ОБЗОРЫ | ВЕТЕРИНАРНАЯ МИКРОБИОЛОГИЯ
Листериоз является одним из наиболее тяжело протекающих заболеваний пищеварительного тракта вовсем мире. Листерии поражают различные группы животных и птиц. Возбудитель выявлен в мясе, молоке, рыбе и рыбопродуктах. Отмечается сезонность заболевания в весенний и осенний периоды. Достоверно установлено, что бактерия Listeria monocytogenes свободно обитает в окружающей среде. Listeria monocytogenes является факультативным внутриклеточным патогеном, заражение которым у животных и людей приводит к инвазивному заболеванию, передающемуся фекально-оральным путем от животного к человеку, от матери к плоду. Патогенез листериозной инфекции хорошо изучен. Желудочно-кишечный тракт является местом транзита и распространения патогенных листерий. Инкубационный период листериозной инфекции длится 20–30 дней у животных и людей. Клиническое течение у различных видов животных, и в том числе птиц, имеет ряд особенностей. Листерии успешно преодолевают кишечный, плацентарный, гематоэнцефалический барьеры. При листериозе отмечается энцефалит, менингит, гастрит, менингоэнцефалит, маститы, аборты, эндометриты и др. Патогенные виды листерий обладают гемолитической активностью, которая отсутствует у непатогенных видов (исключение – Listeria seeligeri). В обзоре представлена актуальная информация о классификации листерий, факторах патогенности Listeria monocytogenes как основного патогена, механизмах протекания листериозной инфекции у различных видов животных.
Трансплантация фекальной микробиоты представляет собой процедуру, при которой фекалии здорового донора вводятся в кишечник реципиента для восстановления микробного баланса и укрепления иммунной защиты. Главным образом трансплантация фекальной микробиоты обеспечивает увеличение бактериального разнообразия и повышение численности полезных микроорганизмов, что позволяет стабилизировать и поддерживать здоровый микробиом, ингибирующий рост патогенов. В ветеринарии трансплантация фекальной микробиоты рассматривается как потенциальная альтернатива традиционным антибиотикам в условиях нарастающей антибиотикорезистентности. Несмотря на отсутствие единых протоколов, исследования показывают, что процедура трансплантации фекальной микробиоты в ветеринарии может применяться для широкого спектра задач: от профилактики заболеваний до иммуномодуляции. Данная обзорная статья посвящена аспектам применения трансплантации фекальной микробиоты на разных видах животных. Согласно анализу научной литературы, большинство работ по данной теме описывают использование трансплантации фекальной микробиоты в качестве терапевтического средства против такого распространенного патологического состояния в ветеринарии, как диарея. Также интересно, что методика успешно применялась для лечения атопического дерматита у собак и мониторинга возрастных изменений у рыб, что подтверждает универсальность данной процедуры. Есть исследования, в которых трансплантация фекальной микробиоты проявляет эффективность частично или не проявляет вовсе. Научные данные свидетельствуют о том, что результативность трансплантации фекальной микробиоты зависит от таких факторов, как способ введения фекального материала и выбор донора, причем первый аспект может по-разному влиять на эффективность терапии в зависимости от вида исследуемого животного. Влияние второго фактора на успешность проведения трансплантации наиболее полно изучено для телят. Необходимы дальнейшие исследования механизмов воздействия трансплантации фекальной микробиоты на разных животных и разработка стандартов, которые могли бы обеспечить широкое и безопасное применение методики в ветеринарии.
ОБЗОРЫ | ЭПИЗООТОЛОГИЯ
Во всех странах мира основной причиной массовых гастроэнтеритов новорожденных телят являются возбудители вирусной природы. Диарея в ранний постнатальный период, как основная причина заболеваемости и смертности молодняка, вызывает серьезные проблемы в промышленном скотоводстве и причиняет значительный экономический ущерб. Наиболее распространенными возбудителями вирусного гастроэнтерита у телят являются ротавирусы, коронавирусы и пестивирусы, наряду с которыми все чаще выявляют астровирусы. Представители семейства Astroviridae способны вызывать у животных различные патологии: у птиц – энтерит, гепатит и нефрит, у млекопитающих – гастроэнтерит, неврологические синдромы и энцефалит. Доказана роль данных вирусов в этиологии респираторной патологии животных. Естественными хозяевами астровируса являются: крупный и мелкий рогатый скот, верблюды, олени, яки, косули, буйволы, альпаки, свиньи, дикие кабаны. Возбудитель был выявлен у летучих мышей, грызунов и морских млекопитающих, а также в моллюсках. В настоящее время список животных, восприимчивых к астровирусной инфекции, расширился более чем до 80 видов из 22 семейств, включая домашних, синантропных и диких животных, птиц и млекопитающих, обитающих в наземной и водной среде. В последнее время увеличивается количество свидетельств о появлении изолятов астровируса с рекомбинациями, что способствует возникновению новых генетических вариантов возбудителя. Большое разнообразие видов инфицированных животных, генетическое разнообразие вируса и случаи рекомбинации указывают либо на межвидовую передачу и последующую адаптацию вируса к новым хозяевам, либо на коинфекцию одного и того жехозяина разными генотипами возбудителя, что может приводить к появлению новых астровирусов, способных заражать животных или имеющих зоонозный потенциал. Астровирусная инфекция не обладает клиническими особенностями, позволяющими дифференцировать ее от других кишечных инфекций. Представленные данные указывают на необходимость учета астровирусной инфекции при исследовании проб патологического материала от больных диареей новорожденных телят, ягнят, козлят и поросят в промышленных хозяйствах страны.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ КРУПНОГО РОГАТОГО СКОТА
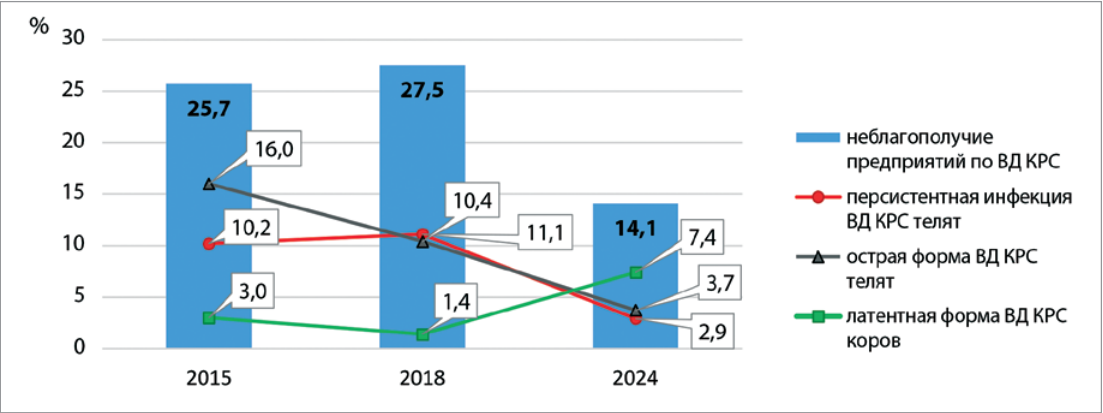
Представлены результаты комплексных исследований вируса диареи крупного рогатого скота, циркулирующего в популяциях крупного рогатого скота на территории Свердловской области. В период с 2018 по 2024 г. с помощью полимеразной цепной реакции было исследовано 113 проб биологического материала, при этом специфические участки РНК вируса были обнаружены в 15,9% случаев. Геном возбудителя вирусной диареи крупного рогатого скота был выделен из биологических проб, полученных от абортировавших коров (61,1%) и молодняка до 1 месяца (38,9%). В результате типирования обнаруженные в 4 пробах (смывы из носоглотки телят, суспензия из органов абортированных плодов и плаценты) изоляты вируса были отнесены к вирулентным генотипам BVDV-1. В 44% проб влагалищных смывов от абортировавших коров и единично в плаценте и паренхиматозных органах от павших телят одновременно выявляли РНК BVDV, ДНК Mycoplasma bovis и Chlamydophila pecorum; в 16% проб патматериала от павших телят – РНК BVDV и ДНК Bovine herpesvirus 1-го типа. В единичных случаях в смывах из носоглотки телят обнаруживали РНК BVDV, ДНК Chlamydophila pecorum и Mycoplasma bovigenitalium. Внедренная в 2018 г. на территории Свердловской области «Комплексная программа биологической защиты и оздоровления сельскохозяйственных организаций от вирусной диареи крупного рогатого скота» привела к снижению количества сельскохозяйственных предприятий, неблагополучных по вирусной диарее крупного рогатого скота. Острая и персистентная форма инфекций среди молодняка регистрировалась в 4 и 3,5 раза реже соответственно, но при этом отмечали увеличение в 2,5 раза диагностируемой латентной формы течения болезни у взрослого поголовья, что связано с увеличением количества проводимых лабораторных исследований.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ МЕЛКОГО РОГАТОГО СКОТА
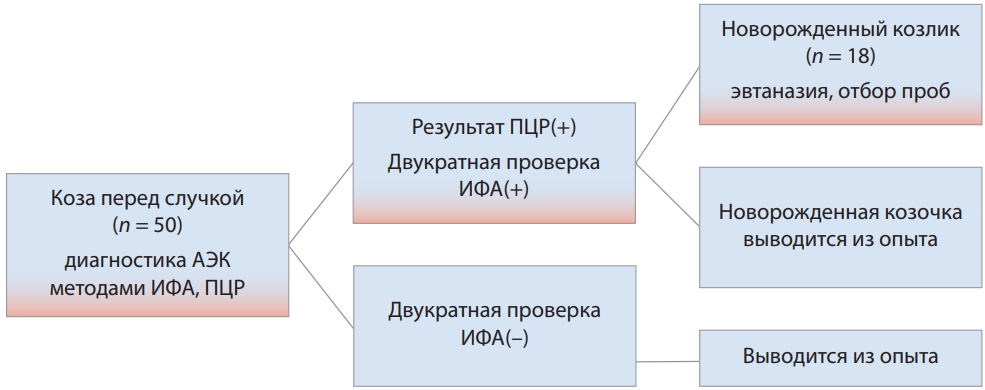
Вирусный артрит-энцефалит коз является серьезной проблемой современного козоводства как в России, так и за рубежом. Заболевание достаточно широко распространено на территории нашей страны, нанося серьезный экономический ущерб владельцам личных подсобных и крестьянских фермерских хозяйств. Этиологическим фактором артрита-энцефалита коз является вирус семейства Retroviridae, входящий в группу лентивирусов мелких жвачных животных, разделенных на пять генетических групп. Своевременной диагностике данного заболевания мешает ряд причин, например, отсутствие нормативно-правовой базы, регулирующей проведение профилактических мероприятий, длительное бессимптомное вирусоносительство возбудителя инфекции, отсутствие патогномоничной симптоматики. Выделяют два пути распространения вируса артрита-энцефалита коз: вертикальный (лактогенный), при котором фактором передачи служит молозиво или молоко от серопозитивной козы, и горизонтальный – от больного животного здоровому при скученном содержании, кормлении из общих поилок и кормушек, а также при половом контакте. В отношении возможности внутриутробной передачи вируса от матери плоду информация, приведенная в литературных источниках, диаметрально отличается. Целью данного исследования было изучить возможность внутриутробного заражения вирусом артрита-энцефалита коз. В опыте использовали сукозных коз с подтвержденным методами иммуноферментного анализа и полимеразной цепной реакции диагнозом «вирусный артрит-энцефалит коз». От новорожденных козлят, полученных методом стерильных родов, брали патологический материал и с помощью полимеразной цепной реакции исследовали на наличие возбудителя артритаэнцефалита коз. Ни в одном из исследованных образцов вирус артрита-энцефалита коз не обнаружен, что доказывает отсутствие факта внутриутробной передачи вируса от больной матери плоду. Косвенным доказательством этого служат результаты многолетнего наблюдения за поголовьем коз, содержащихся в двух личных подсобных хозяйствах, расположенных в Южном федеральном округе и Новосибирской области. Владельцы данных хозяйств, где охват поголовья вирусным артритом-энцефалитом составлял 100%, приняли решение провести комплекс оздоровительных мероприятий. Применение технологиистерильныхокотовспоследующимвыкармливаниемкозлятпастеризованнымпритемпературе 60 °С в течение 30 мин молозивом и молоком с дальнейшим использованием заменителя цельного молока позволило в течение двух лет получить свободное от артрита-энцефалита коз поголовье без существенных экономических потерь и покупки здоровых животных в других хозяйствах.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ СВИНЕЙ
Африканская чума свиней (АЧС) – это геморрагическая вирусная болезнь, которая вызывает серьезные санитарные и экономические последствия из-за высокого уровня смертности животных, карантинных мероприятий и ограничений международной торговли продукцией свиноводства. Вирус АЧС поражает исключительно домашних и диких свиней семейства Suidae всех пород и возрастных групп. До настоящего времени безопасные и эффективные средства специфической защиты против АЧС не разработаны, но в последние годы достигнут определенный прогресс в исследованиях по разработке вакцин первого поколения на основе модифицированного живого вируса, которые ограниченно использовали в некоторых странах Юго-Восточной Азии. Расширение их применения сдерживается в том числе из-за отсутствия международных и государственных рекомендаций (требований) по оценке чистоты, активности, безопасности и эффективности кандидатных вакцин против АЧС. Клинические признаки болезни являются одним из основных показателей безопасности и эффективности кандидатных вакцин против АЧС на основе модифицированного живого вируса. Целью данного исследования являлась разработка системы балльной оценки клинических признаков, пригодной для использования при характеристике вновь выделенных изолятов вируса АЧС, вызывающих различные формы течения болезни, а также при определении безопасности и эффективности кандидатных вакцин, изготовленных на основе модифицированного живого вируса. Предложено учитывать 7 преобладающих клинических признаков: повышение температуры тела, снижение активности, снижение аппетита, поражение кожных покровов, поражение суставов, нарушение дыхания, поражение центральной нервной системы, – каждый из которых оценивается от 0 до 3 или 4 баллов. В результате исследования двенадцати штаммов вируса АЧС различной вирулентности установлено, что при острой и подострой формах АЧС максимальные суммы баллов клинических признаков составляли от 13 до 22, при хронической форме – от 6 до 18, при субклинической – от 0 до 8.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ МЕЛКИХ ДОМАШНИХ ЖИВОТНЫХ
Аденовирусная инфекция собак, вызванная аденовирусом 2-го серотипа, является преимущественно респираторным заболеванием, которое классически проявляется поражением органов дыхательной системы. Заболеваемость собак инфекционным ларинготрахеитом наиболее часто регистрируется в центральной части Российской Федерации и имеет тенденцию к росту. В связи с этим сохраняется актуальность профилактической иммунизации против данного заболевания. В первую очередь для формирования длительного и напряженного иммунитета у животных при изготовлении вакцины необходимо использовать штаммы вируса, распространенные на конкретной территории и актуальные на данный отрезок времени. Целью данного исследования являлось выделение возбудителя аденовироза собак 2-го типа из биологического материала от животных с признаками аденовирусной инфекции, обладающего устойчивостью на протяжении пяти и более пассажей, а также определение параметров его культивирования. В результате эксперимента было выделено пять изолятов вируса, один из которых обладал оптимальными свойствами для использования при производстве вакцинных препаратов. При проведении сравнительного анализа чувствительности к выделенному вирусу перевиваемых культур клеток Vero, MDCK линий NBL-2 и NBL-9, а также первично трипсинизированных культур клеток (почка щенка, селезенка щенка, почка котенка, селезенка котенка) было установлено, что наиболее чувствительной является клеточная культура MDCK линии NBL-2. Следующим этапом было определение параметров культивирования вируса в данной культуре клеток. В результате установлены оптимальные условия, при которых происходит накопление вируса в максимальных титрах: возраст монослоя культуры клеток для заражения – 48 ч, множественность заражения – 0,01 ТЦД50/кл, время предварительного контакта – 60 мин, температура – (37,0 ± 0,5) °С, срок культивирования – 120 ч.
ОРИГИНАЛЬНЫЕ СТАТЬИ | ВЕТЕРИНАРНАЯ МИКРОБИОЛОГИЯ
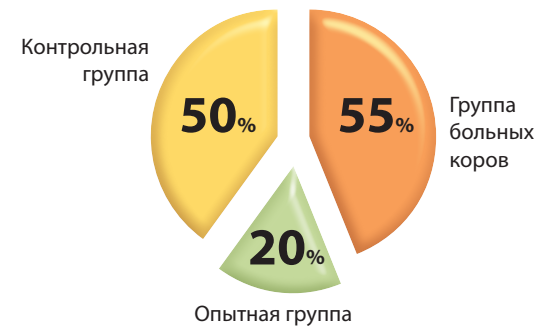
Высокая контагиозность стафилококковых инфекций и появление антибиотикоустойчивых штаммов микроорганизмов диктует необходимость поиска и разработки новых высокоэффективных средств лечения и профилактики инфекционных болезней животных. Для опытной и контрольной групп отобраны взрослые стельные коровы черно-пестрой породы по 10 гол. в каждой. Животным опытной группы вакцину вводили подкожно в область средней трети шеи двукратно: первую дозу в объеме 3 см3 – 55–70 дней до отела, вторую – за 25–30 дней до предполагаемого отела в томже объеме. Животным контрольной группы подкожно вводили стерильный физиологический раствор в сопоставимом объеме и с тем же интервалом. Для изучения антигенной активности вакцины в отношении Staphylococcus aureus у животных обеих групп отбирали кровь: в опытной группе – через 14–16 сут после двукратной иммунизации, в контрольной группе – через 14–16 сут после двукратного введения животным стерильного физиологического раствора. Для проведения бактериологического исследования пробы молока в обеих группах отбирали в первый месяц лактации коров после отела. Как показали результаты серологических исследований, в опытной группе коров титр антител к Staphylococcus aureus колебался от 4,01 до 4,61 lg, его среднее значение составило (4,34 ± 0,06) lg. В контрольной группе животных средние значения титра антител к Staphylococcus aureus были в 5,8 раза ниже и составили (0,75 ± 0,09) lg с колебаниями от 0,3 до 1,2 lg. В результате бактериологических исследований молока в контрольной группе Staphylococcus aureus выделили в 5 из 10 образцов, что составило 50%. В опытной группе возбудитель был обнаружен в 20% случаев, что в 2,5 раза ниже по сравнению с контрольной группой.
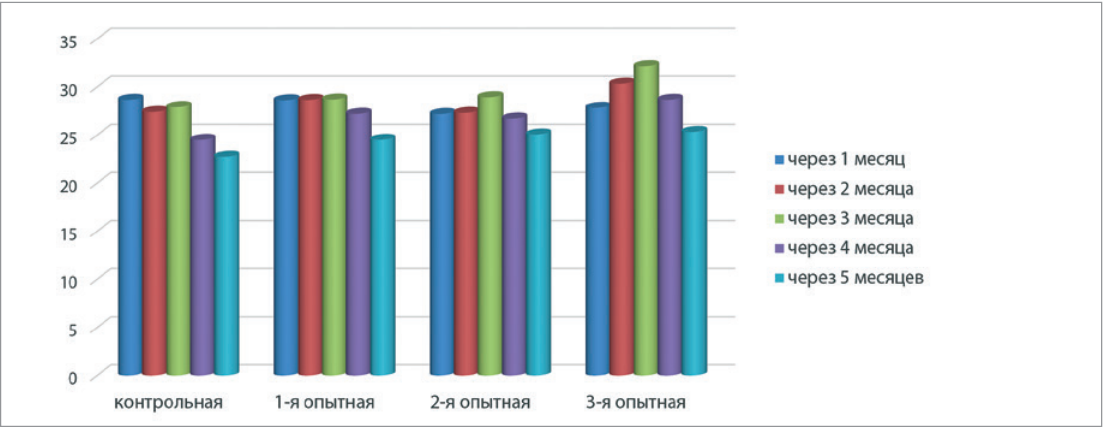
Целью исследований явилось изучение показателей иммунного статуса и продуктивности у коров при применении композиции, содержащей живые бактерии Bacillus subtilis штаммов B-239906 и B-249909 и их метаболиты, в транзитный период. Животным опытных групп (по 10 гол. в каждой) композицию применяли: в течение 14 дней до отела (1-я группа), 14 дней после отела (2-я группа), 14 дней до и 14 после отела (3-я группа). Четвертая группа (n = 10) была контрольной. У коров контрольной и 2-й опытной групп на 14-й и 28-й дни после отела относительное содержание Т-лимфоцитов в крови по сравнению с уровнем в первые сутки после отела достоверно не изменялось, в то время как у особей 1-й и 3-й групп данный показатель возрастал на протяжении всего опыта в 1,2–1,6 раза. Во всех группах коров динамика относительного числа В-лимфоцитов за период наблюдений была аналогичной: увеличение к 14-му дню и сокращение к 28-му дню. Фагоцитарная активность нейтрофилов у животных всех групп изменялась незначительно. Фагоцитарный индекс при этом возрастал в 2,5–3,2 раза на протяжении всего эксперимента, что свидетельствовало о повышении неспецифической резистентности организма. Пик молочной продуктивности регистрировали у коров всех опытных групп на 90-й день лактации. Максимальные значения (32,17 ± 3,33 кг) отмечали в 3-й группе. За 150 дней наблюдений среднесуточные удои у животных опытных групп составили: 24,50 ± 4,15 кг в 1-й; 25,07 ± 4,38 кг в 2-й; 25,33 ± 2,52 кг в 3-й и 22,75 ± 8,82 кг вконтрольной. Уровень массовой доли жира вмолоке у коров всех групп не имел статистически значимых различий на протяжении всего периода наблюдений.
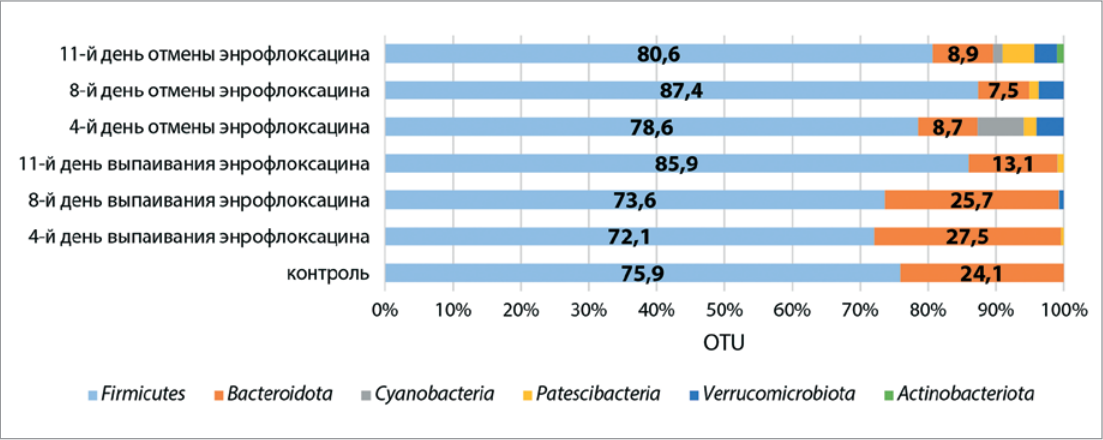
Биологическое разнообразие кишечной микробиоты представляет собой важный экологический ресурс, который играет ключевую роль в поддержании гомеостаза организма хозяина. Исключительно важное значение имеет сохранение существующего биоразнообразия кишечной микробиоты, которое обеспечивает ее устойчивость к негативному действию абиотических факторов, а исследование роли антибиотиков в нарушении биоразнообразия микробиомов является фундаментальной основой не только для выявления аспектов возникновения микробиом-ассоциированных болезней птицы, но и освоения методов управления микробиомами. В данном исследовании представлена характеристика биоразнообразия микробиома кишечника птицы дои после медикаментозной нагрузки антибиотиком на основе биоинформатического анализа секвенирования гена 16S рРНК. Наибольшее количество прочтений в микробиоме цыплят в период выпаивания антибиотика и после его отмены составляли типы Firmicutes и Bacteroidota. Значительное увеличение Patescibacteria было отмечено на 11-й день отмены энрофлоксацина. Появление Actinobacteriota наблюдали на 11-й день после отмены выпаивания антибиотика. Увеличение Cyanobacteria выявлено на 4-й день после отмены препарата. Таксономические сдвиги в микробиоме цыплят на уровне классов как в период выпаивания антибиотика, так и после его отмены проявились тенденцией к снижению относительной доли представителей классов Clostridia и Bacteroidia, а также тенденцией к увеличению доли класса Bacilli, особенно на 8-й день после отмены препарата. Установлено, что десятидневный курс выпаивания энрофлоксацина в рекомендуемой дозе приводит к увеличению в микробиоме доли семейств Bacillaceae, Gastranaerophilales, Lactobacillaceae, Bacteroidaceae, Bifidobacteriaceae, снижению относительной численности семейств Rikenellaceae, Erysipelatoclostridiaceae, Clostridiaceae, Ruminococcaceae и не влияет на колебания относительной численности семейства Lachnospiraceae. Выявленное увеличение доли Lactobacillaceae при использовании антибиотика можетговорить о возможностях здорового организма восстанавливать микробиоту самостоятельно. Результаты биоинформатического анализа метагеномных данных (без отсечения) показали присутствие в микробиоме цыплят 158 видов микроорганизмов, 38% из которых были отнесены к некультивируемым.
ОРИГИНАЛЬНЫЕ СТАТЬИ | ОБЩИЕ ВОПРОСЫ
Целью исследования явилось изучение влияния специфического иммуномодулятора КИМ-М2 на морфоструктуру клеток печени морских свинок, зараженных нетуберкулезными микобактериями. Работа проведена в лаборатории диагностических исследований и биотехнологии отдела ветеринарии ФГБНУ «Омский аграрный научный центр» на поголовье из 15 морских свинок, отобранных по гендерному признаку. Все животные находились в условиях специализированного вивария со стандартным режимом содержания и кормления. Опытных животных разделили на 3 группы по 5 гол. в каждой: 1-я – контроль заражения (Mycobacterium scrofulaceum), 2-я – экспериментальная (Mycobacterium scrofulaceum и КИМ-М2), 3-я – чистый контроль (физиологический раствор). На 30-е сут после начала эксперимента животных выводили из опыта, отбирали биоптаты печени и готовили гистологические препараты по классической методике. В ходе эксперимента установлено, что КИМ-М2 оказывает регенеративное действие на печеночную ткань зараженных нетуберкулезными микобактериями морских свинок, обусловленное увеличением в 1,5 раза количества одноядерных гепатоцитов, увеличением в 3 раза двухъядерных клеток иуменьшением в 4,3 раза безъядерных гепатоцитов, что указывает на проявление компенсаторных реакций в органе и увеличение глубины регенеративных процессов. У животных 1-й группы увеличение площади ядра и цитоплазмы в 1,8 и 1,3 раза в сравнении с особями 2-й группы и увеличение соответственно в 2,7 и 2 раза по сравнению с животными из контрольной группы свидетельствует о запуске механизмов накопления потенциальных репаративных резервов и увеличении их глубины в тканях печени.
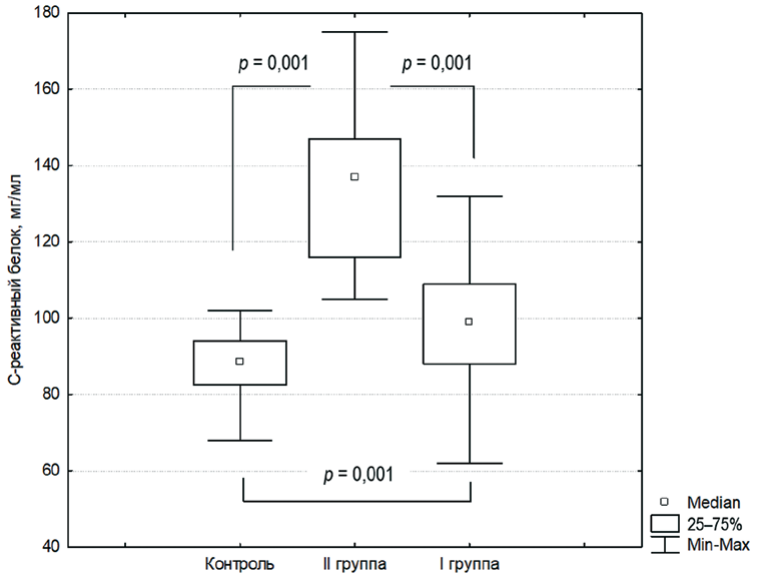
В последнее время ветеринарными специалистами отмечается коморбидное течение заболеваний сердца и почек – кардиоренальный синдром. Обычно кардиоренальный синдром определяется как дисфункция первично интактной почки под воздействием комплекса патогенетических повреждающих факторов, возникающих на фоне основного кардиозаболевания. Цель работы – изучить биохимический профиль сыворотки крови у кошек при кардиоренальном синдроме, возникшем на фоне гипертрофической кардиомиопатии. Исследования проводили на 24 физиологически здоровых (контроль), 24 больных с неосложненными формами патологии (I группа) и 25 больных гипертрофической кардиомиопатией, осложненной кардиоренальным синдромом (II группа), кошках. Показано, что кардиоренальный синдром у животных может возникать как осложнение гипертрофической кардиомиопатии. Биохимическими исследованиями у больных кардиоренальным синдромом кошек верифицированы: цитолиз кардиомиоцитов (повышение сывороточной активности лактатдегидрогеназы в 2,69 раза, креатинфосфокиназы в 2,02 раза, увеличение сывороточной концентрации сердечного тропонина в 5,20 раза по сравнению со здоровыми животными), азотемия (повышение концентрации в сыворотке крови креатинина в 2,72 раза, мочевины в 2,94 раза, симметричного диметиларгинина в 2,60 раза и цистатина С в 1,90 раза по сравнению со здоровыми животными), усиленный кетогенез, системный воспалительный процесс (повышение сывороточной концентрации С-реактивного белка в 1,55 раза по сравнению со здоровыми животными), гиперхолестеринемия, оксидативный стресс (снижение сывороточной активности супероксиддисмутазы в 1,63 раза, каталазы в 4,67 раза и глутатионпероксидазы в 1,71 раза, повышение концентрации малонового диальдегида в 1,79 раза, церулоплазмина в 2,50 раза и диеновых конъюгатов в 1,85 раза по сравнению со здоровыми животными), электролитный дисбаланс в виде гиперкалиемии, гипонатриемии, гиперфосфатемии и гипомагниемии. Надежными диагностическими маркерами наличия кардиоренального синдрома можно считать такие биохимические показатели, как концентрация в сыворотке крови креатинина, тропонина I, цистатина С, симметричного диметиларгинина и С-реактивного белка.
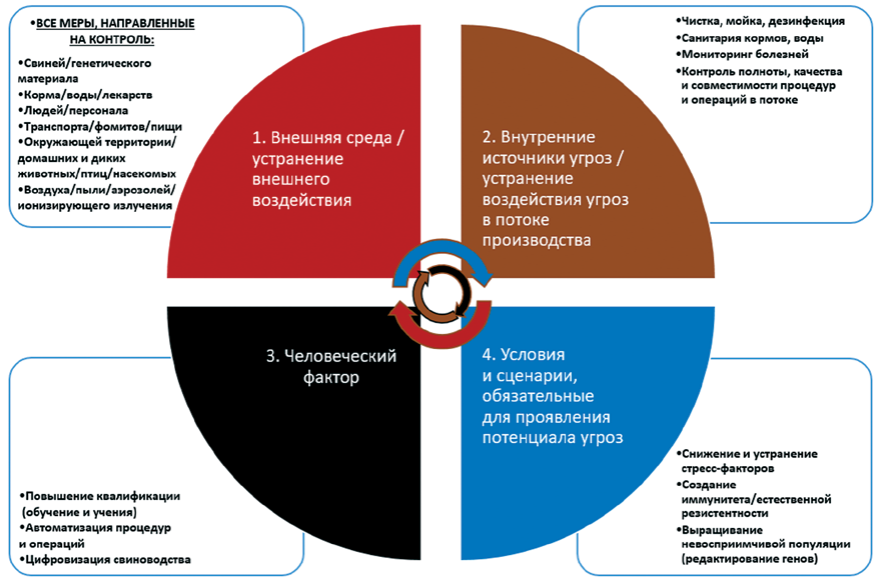
Проведен анализ ситуации по управлению основными значимыми для промышленного свиноводства Российской Федерации эпизоотическими угрозами. Рассмотрены особенности и эффективность различных мер, используемых в системах биозащиты свиноводческих предприятий, и возможные пути их улучшения. Обсуждение путей развития мер биозащиты свиноводческих предприятий и систем в Российской Федерации, способных повлиять на защищенность популяции, вели по четырем направлениям, связанным с путями заноса и распространения инфекций: изолированность популяции от внешних источников угроз (устранение вероятных сценариев воздействия из внешней среды); изолированность популяции от внутренних источников угроз (устранение вероятных сценариев воздействия в потоке производства); изолированность популяции или системы свиноводства от воздействия человеческого фактора (устранение вероятных сценариев воздействия на популяцию человеческого фактора); изолированность популяции от условий, при которых проявлен потенциал угроз (изменение условий). Результаты анализа представили графически в виде принципиальной схемы «Источники угроз для систем биозащиты и меры, направленные на эти источники для формирования защищенной популяции в промышленном свиноводстве». По итогам обсуждения сделано заключение, что автоматизация и цифровизация всех процессов в свиноводстве, создание и внедрение в производство генетически модифицированных свиней, не восприимчивых к таким наиболее значимымвозбудителям, как вирусы африканской чумы свиней, классической чумы свиней, репродуктивно-респираторного синдрома свиней, дальнейшие исследования и внедрение комплексных технологичных решений по санитарии кормов представляются на сегодня эволюционно значимыми путями, которые позволят эффективно интенсифицировать свиноводство в Российской Федерации.
ISSN 2658-6959 (Online)