ОБЗОРЫ | БОЛЕЗНИ МЕЛКИХ ДОМАШНИХ ЖИВОТНЫХ
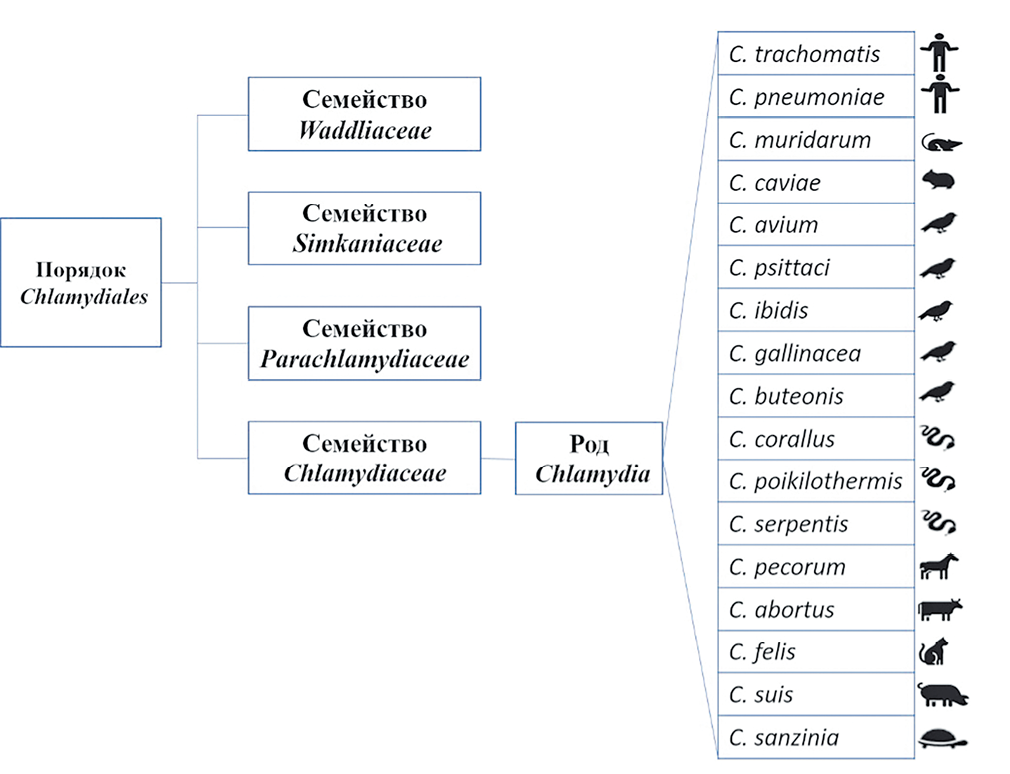
Введение. Хламидиоз кошек – болезнь, вызываемая Chlamydia felis, характеризуется конъюнктивитом (одно- или двухсторонним), слезотечением, поражением респираторного и репродуктивного трактов. Данный возбудитель относится к грамотрицательным бактериям со строго облигатным внутриклеточным паразитизмом, однако в начале 40-х гг. ХХ века хламидии считали промежуточным звеном между вирусами и бактериями. До 1960-х гг. из-за малых размеров и неспособности развиваться на искусственных питательных средах хламидии классифицировали как вирусы. Необычный цикл развития, состоящий из двух фаз, позволяет возбудителю долгое время персистировать в организме животного или человека без клинических проявлений. Лечение хламидиоза должно быть системным и затрагивать как этиологическую терапию (применение антибиотиков), так и симптоматическую. Иммунитет против хламидиоза слабый, клеточный иммунитет имеет большее значение, чем гуморальный. В настоящее время на рынке представлены аттенуированные и инактивированные вакцины, позволяющие защитить от клинического проявления болезни, но не от заражения. Распространен хламидиоз практически повсеместно, при этом заметна тенденция к росту выявляемости из года в год.
Цель исследования. Актуализация и систематизация данных по хламидиозу кошек, вызываемому Chlamydia felis.
Результаты. В статье обозреваются данные о распространенности хламидиоза кошек в мире. Рассмотрены биологические свойс тва описываемого инфекционного агента, клинические признаки хламидиоза кошек и патолого- анатомическая картина, приведены данные об иммунитете, освещаются меры контроля болезни.
Заключение. Chlamydia felis является распространенным патогеном, способным поражать не только кошек и других животных, но и человека, то есть имеющим зоонозный потенциал. Сложный цикл развития, наличие способности обходить иммунитет хозяина, продолжительная персистенция в организме усложняет его эрадикацию. Длительный курс лечения и переход в хроническую форму снижают качество жизни животных-к омпаньонов и создают угрозу передачи патогена человеку. Для разработки схем успешного лечения и профилактики хламидиоза требуется более детальное практическое изучение Chlamydia felis.
ОРИГИНАЛЬНЫЕ СТАТЬИ | ЯЩУР
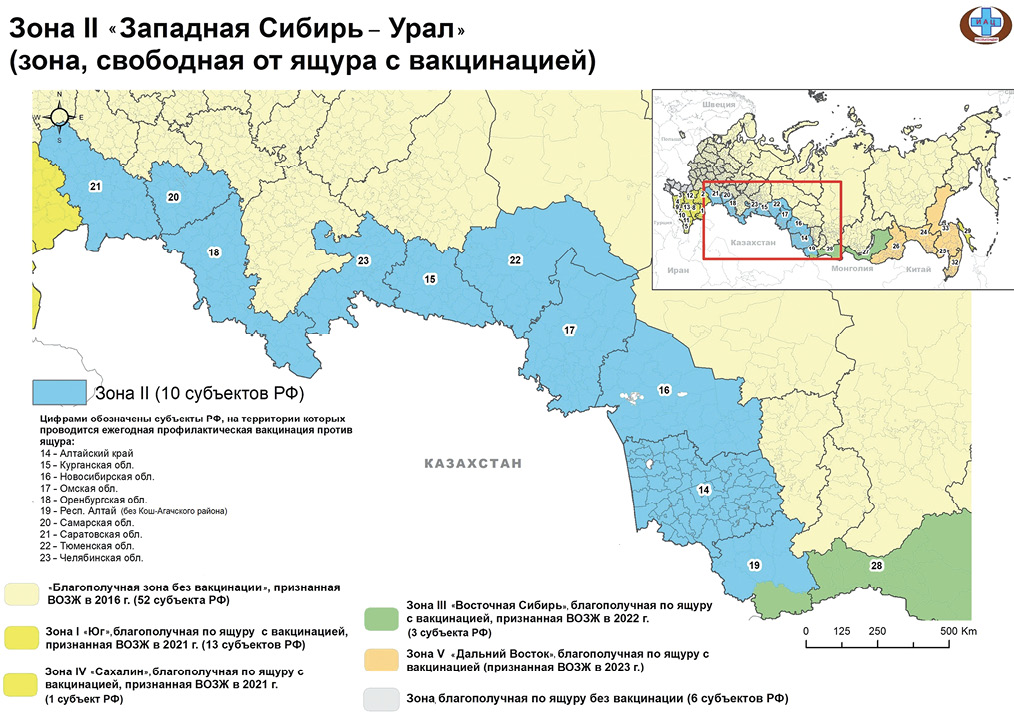
Введение. К числу основополагающих угроз, оказывающих влияние на состояние мировой эпизоотической обстановки и на межгосударственные экономические взаимоотношения, относится ящур – заболевание, подлежащее обязательной нотификации во Всемирную организацию здравоохранения животных (ВОЗЖ). Большая часть территории Российской Федерации (50 субъектов и 2 города федерального значения) в 2016 г. была признана ВОЗЖ зоной, свободной от ящура без вакцинации. Еще 4 зонам нашей страны в период с 2021 по 2023 г. присвоен статус свободы от ящура с вакцинацией. На конец 2024 г. официальное признание данного статуса отсутствовало лишь для 10 субъектов Российской Федерации, входящих в зону «Западная Сибирь – Урал». Цель исследования. Описательный анализ эпизоотической обстановки по ящуру в Российской Федерации в период с 2021 по 2024 г.; аргументация успешности системного подхода Россельхознадзора к регионализации в соответствии с положениями Кодекса здоровья наземных животных ВОЗЖ.
Материалы и методы. Для сбора и последующего анализа информационных материалов по эпизоотической ситуации по ящуру в России использованы различные источники, в том числе архивные материалы СССР, ветеринарная отчетность и статистические данные ВОЗЖ.
Результаты. Проведен анализ эпизоотической ситуации по ящуру в 10 субъектах Российской Федерации, граничащих с Республикой Казахстан, с акцентом на меры контроля, регионализации и зонирования по ящуру. Рассматривается статусное распределение административных субъектов Российской Федерации и исторические данные о вспышках заболевания. Описаны нормативные действия и регламентирующие меры, реализуемые Федеральной службой по ветеринарному и фитосанитарному надзору (Россельхознадзор) в отношении регулирования зоосанитарного статуса по ящуру в регионах с учетом проводимых профилактических мероприятий. Изучена последовательность этих мероприятий и их результаты в динамике совершенствования надзорных мер по ящуру.
Заключение. 29 мая 2025 г. на 92-й Генеральной сессии Всемирной ассамблеи делегатов ВОЗЖ зона «Западная Сибирь – Урал» официально признана зоной, свободной от ящура с вакцинацией. Это решение завершает структурирование регионов Российской Федерации на шесть зон. Статусы благополучия ВОЗЖ подтверждают эффективность профилактических и надзорных мер, что важно для глобальной эпизоотической стабильности. Эти достижения – результат совместной работы Россельхознадзора и подведомственного Федерального центра охраны здоровья животных.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ КРУПНОГО РОГАТОГО СКОТА
Введение. Проблема лейкоза крупного рогатого скота в племхозах Республики Дагестан стала актуальной еще с середины 60-х годов XX века. В связи с тем, что в те годы охват плановыми серологическими исследованиями не превышал 1–2% имеющегося поголовья восприимчивых животных, ясного представления о масштабах распространения лейкоза не было.
Цель исследования. Анализ современной ситуации по распространению лейкоза крупного рогатого скота в племенных хозяйствах Республики Дагестан.
Материалы и методы. Инфицированных вирусом лейкоза животных выявляли c помощью реакции иммунной диффузии в агаровом геле (РИД). Противоэпизоотические мероприятия оценивали с учетом новых «Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов лейкоза крупного рогатого скота», утвержденных приказом Минсельхоза России от 24 марта 2021 г. № 156.
Результаты. Зараженность животных вирусом лейкоза крупного рогатого скота в ретроспективе за 2009–2017 гг. варьировала от 0,1 до 77,3%. С принятием подпрограммы «Профилактика и ликвидация лейкоза крупного рогатого скота в хозяйствах Республики Дагестан» (2018–2020 гг.) в рамках республиканской целевой программы за последние семь лет увеличился охват поголовья серологическими исследованиями более чем в 5,7 раза, частота выявления новых случаев серопозитивных животных снизилась с 23,6 до 0,1% в 2024 г.
Заключение. Эпизоотологический анализ показал неоднородную структуру и динамику распространения лейкозного процесса среди крупного рогатого скота. Реализуемая в условиях Республики Дагестан система мер по предупреждению и ликвидации заболевания крупного рогатого скота лейкозом позволила добиться устойчивой стабилизации эпизоотической обстановки и сократить уровень зараженности животных в племенных хозяйствах. Благодаря проводимой ветеринарной службой планомерной работе по ликвидации вирусной инфекции племхозы сегодня полностью благополучны по лейкозу. Оздоровительная работа, включающая применение серологической диагностики и немедленной выбраковки РИД-позитивных животных, продолжается.
Введение. Респираторные заболевания широко распространены в животноводческих хозяйствах, особенно среди высокопродуктивных животных, при этом достаточно тяжело они протекают у молодняка. Возникновение неспецифической бронхопневмонии у телят связано с комплексом причин, включающим прежде всего условно-п атогенную микробиоту дыхательных путей, которая при неблагоприятных условиях может стать патогенной, а также скученность содержания, несбалансированное кормление, стресс, сквозняки, шум, влияние негативных факторов окружающей среды, а также снижение резистентности и иммунной реактивности новорожденных животных.
Цель исследования. Проведение иммунологического контроля эффективности аэрозольной фитотерапии острой катаральной бронхопневмонии телят.
Материалы и методы. Исследование провели на 1–3-месячных телятах, больных острой катаральной бронхопневмонией (n = 60). Было сформировано три опытные группы по 20 особей в каждой. У больных животных до начала терапии, а также на 7-е и 12-е сут после лечения отбирали кровь для проведения иммунологических исследований.
Результаты. Установлено, что аэрозольное применение фитопрепарата «Экстракт зверобоя продырявленного» в комплексном лечении телят с острой катаральной бронхопневмонией продемонстрировало более высокую эффективность по сравнению с остальными двумя схемами. В опытной группе, где использовали фитотерапию, общее клиническое улучшение наблюдали уже на (4,90 ± 0,64) сут, что на 47,0% быстрее, чем в группе, где лечение животных проводили по общепринятой в хозяйстве схеме. При этом у телят указанной группы аппетит восстанавливался быстрее, они лучше поедали корм, шерсть становилась гладкой и блестящей, показатели клеточного и гуморального иммунитета на 12-е сут, а уровень провоспалительных цитокинов уже на 7-е сут приближались к референсным показателям клинически здоровых животных.
Заключение. Все три терапевтические схемы при борьбе с острой катаральной бронхопневмонией показали относительную эффективность, однако аэрозольное применение фитопрепарата «Экстракт зверобоя продырявленного» в комплексном лечении больных телят продемонстрировало наилучшие результаты, о чем свидетельствуют значительные позитивные сдвиги в клеточном и гуморальном звене иммунитета, а также снижение уровня провоспалительных цитокинов.
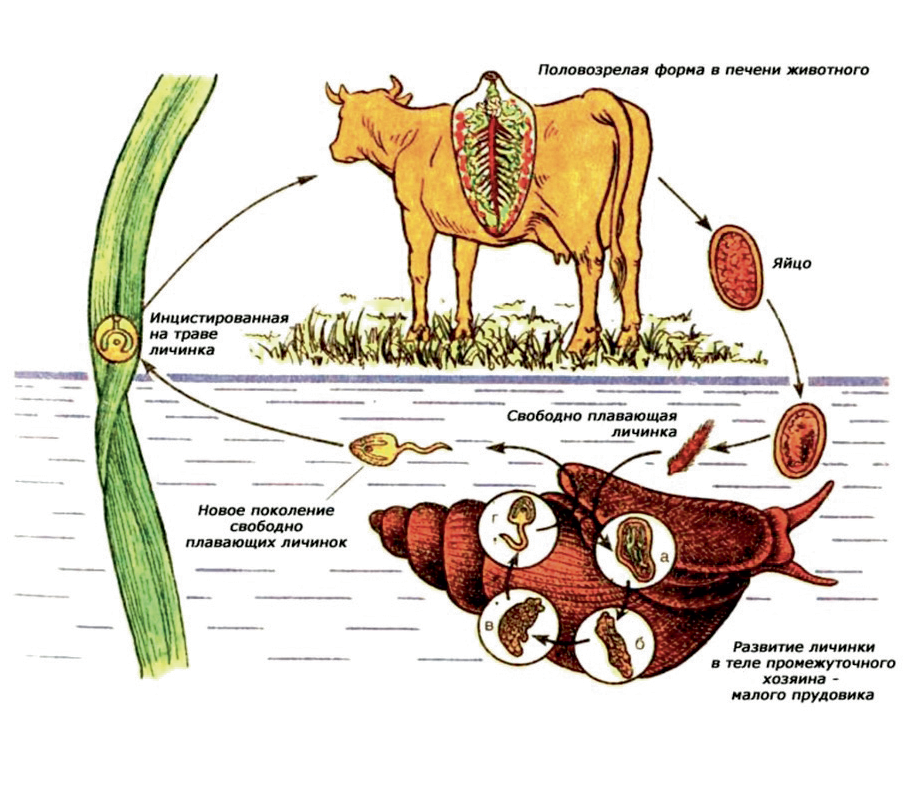
Введение. В равнинных областях Северного Кавказа наблюдается высокая распространенность фасциолеза среди взрослого поголовья буйволов, показатели инвазированности варьируют от 37 до 46%. Сезонная и возрастная динамика зараженности буйволов фасциолами в данном регионе остается невыясненной.
Цель исследования. Изучение сезонной и возрастной динамики фасциолеза буйволов, содержащихся в равнинной зоне Республики Дагестан.
Материалы и методы. Материалом для исследования служили 240 проб фекалий буйволов (в возрасте от года и старше), 20 экземпляров печени и 1428 экземпляров моллюсков семейства прудовиков: Lymnaea palustris, Lymnaea stagnalis, Lymnaea auricularia и Lymnaea truncatula. С целью изучения распространения фасциолеза в равнинном Бабаюртовском районе проведены исследования с использованием прижизненных (копроовоскопия) и посмертных (гельминтологическое вскрытие печени и желчного пузыря) обнаружения паразитов.
Результаты. Установлена высокая степень инвазии взрослых буйволов в равнинной зоне республики. Данный факт объясняется кумулятивным характером заражения, то есть накоплением паразитов в организме животных. Сезонность оказывает значительное влияние на зараженность буйволов фасциолезом. Экстенсивность инвазии достигала пика в декабре (60%) и была минимальной в июне (40%). В период с августа по ноябрь наблюдался заметный рост экстенсивности и интенсивности инвазии, что, по-видимому, связано с увеличением численности промежуточных хозяев паразита на пастбищах в это время года. Взрослые буйволы, обитающие на равнинах, чаще всего и более интенсивно заражались фасциолами. В результате проведенных исследований по инвазированности моллюсков L. palustris, L. stagnalis, L. auricularia и L. truncatula установлено, что только малый и обыкновенный прудовики были заражены личинками фасциол, в то время как другие виды лимнеид оказались свободны от этой трематодозной инвазии.
Заключение. Изучение краевой эпизоотологии фасциолеза буйволов позволит более успешно бороться с данным зоонозным биогельминтозом с учетом особенностей местности и видового состава возбудителей. Знание особенностей жизненного цикла трематод также является важной составляющей в проведении мероприятий по борьбе и профилактике паразитарных болезней.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ МЕЛКОГО РОГАТОГО СКОТА
Введение. Трансграничные и эмерджентные инфекции крупного и мелкого рогатого скота, такие как чума мелких жвачных животных, болезнь Шмалленберга и другие, в условиях развивающейся глобализации представляют серьезную эпизоотическую и экономическую угрозу. С учетом текущей геополитической обстановки необходимость в современных диагностических системах отечественного производства ощущается особенно остро. Подобные системы могут быть разработаны с использованием методов генной инженерии.
Цель исследования. Анализ отечественных и зарубежных публикаций, посвященных получению рекомбинантных белков возбудителей трансграничных и эмерджентных инфекций крупного и мелкого рогатого скота. Создание на основе обработанных данных генетических конструкций для дальнейшей разработки на их основе диагностических средств, в частности иммуноферментных тест-систем.
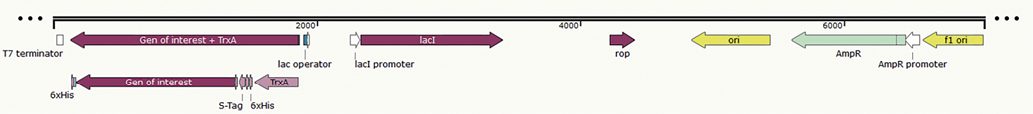
Материалы и методы. При помощи инструментов биоинформатики проведен анализ и оптимизация кодонного состава последовательностей, кодирующих нуклеокапсидные белки вирусов чумы мелких жвачных животных и болезни Шмалленберга. Оптимизированные фрагменты генов были синтезированы de novo и клонированы в экспрессирующий вектор pET-32b(+). Успешность вставки целевой последовательности в вектор подтверждали методом полимеразной цепной реакции и рестрикционного анализа.
Результаты. Представлена информация о разработанных на основе рекомбинантных антигенов иммуноферментных тест-системах для диагностики чумы мелких жвачных животных и болезни Шмалленберга. Освещены основные технологические аспекты получения рекомбинантных антигенов для дальнейшего их использования в диагностической системе с учетом особенностей биологии конкретного инфекционного агента, а также описана собственная методология создания векторов для экспрессии белков возбудителей обозреваемых болезней.
Заключение. Наиболее перспективными для использования в качестве рекомбинантных антигенов в иммуноферментных тест-системах, направленных на выявление антител к вирусам чумы мелких жвачных животных и болезни Шмалленберга, являются полные и усеченные нуклеокапсидные белки вирионов. При этом биофизические свойства и антигенная структура данных белков позволяют получать их в культуре клеток Escherichia coli. Следует отметить, что для получения значительных количеств функциональных белков в растворимой форме может понадобиться их экспрессия в составе слитых белков с повышающими растворимость и облегчающими корректный фолдинг тегами.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ СВИНЕЙ
Введение. Современное свиноводство в России демонстрирует стабильный рост, который сопровождается внедрением новых технологий, направленных на увеличение продуктивности и снижение зависимости от антибиотиков. Это вызывает повышенный интерес к биологически активным препаратам, обладающим иммуностимулирующими и иммуномодулирующими свойствами. Множество исследований подтверждают их положительное влияние на кишечную микрофлору, иммунный статус и общую продуктивность животных. Однако морфофункциональные и биохимические аспекты действия этих средств остаются недостаточно изученными, что подчеркивает необходимость дальнейших исследований в этой области.
Цель исследования. На основе анализа существующей литературы и экспериментальных данных обосновать целесообразность использования препарата «Иммбаклиз С», обладающего иммуномодулирующими свой ствами, для поросят в период их доращивания.
Материалы и методы. Исследовали 60 образцов биологического материала (крови), полученного от поросят на доращивании в апреле – июле 2024 г. на свиноводческом комплексе промышленного типа, расположенном на территории Коломенского городского округа Московской области. Исследования проводились методами иммуноферментного анализа, проточной цитометрии, микроскопии. Обработка данных осуществлялась с использованием пакета статистического анализа Statistica v.13.0.
Результаты. Курсовое введение препарата «Иммбаклиз С» поросятам на доращивании в возрасте 22–113 сут обусловило статистически значимое повышение показателей клеточного и гуморального звеньев иммунной системы, включая увеличение абсолютного и относительного содержания Т- и В-лимфоцитов, фагоцитарной активности нейтрофилов, а также концентрации иммуноглобулинов классов G и M, что указывает на активацию специфических и неспецифических механизмов иммунной защиты.
Заключение. Динамика показателей в течение исследуемого периода свидетельствует о накопительном эффекте препарата, особенно в отношении относительного содержания В-лимфоцитов и уровня IgM, что может указывать на его пролонгированное воздействие при многократном применении. Полученные данные позволяют рассматривать «Иммбаклиз С» как эффективное средство иммунопрофилактики, потенциально пригодное для включения в ветеринарные схемы оздоровления и профилактики иммунодефицитных состояний у молодняка свиней, выращиваемого в условиях интенсивных технологий.
ОРИГИНАЛЬНЫЕ СТАТЬИ | БОЛЕЗНИ ПТИЦ
Введение. Ньюкаслская болезнь – высококонтагиозная вирусная инфекция птиц, которая регистрируется во многих странах мира. О случаях инфицирования вирусом ньюкаслской болезни необходимо уведомлять Всемирную организацию здравоохранения животных.
Цель исследования. Проведение в течение 2023–2024 гг. на территории Российской Федерации мониторинговых исследований по ньюкаслской болезни с использованием серологических методов и анализ полученных результатов.
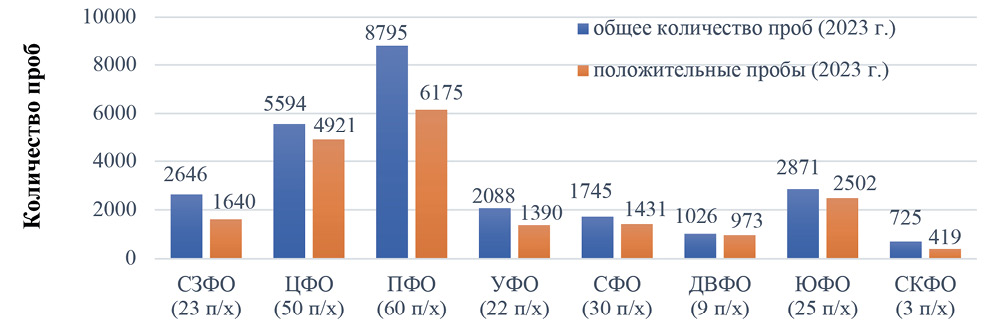
Материалы и методы. Биологический материал (более 66 700 проб сыворотки крови птиц) был отобран территориальными управлениями Россельхознадзора в 74 субъектах Российской Федерации. Исследования выполнены на базе референтной лаборатории вирусных болезней птиц ФГБУ «ВНИИЗЖ» (г. Владимир) с использованием диагностических наборов для выявления антител к вирусу ньюкаслской болезни иммуноферментным методом и в реакции торможения гемагглютинации производства ФГБУ «ВНИИЗЖ».
Результаты. Проведенные исследования показали разную степень серопревалентности у сельскохозяйственной птицы промышленных птицеводческих хозяйств, индивидуального сектора и дикой птицы. Для кур и индеек в промышленных хозяйствах закрытого типа была установлена высокая серопревалентность по ньюкаслской болезни, что связано с массовой вакцинацией птиц против данного заболевания. При этом доля выявленной серопозитивной птицы (в целом по всем видам сельскохозяйственной птицы) была равна 74% в 2023 г. и 81% в 2024 г. В индивидуальном секторе антитела к вирусу ньюкаслской болезни были обнаружены в 35% случаев от числа всех исследованных проб сывороток крови кур и индеек в 2023 г. и в 53% случаев – в 2024 г. Специфические антитела были выявлены также в пробах от вакцинированных цесарок и фазанов и от непривитых гусей и уток. В нескольких регионах Российской Федерации антитела к вирусу ньюкаслской болезни обнаружены у птиц дикой фауны, которые, вероятнее всего, являются естественным резервуаром возбудителя ньюкаслской болезни различной степени патогенности.
Заключение. Таким образом, результаты мониторинговых исследований свидетельствуют о благополучной ситуации по ньюкаслской болезни в промышленных птицеводческих хозяйствах, обусловленной плановой вакцинацией поголовья. В то же время сохраняется угроза заноса и распространения ньюкаслской болезни птиц из неблагополучных индивидуальных хозяйств и дикой фауны.
Введение. Ньюкаслская болезнь птиц входит в перечень нотифицируемых болезней и является актуальной проблемой современного птицеводства. К настоящему времени известно о существовании различных генотипов возбудителя, отличающихся друг от друга по вирулентности. Все больший интерес в последние годы вызывает вирус ньюкаслской болезни генотипа VII, который инициирует тяжелую форму болезни среди кур и других видов коммерческой птицы вплоть до 100%-й летальности поголовья.
Цель исследования. Изучение инфекционного процесса, а также клинических и патолого-анатомических особенностей ньюкаслской болезни птиц при экспериментальном заражении кур разными способами.
Материалы и методы. Провели экспериментальное заражение вирусом ньюкаслской болезни генотипа VII 30-суточных цыплят тремя разными способами: интраназально, перорально и внутримышечно. Через 48 ч после инфицирования в каждую группу поместили по 6 интактных цыплят. В течение последующих 10 сут оценивали клиническое состояние зараженной и контактной птицы, собирали и исследовали методом полимеразной цепной реакции ротоглоточные и клоакальные смывы и проводили патолого-анатомическое вскрытие павшей птицы.
Результаты. В ходе поставленного эксперимента было установлено, что изолят NDV/chicken/rus/Saratov/2403-3/22 вызывает гибель птицы в течение 5–7 сут. При внутримышечном заражении болезнь и гибель птицы наступали быстрее, чем при пероральном и интраназальном инфицировании. В исследованных методом полимеразной цепной реакции образцах ротоглоточных и клоакальных мазков был выявлен геном вируса ньюкаслской болезни. Неспецифические признаки болезни были зафиксированы у всех особей, однако преобладание определенного симптомокомплекса зависело от способа заражения: у птиц, инфицированных внутримышечно и перорально, отмечались ярко выраженные неврологические симптомы; респираторные признаки были характерны при пероральном и интраназальном заражениях. Результаты вскрытия свидетельствуют о том, что специфические патолого-анатомические признаки, характерные для ньюкаслской болезни, развивались после 24 ч с момента начала болезни. У особей, павших ранее, был обнаружен ряд патологических изменений внутренних органов, которые тем не менее не являлись информативными для диагностики ньюкаслской болезни при вскрытии.
Заключение. Штамм вируса ньюкаслской болезни генотипа VII NDV/chicken/rus/Saratov/2403-3/22 является патогенным для кур при экспериментальном инфицировании. Болезнь легко воспроизводится при внутримышечном, интраназальном и пероральном способах заражения и характеризуется молниеносным течением с развитием респираторных и неврологических симптомов.
ОРИГИНАЛЬНЫЕ СТАТЬИ | ВЕТЕРИНАРНАЯ МИКРОБИОЛОГИЯ
Введение. В настоящее время возникла необходимость разработки единой стратегии рациональной антибиотикотерапии, включающей мониторинг чувствительности микроорганизмов, ротацию препаратов и использование альтернативных методов лечения, позволяющих сократить распространение антибиотикорезистентных изолятов бактерий.
Цель исследования. Определение бактериальных патогенов, вызывающих мастит у коров, с оценкой их устойчивости к антимикробным препаратам, применяемым на животноводческом предприятии, расположенном на территории Свердловской области, для последующей ротации антимикробных средств и разработки индивидуальных рекомендаций.
Материалы и методы. Исследования проведены в 2022–2024 гг. на базе сельскохозяйственного предприятия Свердловской области. Идентификацию выросших колоний производили методом MALDI-ToF масс-спектрометрии, чувствительность к антимикробным препаратам определяли диско-диффузионным методом, гены резистентности к антибиотикам выявляли с помощью полимеразной цепной реакции в режиме реального времени.
Результаты. В 2022 г. результаты исследований показали наличие в секрете молочной железы Streptococcus spp. (70,6%), Escherichia coli (52,9%), Staphylococcus aureus (35,3%), Streptococcus agalactiae (23,5%). Изоляты Escherichia coli и Staphylococcus aureus обладали резистентностью к нескольким группам антимикробных препаратов: аминогликозидам, пенициллинам, тетрациклинам и фторхинолонам (ципрофлоксацину), ванкомицину. Установили гены устойчивости: blaDHA, blaCTX-M и blaOXA-10 – у Escherichia coli (5%); ErmB – у группы бактерий Streptococcus (4%); MecA – у Staphylococcus aureus (единично). При повторном исследовании в 2023 г. наблюдали, что все изолированные бактерии (Staphylococcus aureus, Escherichia coli, Enterobacter spp., Streptococcus spp., Enterococcus faecalis/faecium) были чувствительны ко всем антимикробным препаратам. У одного изолята Pseudomonas аeruginosa выявлены гены blaVIM, blaNDM. Результаты, полученные в 2024 г., показали преобладание в пробах секрета молочной железы Escherichia coli и Staphylococcus spp. (100%), Klebsiella pneumonia (30%), Enterobacter spp. (20%), Enterococcus faecalis/faecium (10%). Были выявлены 8 различных генов резистентности к антимикробным препаратам, также обнаружены карбапенем-устойчивые бактерии и ванкомицин-устойчивый Enterococcus spp. (ген VanB). На основе лабораторных исследований, проведенных в 2022–2024 гг. на животноводческом предприятии Свердловской области, разработаны и апробированы меры контроля антимикробной резистентности возбудителей мастита у коров.
Заключение. Замена устаревших схем лечения (тетрациклины, аминогликозиды, цефалоспорины II поколения) на цефалоспорины I/III/IV поколений и фторхинолоны временно снизила резистентность. Возврат к прежним схемам в 2024 г. вызвал резкий рост полирезистентности. В связи с чем даны рекомендации, включающие непрерывный мониторинг резистентности возбудителей, строгое соблюдение ротации антибиотиков, долгосрочное применение схем лечебных мероприятий, внедрение дополнительных молекулярно-генетических методов для детекции генов устойчивости бактерий в целях контроля ситуации на животноводческом предприятии.
Введение. Проблема контаминации пищевых продуктов листериями не теряет своей актуальности. Употребление в пищу обсемененных патогенными бактериями рода Listeria продуктов животного происхождения в сыром или недостаточно термически обработанном виде приводит к заражению человека. По данным Государственного доклада Роспотребнадзора, в 2023 г. в нашей стране было зарегистрировано 100 случаев листериоза, из которых 18 – с летальным исходом. В последние годы наблюдается рост контаминации листериями пищевых продуктов как отечественного, так и зарубежного производства. Таким образом, выявление патогенных видов Listeria в продуктах животного происхождения, пищевом сырье и готовых пищевых продуктах является актуальной задачей.
Цель исследования. Определение контаминации бактериями Listeria monocytogenes продуктов животного происхождения (мясных, рыбных, молочных), произведенных и реализуемых в Нижегородской области в период с 2023 по 2024 г.
Материалы и методы. Исследование проб, а также идентификацию чистой культуры микроорганизмов проводили в соответствии с ГОСТ 32031-2022 «Продукты пищевые. Методы выявления бактерий Listeria monocytogenes и других видов Listeria (Listeria spp.)».
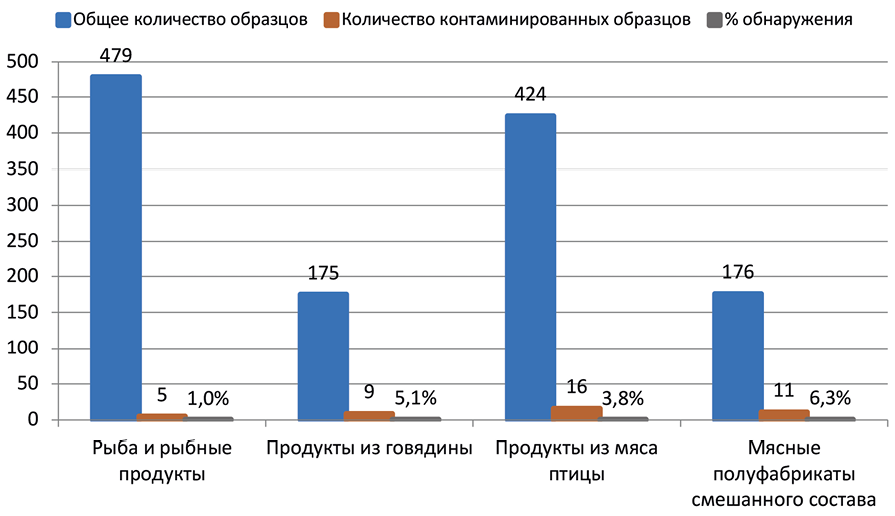
Результаты. При анализе и обобщении полученных данных было показано, что из 3650 исследованных проб бактериями L. monocytogenes были контаминированы 57 образцов (1,6%). В таких категориях продуктов, как полуфабрикаты мясные смешанного состава, продукты из говядины и мяса птицы, было определено наибольшее количество контаминированных проб. При исследовании проб рыбных продуктов инцидентность L. monocytogenes составила 1,1%. Наибольший уровень контаминации отмечен в таких видах продуктов, как фарш говяжий (10,7%), полуфабрикаты из мяса птицы в тестовой оболочке (9,3%), мясо птицы механической обвалки (7,1%), полуфабрикаты крупнокусковые (4,6%) и субпродукты (4,3%) из говядины, полуфабрикаты из мяса птицы рубленые (4,2%).
Заключение. В результате испытаний было установлено, что количество контаминированных проб полуфабрикатов мясных смешанного состава достигло 4,3%, несоответствия требованиям безопасности продуктов из говядины выявлены в 3,7% случаев, 2,8% проб продуктов птицеводства были обсеменены бактериями L. monocytogenes. Количество и процентное соотношение контаминированных проб замороженных и охлажденных продуктов достоверно не различались и составили 0,7 и 0,8% соответственно. Бактерии L. monocytogenes не были выявлены в пробах молочных и готовых мясных продуктов, не требующих термической обработки.
Введение. Производственные объекты животноводческих комплексов являются резервуаром микроорганизмов различных семейств и родов, среди которых есть как условно-патогенные, так и патогенные представители. Постоянный микробиологический мониторинг производственной среды животноводческих помещений, индикация и идентификация микроорганизмов дает возможность контролировать микрофлору данных помещений, тем самым предотвращать риски возникновения инфекционных заболеваний и своевременно проводить качественные ветеринарно-санитарные и зоогигиенические мероприятия.
Цель исследования. Изучение видового состава микроорганизмов производственной среды животноводческих помещений, уровня контаминации и классификация выделенной микрофлоры по семействам и группам устойчивости к дезинфицирующим препаратам.
Материалы и методы. Для изучения видового состава микрофлоры были взяты смывы с поверхностей в производственных помещениях для содержания крупного рогатого скота (коровник – дойное стадо, телятник, родильное отделение и доильный зал), расположенных в животноводческом хозяйстве Омской области. Идентификацию микроорганизмов проводили с использованием биохимических мультимикротестов ММТ Е24 и ММТ С и селективной питательной среды.
Результаты. В результате проведенных исследований установлено, что микрофлору, циркулирующую в помещениях для содержания крупного рогатого скота, составляют как патогенные, так и условно-патогенные микроорганизмы, которые представлены следующими видами: Escherichia coli, Proteus mirabilis, Proteus vulgaris, Klebsiella aerogenes, Citrobacter freundii, Morganella morganii, Hafnia alvei, Klebsiella ozaenae, Enterococcus faecalis, Bacillus cereus, Staphylococcus sciuri, Staphylococcus capitis, Staphylococcus simulans, Staphylococcus intermedius и Staphylococcus lentus.
Заключение. Выделенные микроорганизмы представлены семействами Enterobacteriaceae, Bacillaceae и Staphylococcaceae и принадлежат к следующим группам устойчивости к дезинфектантам: малоустойчивые, устойчивые и особо устойчивые. Наиболее высокая микробиологическая нагрузка наблюдалась на таких объектах, как пол, стены и ограждения в стойлах, расположенных в коровнике (дойное стадо) и доильном зале, микрофлора характеризовалась большим видовым разнообразием микроорганизмов, низкий уровень микробной диссеминации установлен в помещениях родильного отделения и телятника.
ISSN 2658-6959 (Online)