Перейти к:
Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2
https://doi.org/10.29326/2304-196X-2025-14-1-69-75
Аннотация
Введение. Возбудитель новой коронавирусной инфекции (COVID-19) SARS-CoV-2 получил широкое распространение в мире, став причиной пандемии, которая началась в 2019 г. Вирус является зооантропонозным инфекционным агентом, вызывает инфекцию как у человека, так и у многих видов млекопитающих. К настоящему времени имеются сообщения о выявлении SARS-CoV-2 у домашних животных, а также у представителей дикой фауны. Кроме того, проведены исследования по успешному экспериментальному заражению некоторых видов животных. Имеются также доказательства того, что инфицированные особи могут передавать вирус другим животным в естественных условиях при контакте, в том числе между разными видами. В настоящее время ряд исследователей опасается, что SARS-CoV-2 распространится на виды млекопитающих в дикой природе, которые станут природным резервуаром, что может быть причиной вспышек инфекции в популяции людей. При этом воздействие вируса на потенциально восприимчивые виды животных дикой природы, в том числе исчезающие, в настоящее время до конца не изучено. В связи с этим необходимо проводить исследования по изучению распространения данной инфекции среди животных дикой фауны. Для этого требуются высокочувствительные и специфичные диагностические методы. Иммуноферментный анализ с применением в качестве антигена нуклеокапсидного белка SARS-CoV-2 может быть использован для серологического надзора за новой коронавирусной инфекцией среди животных. Применение в качестве антигена рекомбинантного белка является наиболее предпочтительным с точки зрения безопасности.
Цель исследования. Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2 в высокой концентрации и проверка его антигенной активности и специфичности.
Материалы и методы. В работе использовали: SARS-CoV-2, плазмиду pQE, штамм Escherichia coli JM109; осуществляли обратную транскрипцию и полимеразную цепную реакцию, молекулярное клонирование, синтез рекомбинантного белка, очистку рекомбинантного белка, применяли непрямой вариант иммуноферментного анализа.
Результаты. Выполнено молекулярное клонирование N-гена SARS-CoV-2 с использованием прокариотической системы экспрессии. Получены клоны Escherichia coli, продуцирующие рекомбинантный нуклеокапсидный белок SARS-CoV-2 размером 33 кДа. Определены оптимальные условия экспрессии и очистки, обеспечивающие получение препарата антигена в высокой концентрации. Показано, что оптимальной концентрацией индуктора является 0,5 мМ, оптимальный период экспрессии – 4 ч. В результате исследования оптимальных условий очистки рекомбинантного антигена в качестве денатурирующего агента определена мочевина в концентрации 8 М, подобрана оптимальная концентрация имидазола – 0,4 М в элюирующем буфере. Использование оптимальной схемы экспрессии и очистки позволило получить 1,5 мг очищенного антигена с 100 мл культуры Escherichia coli. Показана высокая антигенная активность и специфичность рекомбинантного белка в непрямом варианте иммуноферментного анализа.
Заключение. Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2 в высокой концентрации позволит в перспективе использовать его в качестве антигена при разработке иммуноферментной тест-системы для выявления антител к нуклеокапсидному белку SARS-CoV-2 в сыворотках крови животных.
Для цитирования:
Яковлева А.С., Каньшина А.В., Тимина А.М. Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2. Ветеринария сегодня. 2025;14(1):69-75. https://doi.org/10.29326/2304-196X-2025-14-1-69-75
For citation:
Yakovleva A.S., Kanshina A.V., Timina A.M. Preparation of recombinant SARS-CoV-2 nucleocapsid protein. Veterinary Science Today. 2025;14(1):69-75. https://doi.org/10.29326/2304-196X-2025-14-1-69-75
ВВЕДЕНИЕ
Новый коронавирус (SARS-CoV-2) стал причиной пандемии острой респираторной инфекции, которая охватила весь мир и привела к гибели нескольких миллионов человек [1]. Заболевание у инфицированного человека может проходить как бессимптомно, так и в форме тяжелой пневмонии, приводящей к смерти в случае тотального поражения легких. SARS-CoV-2 – оболочечный одноцепочечный РНК-содержащий вирус семейства Coronaviridae, рода Betacoronavirus. Вирион вируса имеет характерный вид короны с шиповидными (S), мембранными (M) и оболочечными (E) белками, расположенными в двухслойной фосфолипидной оболочке. РНК-геном размером 30 kb кодирует 16 неструктурных белков и 4 основных структурных белка: спайк (S), мембранный (M), оболочечный (E) и нуклеокапсидный (N) [2].
Помимо людей, SARS-CoV-2 способен заражать многие виды млекопитающих [2-10]. По данным Всемирной организации здравоохранения животных (ВОЗЖ), новый коронавирус выявляли у кошек, собак, грызунов (хомяков), норок и хорьков, зоопарковых животных (обезьян, тигров, львов, пум и др.), оленей, лис, лошадей. С начала пандемии 35 стран заявили в ВОЗЖ о выявлении SARS-CoV-2 у животных, что следует из обзора информационно-аналитического центра Россельхознадзора [11].
В настоящее время установлено, что вирус может передаваться от одного вида животного к другому, от человека к животному и от животного к человеку [12-18].
В мае 2023 г. Всемирная организация здравоохранения объявила о конце пандемии, однако некоторые группы ученых считают данное объявление преждевременным. Они предполагают, что вирус может представлять угрозу общественному здравоохранению в течение десятилетий. Даже при условии полной ликвидации циркуляции вируса в популяции людей SARS-CoV-2 будет представлять опасность для здоровья человека, домашних и диких животных из-за скрытых резервуаров в дикой природе [13][19][20].
Потенциально некоторые виды животных могут играть роль природного резервуара этого вируса. С целью изучения такой возможности в некоторых странах проводится серологический мониторинг новой коронавирусной инфекции в популяциях домашних и диких животных. Так, во Франции на наличие антител к SARS-CoV-2 было исследовано более 5600 проб сывороток крови, полученной от кошек и собак, а в Китае – более 20 000 проб от этих двух видов животных. В США активно проводится серомониторинг новой коронавирусной инфекции в дикой фауне. Высокая серопревалентность обнаружена у енотов, белок, рыжих лисиц, опоссумов, скунсов, белоногих мышей и белохвостых оленей [21-23].
Исследование распространения SARS-CoV-2 среди диких и домашних животных требует наличия соответствующих диагностических инструментов. В 2021 г. в ФГБУ «ВНИИЗЖ» разработана иммуноферментная тест-система для выявления антител к SARS-CoV-2 в сыворотках крови животных [24]. В разработанном методе в качестве антигена используется инактивированный коронавирус. Однако для получения такого антигена необходимо культивировать вирус, что сопряжено с высоким биологическим риском. Более безопасной альтернативой антигену, получаемому из нативного вируса, могут быть рекомбинантные белки SARS-CoV-2, производимые в про- или эукариотических системах экспрессии. Ранее было показано, что наиболее иммуногенным белком SARS-CoV-2 с консервативным аминокислотным составом является нуклеокапсидный протеин [25][26].
Цель данной работы заключалась в получении рекомбинантного нуклеокапсидного белка SARS-CoV-2, который в дальнейшем может быть использован в качестве антигена в иммуноферментном анализе.
МАТЕРИАЛЫ И МЕТОДЫ
Вирус. Для выделения РНК SARS-CoV-2 был использован клинический материал (назальные смывы) от человека с подтвержденным диагнозом на COVID-19.
Вирусную РНК выделяли на стекловолокнистых фильтрах GF/F по методике О. Г. Грибанова и соавт. [27].
Обратная транскрипция и полимеразная цепная реакция (ОТ-ПЦР). N-ген SARS-CoV-2 амплифицировали методом ОТ-ПЦР. Продукты реакции анализировали с помощью электрофореза в 1,5%-м агарозном геле, содержащем 0,001% бромистого этидия, при силе тока 50 мА.
Молекулярное клонирование продукта ОТ-ПЦР осуществляли по общепринятым методикам [28]. В работе использовали плазмиду pQE (QIAGEN, Нидерланды), штамм Escherichia coli JM109 (Promega, США).
Синтез рекомбинантного белка. Культивирование Е. coli проводили в орбитальном шейкере при 150 об/мин и 37 °С. В дневную культуру клеток, достигшую логарифмической фазы роста, добавляли индуктор ИПТГ (изопропил-β-D-1-тиогалактопиранозид). Уровень синтеза и размер рекомбинантных белков определяли с помощью электрофореза в 12%-м полиакриламидном геле.
Очистка рекомбинантного белка проводилась методом металл-хелатной хроматографии с применением Ni-NTA-агарозы (Thermo Fisher Scientific, США).
Непрямой вариант иммуноферментного анализа (ИФА) осуществляли с использованием ТБС-Т (трис-буферный раствор с добавлением Tвин-20) для промывки планшетов. Для блокировки участков неспецифического связывания и для разведения сывороток и антивидового конъюгата применяли 1%-е молоко на основе ТБС-Т. В работе использовали конъюгат протеина А фирмы КPL (Италия). В качестве субстрата для пероксидазного конъюгата применяли АБТС (2,2-азино-бис (3-этилбензтиозолин-6-сульфоновая кислота).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для молекулярного клонирования N-ген SARS-CoV-2 получили методом ОТ-ПЦР. При амплификации использовали праймеры, содержащие в своей последовательности сайты рестрикции BamHI и SalI.
После рестрикции соответствующими ферментами ампликон применяли для лигирования в плазмидный вектор, который был получен после обработки плазмиды pQE соответствующими рестриктазами. Лигазную смесь, содержащую обработанный ампликон и плазмидный вектор, вносили в компетентные клетки штамма JM109 E. сoli методом химической трансформации. Клетки E. coli высевали на LB-агар, содержащий 100 мкг/мл ампициллина. В результате трансформации был проведен скрининг полученных колоний и отобрано несколько клонов E. coli, синтезирующих рекомбинантный нуклеокапсидный белок SARS-CoV-2, содержащий на N-конце полигистидиновый остаток. Молекулярная масса белка составила 33 кДа, что соответствовало расчетным данным.
Для увеличения концентрации синтезируемого рекомбинантного белка в отобранном клоне E. coli были определены оптимальная концентрация индуктора, оптимальный период экспрессии, обеспечивающие максимальное накопление белка в бактериальных клетках.
Для установления оптимальной концентрации индуктора использовали растворы 0,1; 0,2; 0,5 и 1,0 мМ ИПТГ. Уровень экспрессии белка определяли по электрофореграмме визуально. Накопление рекомбинантного белка достигало пика при концентрации ИПТГ 0,5 мМ и не изменялось при двукратном увеличении концентрации индуктора. Концентрацию 0,5 мМ установили как оптимальную, и в дальнейшем все работы по экспрессии проводили при данной концентрации индуктора.
Для определения оптимального периода экспрессии рекомбинантного белка исследовали лизат клеток E. coli через 2, 4 и 18 ч после индукции. Анализ уровня накопления белка проводили в 12%-м полиакриламидном геле. Максимальный уровень экспрессии рекомбинантного белка наблюдали через 4 ч после внесения индуктора (рис. 1). Через 18 ч количество белка было ниже, что, возможно, связано с его разрушением при длительном культивировании E. coli. Таким образом, 4 ч после индукции были приняты в качестве оптимального времени для синтеза рекомбинантного белка.
Очистку рекомбинантного белка проводили методом металл-хелатной хроматографии. При приготовлении лизата клеток в нативных условиях большая часть белка оставалась в клеточном дебрисе, поэтому в дальнейшем лизис проводили в денатурирующих условиях.
Для получения очищенного препарата белка в максимальной концентрации были проведены работы по поиску оптимального состава лизирующего и элюирующего буферов.
В составе лизирующего буфера № 1 использовали 8 М мочевину, лизирующего буфера № 2 – 6 М гуанидингидрохлорид (Gu-HCl). В денатурирующих условиях большая часть белка уходила из клеточного дебриса в надосадок. Выход белка был примерно одинаковым как с применением 8 М мочевины, так и с применением 6 М Gu-HCl (рис. 2). В качестве денатурирующего агента было принято использовать 8 М мочевину.
Очистку клеточного лизата проводили методом металл-хелатной хроматографии с применением агарозы Ni-NTA (никель-нитрилоацетат). Для элюирования N-белка были использованы 4 варианта буферов: буфер A (8 М мочевина, 0,1 М Na2HPO4, 0,01 М трис-Cl, рН 4,0), буфер B (8 М мочевина, 0,1 М Na2HPO4, 0,01 М трис-Cl, 0,2 М имидазол, рН 8,0), буфер C (8 М мочевина, 0,1 М Na2HPO4, 0,01 М трис-Cl, 0,4 М имидазол, рН 8,0), буфер D (8 М мочевина, 0,1 М Na2HPO4, 0,01 М трис-Cl, 0,5 М имидазол, рН 8,0). Концентрацию белка в каждом элюате оценивали визуально по электрофореграмме. Наибольшая концентрация рекомбинантного белка была в элюате с использованием буфера C (рис. 3). Таким образом, максимального выхода очищенного N-белка удалось добиться при денатурации буфером с 8 М мочевиной и элюации буфером, содержащим 0,4 М имидазола.
При проведении экспериментов по оптимизации условий экспрессии и очистки была установлена следующая схема получения рекомбинантного нуклеокапсидного белка SARS-CoV-2. В 0,1 л среды LB с 100 мкг/мл ампициллина вносили 1 мл клеточной суспензии рекомбинантного клона E. coli, полученной после ночной инкубации, и инкубировали при 150 об/мин и 37 °С до достижения плотности OD600 = 0,5. Индукцию проводили внесением ИПТГ до конечной концентрации 0,5 мМ и инкубировали еще 4 ч при 150 об/мин и 37 °С. Клеточную суспензию осаждали в течение 15 мин при 5000 об/мин. Осадок ресуспендировали в 5 мл лизирующего буфера с 8 М мочевиной. Клеточный дебрис удаляли центрифугированием в течение 5 мин при 12 000 об/мин. Надосадок использовали для проведения металл-хелатной хроматографии. Осветленный лизат перемешивали с 1 мл сорбента (агароза Ni-NTA) в течение 15 мин, после чего полученную суспензию центрифугировали в течение 1 мин при 12 000 об/мин. Осадок промывали два раза лизирующим буфером. Элюирование производили добавлением к осадку 1 мл элюирующего буфера с 0,4 М имидазолом, перемешивали в течение 1 мин, после чего центрифугировали в течение 1 мин при 12 000 об/мин. Надосадок исследовали на наличие рекомбинантного белка. Для оценки степени очистки и размера полученного белка проводили электрофорез в 12%-м полиакриламидном геле (рис. 4). Концентрацию белка определяли по Бредфорду.
В результате оптимизации параметров экспрессии и очистки рекомбинантного нуклеокапсидного белка SARS-CoV-2 получили препарат белка в высокой концентрации. Выход очищенного протеина с 100 мл культуры E. coli составил 1,5 мг.
Антигенную активность рекомбинантного нуклеокапсидного белка SARS-CoV-2 проверяли в непрямом варианте твердофазного ИФА с контрольными сыворотками крови кроликов. Для этого рекомбинантный белок, разведенный 1:800 в карбонатно-бикарбонатном буфере, вносили в лунки иммунологического планшета и инкубировали в течение ночи. После блокировки неспецифических участков связывания и последующей отмывки в лунки планшета вносили контрольные сыворотки крови кролика в разведении от 1:20 до 1:2560. В качестве положительного контроля использовали сыворотку крови от трех кроликов, иммунизированных антигеном SARS-CoV-2 (+К), в качестве отрицательного контроля – сыворотку крови от неиммунизированного кролика (–К). Через 1 ч сыворотки удаляли, планшет промывали и добавляли пероксидазный конъюгат протеина А. Еще через 1 ч планшеты промывали и затем проявляли реакцию добавлением субстрата АБТС. Результаты ИФА отражены в таблице.
Показано, что рекомбинантный нуклеокапсидный белок продемонстрировал высокую антигенную активность с положительными контрольными сыворотками и отсутствие неспецифического связывания с отрицательной контрольной сывороткой.
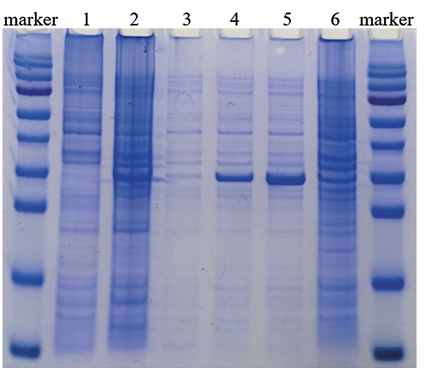
Рис. 1. Определение оптимального периода экспрессии рекомбинантного нуклеокапсидного белка SARS-CoV-2:
marker – маркер молекулярного веса белков (170, 130, 95, 72, 55, 43, 34, 26, 17, 10 кДа);
1 – лизат клеток E. coli JM109;
2 – лизат клеток клона E. coli, содержащего N-ген SARS-CoV-2, после 18 ч инкубации;
3 – лизат клеток клона E. coli, содержащего N-ген SARS-CoV-2, до индукции;
4 – лизат клеток клона E. coli, содержащего N-ген SARS-CoV-2, через 2 ч после индукции;
5 – лизат клеток клона E. coli, содержащего N-ген SARS-CoV-2, через 4 ч после индукции;
6 – лизат клеток клона E. coli, содержащего N-ген SARS-CoV-2, через 18 ч после индукции
Fig. 1. Determination of optimal period of recombinant SARS-CoV-2 nucleocapsid protein expression:
protein molecular weight marker (170, 130, 95, 72, 55, 43, 34, 26, 17, 10 kDa);
1 – E. coli JM109 cell lysate;
2 – cell lysate of SARS-CoV-2 N-gene-containing E. coli clone, after 18-hour incubation;
3 – cell lysate of SARS-CoV-2 N-gene-containing E. coli clone, before induction;
4 – cell lysate of SARS-CoV-2 N-gene-containing E. coli clone, 2 hours after induction;
5 – cell lysate of SARS-CoV-2 N-gene-containing E. coli clone, 4 hours after induction;
6 – cell lysate of SARS-CoV-2 N-gene-containing E. coli clone, 18 hours after induction
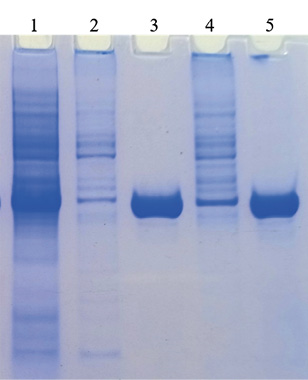
Рис. 2. Влияние состава лизирующего буфера на растворимость и выход очищенного рекомбинантного нуклеокапсидного белка SARS-CoV-2:
1 – лизат клеток рекомбинантного клона E. coli через 4 ч после индукции;
2 – осадок клеток, экспрессирующих рекомбинантный белок после обработки лизирующим буфером № 1, содержащим 8 М мочевину;
3 – очищенный рекомбинантный белок при использовании в составе денатурирующего буфера 8 М мочевину;
4 – осадок клеток, экспрессирующих рекомбинантный белок после обработки лизирующим буфером № 2, содержащим 6 М Gu-HCl;
5 – очищенный рекомбинантный белок при использовании в составе денатурирующего буфера 6 М Gu-HCl
Fig. 2. Effect of lysing buffer composition on purified recombinant SARS-CoV-2 nucleocapsid protein solubility and yield:
1 – cell lysate of recombinant E. coli clone, 4 hours after induction;
2 – sediment of recombinant protein-expressing cells after treatment with lysis buffer No. 1 containing 8 M urea;
3 – purified recombinant protein when denaturing buffer containing 8 M urea was used;
4 – sediment of recombinant protein-expressing cells after treatment with lysis buffer No. 2 containing 6 М Gu-HCl;
5 – purified recombinant protein when denaturing buffer containing 6 М Gu-HCl was used
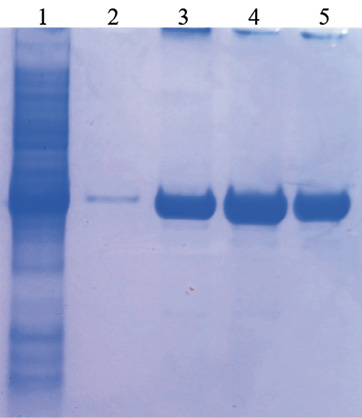
Рис. 3. Влияние состава элюирующих буферов на выход очищенного рекомбинантного нуклеокапсидного белка SARS-CoV-2:
1 – лизат клеток рекомбинантного клона E. coli после 4 ч индукции;
2 – очищенный рекомбинантный белок при использовании буфера A;
3 – очищенный рекомбинантный белок при использовании буфера B;
4 – очищенный рекомбинантный белок при использовании буфера C;
5 – очищенный рекомбинантный белок при использовании буфера D
Fig. 3. Effect of elution buffer composition on purified recombinant SARS-CoV-2 nucleocapsid protein yield:
1 – cell lysate of recombinant E. coli clone, 4 hours after induction;
2 – purified recombinant protein when buffer A was used;
3 – purified recombinant protein when buffer B was used;
4 – purified recombinant protein when buffer C was used;
5 – purified recombinant protein when buffer D was used
Таблица
Антигенная активность рекомбинантного нуклеокапсидного белка SARS-CoV-2 в непрямом варианте твердофазного ИФА
Table
Results of tests of recombinant SARS-CoV-2 nucleocapsid protein for its antigenic activity with indirect ELISA
|
Разведение контрольных сывороток |
Оптическая плотность контролей в ИФА |
|||
|
–К |
+К № 1 |
+К № 2 |
+К № 3 |
|
|
1:20 |
0,094 |
2,552 |
2,839 |
3,102 |
|
1:40 |
0,092 |
1,170 |
2,712 |
3,054 |
|
1:80 |
0,083 |
1,911 |
2,628 |
2,995 |
|
1:160 |
0,081 |
1,261 |
2,240 |
2,803 |
|
1:320 |
0,078 |
0,753 |
1,717 |
2,420 |
|
1:640 |
0,078 |
0,466 |
1,181 |
1,899 |
|
1:1280 |
0,077 |
0,266 |
0,693 |
1,293 |
|
1:2560 |
0,070 |
0,182 |
0,422 |
0,849 |
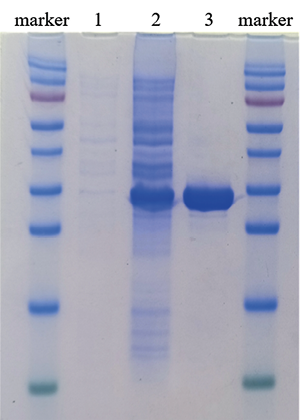
Рис. 4. Оценка размера и степени очистки рекомбинантного нуклеокапсидного белка SARS-CoV-2:
marker – маркер молекулярного веса белков (170, 130, 95, 72, 55, 43, 34, 26, 17, 10 кДа);
1 – лизат клеток рекомбинантного клона E. coli до индукции;
2 – лизат клеток рекомбинантного клона E. coli через 4 ч после индукции;
3 – очищенный рекомбинантный белок
Fig. 4. Assessment of recombinant SARS-CoV-2 nucleocapsid protein size and purification level:
protein molecular weight marker (170, 130, 95, 72, 55, 43, 34, 26, 17, 10 kDа);
1 – cell lysate of recombinant E. coli clone before induction;
2 – cell lysate of recombinant E. coli clone, 4 hours after induction;
3 – purified recombinant protein
ЗАКЛЮЧЕНИЕ
Проведено молекулярное клонирование гена, кодирующего нуклеокапсидный белок SARS-CoV-2, с использованием прокариотической системы экспрессии.
Получены клоны E. coli, экспрессирующие рекомбинантный нуклеокапсидный белок.
Были установлены условия экспрессии и очистки, обеспечивающие высокий выход очищенного антигена.
В непрямом варианте ИФА показано, что полученный рекомбинантный белок имеет высокую антигенную активность и позволяет выявлять антитела к SARS-CoV-2 в сыворотках крови животных.
Список литературы
1. Карта коронавируса COVID-19 онлайн. https://coronavirusmonitor.info
2. Mahdy M. A. A., Younis W., Ewaida Z. An overview of SARS-CoV-2 and animal infection. Frontiersin Veterinary Science. 2020; 7:596391. https://doi.org/10.3389/fvets.2020.596391
3. Enserink M. Coronavirus rips through Dutch mink farms, triggering culls. Science. 2020; 368 (6496):1169. https://doi.org/10.1126/science.368.6496.1169
4. McAloose D., Laverac M., Wang L., Killian M. L., Caserta L. C., YuanF., et al. Frompeople toPanthera: Natural SARS-CoV-2 infectionintigers and lions at the Bronx Zoo. mBio. 2020; 11 (5):e02220-20. https://doi.org/10.1128/mbio.02220-20
5. Oreshkova N., Molenaar R. J., Vreman S., Harders F., Oude Munnink B. B., Hakze-van der Honing R. W., et al. SARS-CoV-2 infection in farmed minks, the Netherlands, April and May 2020. Eurosurveillance. 2020; 25 (23):2001005. https://doi.org/10.2807/1560-7917.es.2020.25.23.2001005
6. Sailleau C., Dumarest M., Vanhomwegen J., Delaplace M., Caro V., Kwasiborski A., et al. First detection and genome sequencing of SARS-CoV-2 in an infected cat in France. Transboundary and Emerging Diseases. 2020; 67 (6): 2324–2328. https://doi.org/10.1111/tbed.13659
7. Freuling C. M., Breithaupt A., MüllerT., SehlJ., Balkema-Buschmann A., Rissmann M., et al. Susceptibility of raccoon dogs for experimental SARSCoV-2 infection. Emerging Infectious Diseases. 2020; 26 (12): 2982–2985. https://doi.org/10.3201/eid2612.203733
8. Sit T. H. C., Brackman C. J., Ip S. M., Tam K. W. S., Law P. Y. T., To E. M. W., et al. Infection of dogs with SARS-CoV-2. Nature. 2020; 586: 776–778. https://doi.org/10.1038/s41586-020-2334-5
9. Schlottau K., Rissmann M., Graaf A., Schön J., SehlJ., Wylezich C., et al. SARS-CoV-2 in fruit bats, ferrets, pigs, and chickens: an experimental transmission study. The Lancet Microbe. 2020; 1 (5): e218–e225. https://doi.org/10.1016/s2666-5247(20)30089-6
10. Hobbs E. С., Reid T. J. Animals and SARS-CoV-2: Species susceptibility and viral transmission in experimental and natural conditions, and the potential implications for community transmission. Transboundary and Emerging Diseases. 2021; 68 (4): 1850–1867. https://doi.org/10.1111/tbed.13885
11. Макеева Ю. О выявлении SARS-CoV-2 у животных заявили в ВОЗЖ 35 стран. Ветеринария и жизнь. 28 декабря 2022 г. https://vetandlife.ru/sobytiya/o-vyyavlenii-sars-cov-2-u-zhivotnyh-zayavili-v-vozzh-35-stran
12. EFSA Panel on Animal Health and Welfare (AHAW), Nielsen S. S., Alvarez J., Bicout D. J., Calistri P., Canali E., et al. SARS-CoV-2 in animals: susceptibility of animal species, risk for animal and public health, monitoring, prevention and control. EFSA Journal. 2023; 21 (2):e07822. https://doi.org/10.2903/j.efsa.2023.7822
13. Fang R., Yang X., Guo Y., Peng B., Dong R., Li S., Xu S. SARSCoV-2 infection in animals: Patterns, transmission routes, and drivers. Eco-Environment & Health. 2024; 3 (1): 45–54. https://doi.org/10.1016/j.eehl.2023.09.004
14. Mastutik G., Rohman A., I’tishom R., Ruiz-Arrondo I., de BlasI. Experimental and natural infections ofsevere acute respiratory syndrome-related coronavirus 2 in pets and wild and farm animals. Veterinary World. 2022; 15 (3): 565–589. https://doi.org/10.14202/vetworld.2022.565-589
15. Cui S., LiuY., Zhao J., Peng X., LuG., ShiW., et al. An updated review on SARS-CoV-2 infection in animals. Viruses. 2022; 14 (7):1527. https://doi.org/10.3390/v14071527
16. Hammer A. S., Quaade M. L., Rasmussen T. B., Fonager J., Rasmussen M., Mundbjerg K., et al. SARS-CoV-2 transmission between mink (Neovison vison) and humans, Denmark. Emerging InfectiousDiseases. 2021; 27 (2): 547–551. https://doi.org/10.3201/eid2702.203794
17. Yen H.-L., Sit T. H. C., Brackman C. J., Chuk S. S. Y., Gu H., Tam K. W. S., et al. Transmission of SARS-CoV-2 delta variant (AY.127) from pet hamsters to humans, leading to onward human-to-human transmission: a case study. The Lancet. 2022; 399 (10329): 1070–1078. https://doi.org/10.1016/s0140-6736(22)00326-9
18. Cui X., Wang Y., Zhai J., Xue M., Zheng C., Yu L. Future trajectory of SARS-CoV-2: Constant spillover back and forth between humans and animals. Virus Research. 2023; 328:199075. https://doi.org/10.1016/j.virusres.2023.199075
19. Cheng K., Wu C., Gu S., LuY., Wu H., Li C. WHOdeclaresthe end of the COVID-19 global health emergency: lessons and recommendations from the perspective of ChatGPT/GPT-4. International Journal of Surgery. 2023; 109 (9): 2859–2862. https://doi.org/10.1097/js9.0000000000000521
20. Santini J. M., Edwards S. J. L. Host range of SARS-CoV-2 and implications for public health. The Lancet Microbe. 2020; 1 (4): e141–e142. https://doi.org/10.1016/s2666-5247(20)30069-0
21. Fritz M., Elguero E., Becquart P., de Fonclare D. de R., Garcia D., Beurlet S., et al. A large-scale serological survey in pets from October 2020 through June 2021 in France shows significantly higher exposure to SARSCoV-2 in cats. bioRxiv. December 26, 2022; preprint, Version 4. https://doi.org/10.1101/2022.12.23.521567
22. Wang A., Zhu X., Chen Y., Sun Y., Liu H., Ding P., et al. Serological survey of SARS-CoV-2 in companion animalsin China. Frontiersin Veterinary Science. 2022; 9:986619. https://doi.org/10.3389/fvets.2022.986619
23. Goldberg A. R., Langwig K. E., Brown K. L., Marano J. M., Rai P., King K. M., et al. Widespread exposure to SARS-CoV-2 in wildlife communities. Nature Communications. 2024; 15 (1):6210. https://doi.org/10.1038/s41467-024-49891-w.
24. Волкова М. А., Зиняков Н. Г., Ярославцева П. С., Чвала И. А., Галкина Т. С., Андрейчук Д. Б. Разработка тест-системы для выявления антител к вирусу SARS-CoV-2 в сыворотках крови восприимчивых животных. Ветеринария сегодня. 2021; (2): 97–102. https://doi.org/10.29326/2304-196X-2021-2-37-97-102
25. Burbelo P. D., Riedo F. X., Morishima C., Rawlings S., Smith D., Das S., et al. Sensitivity in detection of antibodies to nucleocapsid and spike proteins of severe acute respiratory syndrome coronavirus 2 in patients with coronavirus disease 2019. The Journal of Infectious Diseases. 2020; 222 (2): 206–213. https://doi.org/10.1093/infdis/jiaa273
26. De Marco Verissimo C., O’Brien C., López Corrales J., Dorey A., Cwiklinski K., Lalor R., et al. Improved diagnosis of SARS-CoV-2 by using nucleoprotein and spike protein fragment 2 in quantitative dual ELISA tests. Epidemiology and Infection. 2021; 149:e140. https://doi.org/10.1017/S0950268821001308
27. Грибанов О. Г., Щербаков А. В., Перевозчикова Н. А., Гусев А. А. Использование аэросила А300 и фильтров GF/F (GF/C) для очистки фрагментов ДНК, ДНК-плазмид и РНК. Биохимия. 1996; 61 (6): 1064–1070. https://biochemistrymoscow.com/ru/archive/1996/61-06-1064
28. Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир; 1984. 480 с.
Об авторах
А. С. ЯковлеваРоссия
Яковлева Анастасия Сергеевна, канд. биол. наук, старший научный сотрудник референтной лаборатории по особо опасным болезням
мкр. Юрьевец, г. Владимир, 600901
А. В. Каньшина
Россия
Каньшина Анжелика Владимировна, канд. вет. наук, старший научный сотрудник референтной лаборатории по особо опасным болезням
мкр. Юрьевец, г. Владимир, 600901
А. М. Тимина
Россия
Тимина Анна Михайловна, канд. вет. наук, старший научный сотрудник референтной лаборатории по особо опасным болезням
мкр. Юрьевец, г. Владимир, 600901
Рецензия
Для цитирования:
Яковлева А.С., Каньшина А.В., Тимина А.М. Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2. Ветеринария сегодня. 2025;14(1):69-75. https://doi.org/10.29326/2304-196X-2025-14-1-69-75
For citation:
Yakovleva A.S., Kanshina A.V., Timina A.M. Preparation of recombinant SARS-CoV-2 nucleocapsid protein. Veterinary Science Today. 2025;14(1):69-75. https://doi.org/10.29326/2304-196X-2025-14-1-69-75
JATS XML



































