Перейти к:
Функционально-метаболическая активность нейтрофилов у молодняка крупного рогатого скота, сенсибилизированного неагглютиногенным штаммом бруцелл
https://doi.org/10.29326/2304-196X-2025-14-1-62-68
Аннотация
Введение. Бруцеллез остается одной из наиболее распространенных инфекций в группе особо опасных зоонозов. Устойчивость к патогенным микроорганизмам рода Brucella зависит от полноценного клеточно-опосредованного иммунитета, включающего в себя активацию бактерицидных механизмов фагоцитов. Несмотря на неоднократно доказанную роль нейтрофилов в борьбе со многими бактериальными патогенами, функции этих иммунокомпетентных клеток при бруцеллезе оставались неизученными в течение продолжительного времени.
Цель исследования. Изучение функционально-метаболической активности нейтрофилов у молодняка крупного рогатого скота, сенсибилизированного неагглютиногенным штаммом бруцелл.
Материалы и методы. У молодняка крупного рогатого скота, иммунизированного против бруцеллеза вакциной из неагглютиногенного штамма Brucella abortus RB-51, оценивали функционально-метаболическое состояние нейтрофилов на 7, 14, 21, 28, 35-е сут после иммунизации в тесте с нитросиним тетразолием, а также по уровню ферментной активности миелопероксидазы и содержанию неферментных катионных белков. Измерения показателей проводили фотометрическим способом в спонтанном и стимулированном вариантах постановки с последующим расчетом коэффициентов стимуляции. В качестве стимуляторов реакции применяли дезинтеграты бруцелл и корпускулярные антигены, изготовленные из вакцинных штаммов бруцелл с разной антигенной структурой.
Результаты. Было установлено, что при иммунизации молодняка крупного рогатого скота неагглютиногенным штаммом бруцелл функционально-метаболический статус нейтрофилов характеризуется усилением активности нейтрофилов в тесте с нитросиним тетразолием на 7-е и 35-е сут исследования, отсутствием выраженных изменений в показателях ферментной активности миелопероксидазы, а также снижением количества неферментных катионных белков на 7–14-е сут после вакцинации.
Заключение. Наиболее выраженное увеличение коэффициентов стимуляции отмечается при применении в качестве стимулятора реакции дезинтегратов бруцелл. При оценке кислородзависимого метаболизма нейтрофилов в тесте с нитросиним тетразолием максимальные значения коэффициентов стимуляции отмечали на 28-е сут после вакцинации, при оценке кислороднезависимого метаболизма – на 14-е сут.
Для цитирования:
Манакова О.О., Янченко Т.А., Власенко В.С. Функционально-метаболическая активность нейтрофилов у молодняка крупного рогатого скота, сенсибилизированного неагглютиногенным штаммом бруцелл. Ветеринария сегодня. 2025;14(1):62-68. https://doi.org/10.29326/2304-196X-2025-14-1-62-68
For citation:
Manakova O.O., Yanchenko T.A., Vlasenko V.S. Functional and metabolic activity of neutrophils in young cattle sensitized with a non-agglutinogenic strain of Brucella. Veterinary Science Today. 2025;14(1):62-68. https://doi.org/10.29326/2304-196X-2025-14-1-62-68
ВВЕДЕНИЕ
Бруцеллез крупного рогатого скота, несмотря на применяемую в животноводстве научно обоснованную систему противобруцеллезных мероприятий, остается эндемичным для большинства территорий Российской Федерации и представляет опасность для животноводческих предприятий [1][2].
В настоящее время одной из основных составляющих системы противобруцеллезных мероприятий является специфическая профилактика [3-6], главная цель которой заключается в воспроизведении у сельскохозяйственных животных бессимптомной или латентной инфекции в сочетании с нестерильным иммунитетом, переходящим в постинфекционный стерильный [7-9].
Устойчивость макроорганизма к патогенным микроорганизмам рода Brucella на первых этапах развития инфекционного процесса определяется активностью клеточных факторов защиты, а именно активацией бактерицидных механизмов фагоцитов [10-12]. Основными фагоцитирующими клетками, осуществляющими противобруцеллезную защиту, являются полиморфно-ядерные нейтрофилы. Функционально-метаболический статус нейтрофилов определяет выраженность воспалительной реакции, развивающейся в ответ на проникновение в организм инфекционных возбудителей [13-15]. Бактерицидные свойства нейтрофилов обеспечиваются гидролитическими ферментами, катионными белками, активными формами кислорода [16-18].
Исследования ферментативных и неферментативных систем нейтрофилов позволяют обнаружить изменения в организме на ранних стадиях развития инфекционного процесса, до появления более глубоких изменений в органах и системах, выявляемых с помощью традиционных методов исследований. В научной литературе описаны особенности функционирования систем нейтрофилов в опытах на лабораторных и других животных [19-21].
На сегодняшний день особый научный интерес представляет проблема клеточно-опосредованного противобруцеллезного иммунитета у продуктивных животных. Исследование клеточных реакций in vitro в ответ на стимуляцию изготовленными в ФГБНУ «Омский аграрный научный центр» (ФГБНУ «Омский АНЦ») бруцеллезными антигенами можно считать информативным и объективным подходом при анализе иммунологической перестройки организма на ранних сроках после вакцинации, что очень важно при оценке эффективности иммунобиологических препаратов.
Цель исследования – изучить функционально-метаболическую активность нейтрофилов у молодняка крупного рогатого скота, сенсибилизированного неагглютиногенным штаммом бруцелл.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена в отделе ветеринарии ФГБНУ «Омский АНЦ».
Материалом для исследования служила гепаринизированная периферическая кровь крупного рогатого скота. Отбор проб осуществляли до вакцинации и на 7, 14, 21, 28, 35-е сут после вакцинации.
Штаммы бактерий. Для изготовления антигенов использовали штаммы бруцелл, находящиеся в биоресурсной коллекции отдела ветеринарии ФГБНУ «Омский АНЦ»: Brucella abortus 16/4 в стабильной R-форме и Brucella abortus 19 в S-форме.
Для иммунизации молодняка применяли вакцину против бруцеллеза крупного рогатого скота из неагглютиногенного штамма B. abortus RB-51 производства США.
Животные. Эксперимент проводили на 4–5-месячных телках (n = 50) красной степной породы, находящихся на выгульном содержании и сбалансированном рационе.
Антигены изготовлены в условиях научной лаборатории по модифицированным методикам Н. П. Иванова [22].
CS – корпускулярный антиген, изготовленный из штамма B. abortus 19.
CR – корпускулярный антиген, изготовленный из штамма B. abortus 16/4.
DS – антиген, изготовленный методом ультразвуковой дезинтеграции (дезинтеграт) из штамма B. abortus 19.
DR – антиген, изготовленный методом ультразвуковой дезинтеграции (дезинтеграт) из штамма B. abortus 16/4.
Функционально-метаболическое состояние нейтрофилов оценивали в тесте с нитросиним тетразолием (НСТ-тест) по модифицированной методике [23], а также по количеству катионных белков и миелопероксидазы по модифицированной методике, описанной Н. М. Хитрик [24]. Измерения проводили фотометрическим методом в спонтанном (без обработки антигеном) и стимулированном (с обработкой антигеном) вариантах постановки. Результаты реакции фиксировали с помощью многоканального иммунохимического анализатора Fluorofot STD-Less-486-M (Россия) и выражали в условных единицах оптической плотности с последующим подсчетом коэффициента стимуляции по формуле
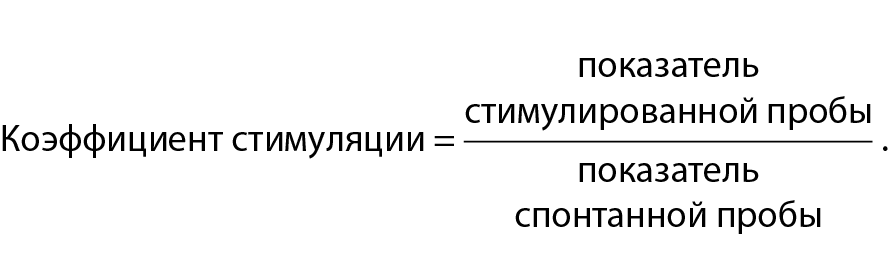
В качестве стимуляторов реакций использовали дезинтеграты бруцелл (DR и DS) и корпускулярные антигены (CR и CS).
Математическую обработку полученных цифровых данных осуществляли с помощью стандартных методов вариационной статистики с определением средних арифметических (M) и расчета ошибок средних арифметических (m). С целью оценки достоверности различий (p) использовали t-критерий Стьюдента. Также применяли метод нормированного отклонения с автоматическим определением показателей с помощью специальной программы для ПК [25] в соответствии с формулой
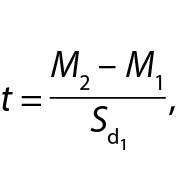
где t – нормированное отклонение;
М – среднее опытной (М2) и контрольной (М1)
групп;
Sd – стандартное отклонение контрольной группы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование проведено в благополучном по бруцеллезу сельскохозяйственном предприятии с регулярным применением вакцины против бруцеллеза крупного рогатого скота из неагглютиногенного штамма B. abortus RB-51.
На начальном этапе исследований была проведена оценка функционально-метаболического состояния нейтрофилов при помощи НСТ-теста, ферментной активности миелопероксидазы и содержания неферментных катионных белков в разные сроки после сенсибилизации животных неагглютиногенным штаммом бруцелл.
Установлено, что уровень спонтанной тетразолиевой активности нейтрофилов после повышения к 7-м сут от начала эксперимента имел некоторую тенденцию к снижению, достигая минимума к 28-м сут, после чего вновь увеличивался, но не достигал достоверной разницы относительно фоновых значений.
При внесении в клеточную взвесь фагоцитов как корпускулярных (СS, CR), так и дезинтегрированных (DS, DR) антигенов также наблюдали усиленную генерацию кислородных радикалов в нейтрофильных гранулоцитах к 7-м сут, которая, в зависимости от используемого антигена, возвращалась к исходному уровню (до введения вакцины) на 14–28-е сут от начала эксперимента. Следует отметить, что на 35-е сут отмечали повторное увеличение значений индуцированной НСТ-активности. Так, при стимуляции антигенами CS и DS регистрировали статистически значимое увеличение показателей в 2,1 (р < 0,05) и 1,9 (р < 0,05) раза соответственно относительно показателей до вакцинации.
С 14-х сут после вакцинации отмечали увеличение коэффициента стимуляции НСТ при использовании в качестве индукторов корпускулярных антигенов CS, CR и дезинтеграта DS, тогда как стимулирующее действие антигена DR проявлялось с 21-х сут. Следует также отметить, что максимальных значений коэффициент стимуляции достигал на 28-е сут от начала эксперимента, особенно при взаимодействии фагоцитов с дезинтегратами DS и DR, где этот параметр относительно значений, зарегистрированных до сенсибилизации бруцеллами, возрос соответственно в 1,6 и 2,3 раза. В последующем отмечали снижение коэффициентов стимуляции НСТ, однако при применении антигена CS коэффициент оставался на том же уровне (табл. 1).
Данные проведенного исследования подтверждают ранее полученные нами результаты. Так, у морских свинок, иммунизированных неагглютиногенным штаммом бруцелл, максимальные значения коэффициентов стимуляции при определении тетразолиевой активности нейтрофилов отмечали на 28-е сут после иммунизации [26].
Спонтанная и стимулированная ферментная активность миелопероксидазы, которая также характеризует кислородпродуцирующую способность нейтрофилов, в ходе динамических исследований не имела статистически значимых изменений. Значения коэффициентов стимуляции достигали максимума на 21-е сут от начала эксперимента, за исключением тех случаев, когда в качестве антигена в пробы крови вносили дезинтеграт DS (табл. 2).
Катионные белки нейтрофилов – другой показатель, который, в отличие от двух предыдущих, характеризовал анаэробный метаболизм фагоцитов, в ходе динамических исследований имел некоторые особенности изменений, которые не наблюдали при изучении тетразолиевой и ферментной активности нейтрофилов. Так, спонтанная активность антимикробных пептидов, которая в начале эксперимента составила (2,15 ± 0,48), достигла минимума уже на 14-е сут после сенсибилизации животных бруцеллами (1,03 ± 0,03), а затем после кратковременного незначительного повышения на 28-е сут до (1,23 ± 0,19) вновь снизилась на 35-е сут и составила (1,07 ± 0,11).
При обработке проб крови корпускулярным антигеном из S-штамма активность катионных белков к 14-м сут от начала эксперимента по сравнению с фоновыми значениями снижалась в 1,3 раза (p < 0,05), затем на 28-е сут – в 1,78 раза (p < 0,05) и на 35-е сут – в 1,67 раза (p < 0,05), тогда как при применении антигена, изготовленного из R-штамма бруцелл, достоверное уменьшение кислороднезависимого метаболизма нейтрофилов регистрировали с 21-х сут после введения молодняку крупного рогатого скота неагглютиногенного штамма бруцелл.
В более поздний срок наблюдали спад активности катионных белков нейтрофилов в случаях использования дезинтегрированных DS- и DR-антигенов. В частности, на 28-е сут от начала эксперимента относительно исходных значений антимикробная деятельность фагоцитов была снижена соответственно в 1,73 (p < 0,05) и 2,24 раза (p < 0,05), а на 35-е – в 2,46 (p < 0,05) и 3,4 раза (p < 0,05).
На 14-е сут после сенсибилизации животных бруцеллами коэффициент стимуляции достигал максимального уровня, особенно это касалось дезинтегратов DS и DR, при применении которых увеличение относительно фоновых значений было наиболее выраженным, соответственно в 1,54 (p < 0,05) и 1,68 (p < 0,05) раза. В последующие сроки исследования происходило снижение этого коэффициента (табл. 3).
Динамика коэффициентов стимуляции при оценке неферментных катионных белков нейтрофилов у молодняка крупного рогатого скота подтверждает результаты, полученные нами при проведении эксперимента на морских свинках, иммунизированных неагглютиногенным штаммом бруцелл, по результатам которого наиболее выраженную активность неферментные катионные белки нейтрофилов проявляли на 14-е сут после введения иммунобиологического препарата [27].
На следующем этапе исследований с помощью специальной компьютерной программы была проведена статистическая обработка коэффициентов стимуляции НСТ-теста, миелопероксидазы и катионных белков с помощью метода нормированного отклонения для установления степени их трансформации относительно среднего уровня в разные сроки исследований. В тех случаях, когда отклонение от среднего уровня выходило за пределы +1,0 сигмы, отмечали статистически достоверную разницу, что указывало на выраженную специфическую сенсибилизацию нейтрофилов к бруцеллам. Результаты представлены в таблице 4.
Как показывают полученные данные, при постановке НСТ-теста выраженная специфическая сенсибилизация была зарегистрирована на 14–35-е сут от начала эксперимента при использовании корпускулярного антигена CS и на 28-е сут при стимуляции дезинтегратом DR, тогда как при оценке ферментной активности миелопероксидазы только на 21-е сут при индукции дезинтегрированным антигеном DR (t = +1,69).
В отличие от параметров кислородзависимого метаболизма при определении катионных белков, выполняющих свою функцию в анаэробных условиях, специфическую сенсибилизацию фиксировали в более ранние сроки. Так, при использовании СS-антигена отклонение от среднего уровня за пределы +1,0 сигмы наблюдали с 7-х по 21-е сут, а CR-, DS- и DR-антигенов только на 14-е сут. Необходимо отметить, что дезинтегрированные антигены индуцировали более выраженную специфическую сенсибилизацию (от +2,42 и выше).
Таблица 1
Динамика коэффициентов стимуляции при определении тетразолиевой активности нейтрофильных гранулоцитов у молодняка крупного рогатого скота в разные сроки после вакцинации, M ± m
Table 1
Stimulation coefficient dynamics in tests for tetrazolium activity of neutrophil granulocytes in young cattle at different time points after vaccination, M ± m
|
Антиген |
Срок после вакцинации, сут |
|||||
|
до введения |
7 |
14 |
21 |
28 |
35 |
|
|
CS |
0,63 ± 0,17 |
0,65 ± 0,02 |
1,00 ± 0,28 |
1,05 ± 0,06 |
1,00 ± 0,08 |
1,03 ± 0,24 |
|
CR |
0,72 ± 0,31 |
0,75 ± 0,13 |
0,89 ± 0,10 |
0,85 ± 0,10 |
1,04 ± 0,14 |
0,80 ± 0,11 |
|
DS |
0,82 ± 0,44 |
0,71 ± 0,09 |
0,85 ± 0,22 |
0,87 ± 0,09 |
1,33 ± 0,19 |
0,80 ± 0,16 |
|
DR |
0,78 ± 0,25 |
0,70 ± 0,07 |
0,72 ± 0,14 |
1,18 ± 0,33 |
1,80 ± 0,32 |
0,73 ± 0,13 |
Таблица 2
Динамика коэффициентов стимуляции при определении ферментной активности миелопероксидазы нейтрофильных гранулоцитов у молодняка крупного рогатого скота в разные сроки после вакцинации, M ± m
Table 2
Stimulation coefficient dynamics in tests for enzymatic activity of myeloperoxidase of neutrophil granulocytes in young cattle at different time points after vaccination, M ± m
|
Антиген |
Срок после вакцинации, сут |
|||||
|
до введения |
7 |
14 |
21 |
28 |
35 |
|
|
CS |
0,87 ± 0,13 |
0,99 ± 0,02 |
0,99 ± 0,01 |
1,02 ± 0,01 |
0,99 ± 0,01 |
1,00 ± 0,01 |
|
CR |
1,00 ± 0,02 |
0,99 ± 0,02 |
0,97 ± 0,01 |
1,03 ± 0,01 |
0,95 ± 0,01 |
0,97 ± 0,01 |
|
DS |
1,01 ± 0,03 |
1,00 ± 0,01 |
1,00 ± 0,004 |
0,98 ± 0,02 |
0,85 ± 0,10 |
0,99 ± 0,01 |
|
DR |
0,96 ± 0,02 |
0,98 ± 0,02 |
0,97 ± 0,01 |
1,03 ± 0,01 |
0,94 ± 0,01 |
0,96 ± 0,01 |
Таблица 3
Динамика коэффициентов стимуляции при оценке неферментных катионных белков нейтрофилов у молодняка крупного рогатого скота в разные сроки после вакцинации, M ± m
Table 3
Stimulation coefficient dynamics in tests for non-enzymatic cationic proteins of neutrophils in young cattle at different time points after vaccination, M ± m
|
Антиген |
Срок после вакцинации, сут |
|||||
|
до введения |
7 |
14 |
21 |
28 |
35 |
|
|
CS |
0,89 ± 0,18 |
1,22 ± 0,21 |
1,30 ± 0,10 |
1,49 ± 0,31 |
0,86 ± 0,12 |
0,96 ± 0,13 |
|
CR |
1,24 ± 0,14 |
1,25 ± 0,27 |
1,80 ± 0,26 |
1,03 ± 0,03a |
1,10 ± 0,26 |
1,38 ± 0,16 |
|
DS |
1,43 ± 0,18 |
1,45 ± 0,35 |
2,20 ± 0,19a |
1,41 ± 0,24 |
1,40 ± 0,20 |
1,16 ± 0,19 |
|
DR |
1,28 ± 0,18 |
1,31 ± 0,28 |
2,15 ± 0,11a |
1,52 ± 0,29 |
0,96 ± 0,12 |
0,74 ± 0,06a |
|
a p < 0,05. |
||||||
Таблица 4
Определение специфической сенсибилизации нейтрофилов к бруцеллам по анализу коэффициентов стимуляции НСТ-теста, миелопероксидазы и катионных белков
Table 4
Determination of specific sensitization of neutrophils to Brucella by analysis of stimulation coefficients of NBT test, myeloperoxidase and cationic proteins
|
Антиген |
Срок исследования, сут |
||||
|
7 |
14 |
21 |
28 |
35 |
|
|
НСТ-тест |
|||||
|
CS |
+0,05 |
+1,21 |
+1,39 |
+1,21 |
+1,30 |
|
CR |
+0,52 |
+0,30 |
+0,24 |
+0,60 |
+0,13 |
|
DS |
–0,14 |
+0,41 |
+0,61 |
+0,67 |
–0,20 |
|
DR |
–0,19 |
–0,14 |
+0,93 |
+2,38 |
–0,10 |
|
миелопероксидаза |
|||||
|
CS |
+0,50 |
+0,53 |
+0,67 |
+0,50 |
+0,54 |
|
CR |
–0,30 |
–0,72 |
+0,96 |
–1,47 |
–0,90 |
|
DS |
–0,17 |
–0,29 |
–0,53 |
–2,78 |
–0,44 |
|
DR |
+0,40 |
+0,22 |
+1,69 |
–0,66 |
–0,07 |
|
катионные белки |
|||||
|
CS |
+1,06 |
+1,32 |
+1,93 |
–0,10 |
+0,21 |
|
CR |
+0,05 |
+2,23 |
–1,47 |
–0,56 |
+0,55 |
|
DS |
+0,06 |
+2,42 |
–0,07 |
–0,09 |
–0,85 |
|
DR |
+0,09 |
+2,76 |
+0,76 |
–1,01 |
–1,69 |
ЗАКЛЮЧЕНИЕ
На основании проведенных исследований можно прийти к заключению, что функционально-метаболическая активность нейтрофилов у молодняка крупного рогатого скота, иммунизированного B. abortus RB-51, характеризуется усилением спонтанной и стимулированной тетразолиевой активности нейтрофилов независимо от применяемого антигена на 7-е и 35-е сут после вакцинации в 1,1–2,4 раза, снижением концентрации катионных белков с 7–14-х сут от начала эксперимента в 1,2–2,1 раза при отсутствии выраженных изменений в содержании миелопероксидазы.
Выраженное увеличение коэффициентов стимуляции в 1,5–2,3 раза наблюдали при применении дезинтегрированных антигенов. По результатам математической обработки методом нормированного отклонения максимальные значения коэффициентов стимуляции отмечали при оценке аэробного метаболизма нейтрофилов (НСТ-тест) на 28-е сут после инокуляции вакцинного штамма при внесении DR-антигена (t = +2,38), а при анализе анаэробного метаболизма (катионные белки) – на 14-е сут с применением DS- и DR-антигенов (соответственно t = +2,42 и +2,76), что свидетельствовало о выраженной специфической сенсибилизации нейтрофилов к бруцеллам.
Список литературы
1. Arakelyan P. K., Dimova A. S., Dimov S. K., Rudenko A. V., Yanchenko T. A., Orobets V. A. Ecological bases of the epizootic process of brucellosis and its control in small ruminants. IOP Conference Series: Earth and Environmental Science. 2021; 723:042015. https://doi.org/10.1088/1755-1315/723/4/042015
2. Гордиенко Л. Н., Новиков А. Н., Куликова Е. В. Динамика развития эпизоотического процесса в свежем очаге бруцеллеза, возникшем на фоне длительного благополучия. Ветеринария. 2023; (6): 16–19. https://doi.org/10.30896/0042-4846.2023.26.6.16-19
3. Elrashedy A., Gaafar M., Mousa W., Nayel M., Salama A., Zaghawa A., et al. Immune response and recent advances in diagnosis and control of brucellosis. German Journal of Veterinary Research. 2022; 2 (1): 10–24. https://doi.org/10.51585/gjvr.2022.1.0033
4. Аракелян П. К., Трегубов А. Н., Вергун А. А., Ильин Е. Н., Димова А. С., Димов С. К., Янченко Т. А. Роль специфической профилактики в контроле эпизоотического процесса бруцеллеза крупного рогатого скота. Ветеринария. 2021; (11): 28–32. https://doi.org/10.30896/0042-4846.2021.24.11.28-32
5. Аракелян П. К., Трегубов А. Н., Вергун А. А., Ильин Е. Н., Янченко Т. А., Димова А. С. и др. Эффективность конъюнктивальной иммунизации крупного рогатого скота вакциной из штамма B. abortus 19 при бруцеллезе. Ветеринария. 2020; (10): 9–12. https://doi.org/10.30896/0042-4846.2020.23.10.09-12
6. Heidary M., Dashtbin S., Ghanavati R., Mahdizade Ari M., BostanghadiriN., DarbandiA., et al. Evaluationofbrucellosis vaccines: Acomprehensive review. Frontiers in Veterinary Science. 2022; 9:925773. https://doi.org/10.3389/fvets.2022.925773
7. Gheibi A., Khanahmad H., Kashfi K., Sarmadi M., Khorramizadeh M. R. Development of new generation of vaccines for Brucella abortus. Heliyon. 2018; 4 (12):e01079. https://doi.org/10.1016/j.heliyon.2018.e01079
8. Simpson G. J. G., Marcotty T., Rouille E., Chilundo A., Letteson J.-J., Godfroid J. Immunological response to Brucella abortus strain 19 vaccination of cattle in a communal area in South Africa. Journal of the South AfricanVeterinaryAssociation. 2018; 89:a1527. https://doi.org/10.4102/jsava.v89i0.1527
9. Senevirathne A., Hewawaduge C., Lee J. H. Attenuated Salmonella secreting Brucella protective antigens confer dual-faceted protection against brucellosis and salmonellosis in a mouse model. Veterinary Immunology and Immunopathology. 2019; 209: 31–36. https://doi.org/10.1016/j.vetimm.2019.02.001
10. Zimmermann P., Curtis N. Factors that influence the immune response to vaccination. ClinicalMicrobiology Reviews. 2019; 32 (2):e00084-18. https://doi.org/10.1128/CMR.00084-18
11. Абдессемед Д., Агольцов В. А., Веселовский С. Ю., Попова О. М., Красникова Е. С., Семиволос А. М., Девришов Д. А. Значение клеточных факторов иммунитета при применении экологически безопасной сплит-конъюгированной противобруцеллезной вакцины в сочетании с иммуномодуляторами. Теоретическая и прикладная экология. 2020; (2): 172–179. https://doi.org/10.25750/1995-4301-2020-2-172-179
12. Celli J. The intracellular life cycle of Brucella spp. Microbiology Spectrum. 2019; 7:10.1128/microbiolspec.bai-0006-2019. https://doi.org/10.1128/microbiolspec.bai-0006-2019
13. Сакидибиров О. П., Дмитриев А. Ф. Критерии оценки сущности функционирования инфекционных паразитарных систем хронических инфекций. Известия Дагестанского ГАУ. 2023; (2): 126–130. https://elibrary.ru/nakndr
14. Avila-Calderón E. D., Flores-Romo L., Sharon W., Donis-Maturano L., Becerril-García M. A., Arreola M. G. A., et al. Dendritic cells and Brucella spp. interaction: the sentinel host and the stealthy pathogen. FoliaMicrobiologica. 2020; 65 (1): 1–16. https://doi.org/10.1007/s12223-019-00691-6
15. Çelik M., Ceylan M. R., Altındağ D., Dinçer N. G., Alkan S. Diagnostic significance of hematological parameters in brucellosis. Journal of Clinical Medicine of Kazakhstan. 2023; 20 (1): 50–55. https://doi.org/10.23950/jcmk/12929
16. Moreno E., Barquero-Calvo E. The role of neutrophils in brucellosis. Microbiology andMolecular Biology Reviews. 2020; 84 (4):e00048-20. https://doi.org/10.1128/MMBR.00048-20
17. Кулаков Ю. К. Молекулярные механизмы персистенции возбудителя бруцеллеза. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018; 95 (4): 68–76. https://doi.org/10.36233/0372-9311-2018-4-68-76
18. Горчакова Н. Г. Особенности паразитарной системы бруцеллеза. Научно-исследовательские публикации. 2017; (4): 14–27. https://elibrary.ru/yqdcts
19. Алимов А. М., Закирова Л. А. Показатели клеточного иммунитета у морских свинок при вакцинации и экспериментальной бруцеллезной инфекции. Ученые записки Казанской государственной академии ветеринарной медицины им. Н. Э. Баумана. 2016; 227 (3): 4–7. https://elibrary.ru/wmapzf
20. Дегтяренко Л. В., Власенко В. С., Скляров О. Д. Оценка иммунологических тестов при бруцеллезе собак, вызываемом B. canis. Ветеринария. 2016; (7): 60–63. https://elibrary.ru/wjdhhb
21. Дегтяренко Л. В., Власенко В. С., Бронников В. С. Оценка механизмов иммуногенеза у морских свинок, сенсибилизированных бруцеллами. Вестник ветеринарии. 2015; (2): 42–46. https://elibrary.ru/tvqmnx
22. Иванов Н. П. Научные основы разработки диагностических препаратов из бруцелл: автореф. дис. … д-ра вет. наук. Казань; 1984. 41 с.
23. Дегтяренко Л. В., Гордиенко Л. Н., Власенко В. С., Гулюкин М. И., Альбертян М. П., Искандаров М. И. и др. Методы иммунологической оценки животных, сенсибилизированных измененными формами бруцелл: методическое пособие. М.; Омск: ЛИТЕРА; 2017. 30 с. https://elibrary.ru/zenyrb
24. Хитрик Н. М. Функциональная активность фагоцитов у больных с инфекцией, вызванной вирусом простого герпеса: автореф. дис. … канд. мед. наук. М.; 2007. 28 с.
25. Власенко В. С., Борисов Е. С., Кособоков Е. А. Оценка эффективности иммунных реакций на введение иммунобиологических препаратов. Свидетельство о государственной регистрации программы для ЭВМ № 2023611548 Российская Федерация. ФГБНУ «Омский аграрный научный центр». № 2023610734. Заявл. 23.01.2023. Опубл. 23.01.2023. Бюл. № 2.
26. Манакова О. О., Янченко Т. А., Власенко В. С. Испытание экспериментальных бруцеллезных антигенов в стимулированном клеточном тесте с нитросиним тетразолием. Вестник НГАУ (Новосибирский государственный аграрный университет). 2024; (1): 212–218. https://doi.org/10.31677/2072-6724-2024-70-1-212-218
27. Манакова О. О., Янченко Т. А., Власенко В. С. Особенности кислород-независимого метаболизма нейтрофилов у животных, сенсибилизированных неагглютиногенным штаммом бруцелл. Сибирский вестник сельскохозяйственной науки. 2024; 54 (5): 81–88. https://doi.org/10.26898/0370-8799-2024-5-8
Об авторах
О. О. МанаковаРоссия
Манакова Ольга Олеговна, младший научный сотрудник лаборатории специфической профилактики бруцеллеза отдела ветеринарии
пр. Королёва, 26, г. Омск, 644012
Т. А. Янченко
Россия
Янченко Татьяна Александровна, канд. биол. наук, ведущий научный сотрудник лаборатории специфической профилак тики бруцеллеза отдела ветеринарии
пр. Королёва, 26, г. Омск, 644012
В. С. Власенко
Россия
Власенко Василий Сергеевич, д-р биол. наук, профессор, главный научный сотрудник лаборатории эпизоотологии и мер борьбы с туберкулезом отдела ветеринарии
пр. Королёва, 26, г. Омск, 644012
Рецензия
Для цитирования:
Манакова О.О., Янченко Т.А., Власенко В.С. Функционально-метаболическая активность нейтрофилов у молодняка крупного рогатого скота, сенсибилизированного неагглютиногенным штаммом бруцелл. Ветеринария сегодня. 2025;14(1):62-68. https://doi.org/10.29326/2304-196X-2025-14-1-62-68
For citation:
Manakova O.O., Yanchenko T.A., Vlasenko V.S. Functional and metabolic activity of neutrophils in young cattle sensitized with a non-agglutinogenic strain of Brucella. Veterinary Science Today. 2025;14(1):62-68. https://doi.org/10.29326/2304-196X-2025-14-1-62-68
JATS XML



































