Перейти к:
Изучение инфекционного процесса у кур при различных способах заражения вирусом ньюкаслской болезни генотипа VII
https://doi.org/10.29326/2304196X-2025-14-4-401-409
Аннотация
Введение. Ньюкаслская болезнь птиц входит в перечень нотифицируемых болезней и является актуальной проблемой современного птицеводства. К настоящему времени известно о существовании различных генотипов возбудителя, отличающихся друг от друга по вирулентности. Все больший интерес в последние годы вызывает вирус ньюкаслской болезни генотипа VII, который инициирует тяжелую форму болезни среди кур и других видов коммерческой птицы вплоть до 100%-й летальности поголовья.
Цель исследования. Изучение инфекционного процесса, а также клинических и патолого-анатомических особенностей ньюкаслской болезни птиц при экспериментальном заражении кур разными способами.
Материалы и методы. Провели экспериментальное заражение вирусом ньюкаслской болезни генотипа VII 30-суточных цыплят тремя разными способами: интраназально, перорально и внутримышечно. Через 48 ч после инфицирования в каждую группу поместили по 6 интактных цыплят. В течение последующих 10 сут оценивали клиническое состояние зараженной и контактной птицы, собирали и исследовали методом полимеразной цепной реакции ротоглоточные и клоакальные смывы и проводили патолого-анатомическое вскрытие павшей птицы.
Результаты. В ходе поставленного эксперимента было установлено, что изолят NDV/chicken/rus/Saratov/2403-3/22 вызывает гибель птицы в течение 5–7 сут. При внутримышечном заражении болезнь и гибель птицы наступали быстрее, чем при пероральном и интраназальном инфицировании. В исследованных методом полимеразной цепной реакции образцах ротоглоточных и клоакальных мазков был выявлен геном вируса ньюкаслской болезни. Неспецифические признаки болезни были зафиксированы у всех особей, однако преобладание определенного симптомокомплекса зависело от способа заражения: у птиц, инфицированных внутримышечно и перорально, отмечались ярко выраженные неврологические симптомы; респираторные признаки были характерны при пероральном и интраназальном заражениях. Результаты вскрытия свидетельствуют о том, что специфические патолого-анатомические признаки, характерные для ньюкаслской болезни, развивались после 24 ч с момента начала болезни. У особей, павших ранее, был обнаружен ряд патологических изменений внутренних органов, которые тем не менее не являлись информативными для диагностики ньюкаслской болезни при вскрытии.
Заключение. Штамм вируса ньюкаслской болезни генотипа VII NDV/chicken/rus/Saratov/2403-3/22 является патогенным для кур при экспериментальном инфицировании. Болезнь легко воспроизводится при внутримышечном, интраназальном и пероральном способах заражения и характеризуется молниеносным течением с развитием респираторных и неврологических симптомов.
Ключевые слова
Для цитирования:
Вершинина М.А., Мороз Н.В., Фролов С.В., Долгов Д.Л., Курненкова Е.В., Щербакова Л.О. Изучение инфекционного процесса у кур при различных способах заражения вирусом ньюкаслской болезни генотипа VII. Ветеринария сегодня. 2025;14(4):401-409. https://doi.org/10.29326/2304196X-2025-14-4-401-409
For citation:
Vershinina M.A., Moroz N.V., Frolov S.V., Dolgov D.L., Kurnenkova E.V., Scherbakova L.O. Investigating the infectious process in chickens infected with Newcastle disease virus genotype VII via different routes. Veterinary Science Today. 2025;14(4):401-409. (In Russ.) https://doi.org/10.29326/2304196X-2025-14-4-401-409
ВВЕДЕНИЕ
На протяжении века ньюкаслская болезнь птиц представляет серьезную угрозу птицеводству и продолжает наносить значительный экономический ущерб хозяйствам по всему миру. Несмотря на активные усилия по вакцинации, в последние десятилетия внимание исследователей привлекли постоянные вспышки ньюкаслской болезни и их пагубные последствия для птицеводства [1]. Болезнь вызывается вирулентным птичьим ортоавулавирусом (Orthoavulavirus javaense, OAVJ). Данный патоген относится к семейству Paramyxoviridae [2] и ранее обозначался многими авторами как парамиксовирус птиц серотипа 1 (APMV-1) [3]. Геном вируса ньюкаслской болезни (NDV) представлен одноцепочечной отрицательной молекулой РНК, что соответствует порядку Mononegavirales, а сам возбудитель имеет спиральную симметрию капсида и реплицируется в цитоплазме пораженной клетки [4][5]. Хотя все штаммы вируса ньюкаслской болезни являются представителями OAVJ и относятся к одному серотипу, между различными генотипами наблюдается антигенное и генетическое разнообразие [6]. Длина генома и особенности нуклеотидных последовательностей изолятов легли в основу их разделения на классы (I и II) [7, 8]. Штаммы класса I принадлежат к одному генотипу, тогда как представители класса II отличаются большим разнообразием и в настоящее время разделены на 21 генотип на основе комплексного секвенирования кодирующей области гибридного гена F [7][9-11].
К вирусу ньюкаслской болезни восприимчиво большое количество птиц, хотя вирулентность возбудителя и исход болезни различаются в зависимости от конкретного вида [12]. Многочисленные виды домашней птицы, включая бройлеров, кур-несушек, голубей, уток, индеек, страусов, павлинов, фазанов, водоплавающих птиц и попугаев (Psittacidae), подвержены заражению различными штаммами вируса ньюкаслской болезни по всему миру. Все больший интерес в последние годы вызывает генотип VII, возникший еще в 1990-х гг., но превалирующий в настоящее время в Азии и на Ближнем Востоке, а также в Европе, Южной Африке и Южной Америке [13]. В силу своей высокой вирулентности он вызывает тяжелую форму болезни у кур и других видов коммерческой птицы вплоть до 100%-й летальности поголовья. Представители генотипа VII первоначально были разделены на два субгенотипа: штаммы подтипа VIIa, которые появились в 1990-х гг. на Дальнем Востоке и распространились в Европе и Азии, и штаммы подтипа VIIb, возникшие на Дальнем Востоке и распространившиеся в Южной Африке [14]. С течением времени классификация претерпела ряд изменений, и генотип VII был разделен на 8 субгенотипов, в том числе субгенотип VII-L, ассоциируемый в последние годы со вспышками ньюкаслской болезни в Иране [15] и других странах. В настоящее время введены новые номенклатурные критерии, на основании которых генотип VII включает три субгенотипа: VII.1.1, VII.1.2 и VII.2 [16]. Известно, что субгенотип VI.1.1 привел к третьей панзоотии у голубей в 1980-х гг.; четвертая панзоотия, начавшаяся в 1985 г., и последняя, пятая, панзоотия также были вызваны вирусом ньюкаслской болезни генотипа VII [17].
В зависимости от степени вирулентности вирус ньюкаслской болезни подразделяется на четыре патотипа: велогенный, мезогенный, лентогенный и бессимптомный кишечный, хотя проявление этих патотипов не всегда может быть четко выражено [18]. Велогенные штаммы далее делятся на висцеротропные, вызывающие множественные геморрагии, и нейротропные, при инфицировании которыми характерны неврологические и дыхательные расстройства [19]. Заражение происходит в основном при вдыхании или проглатывании вируса, выделяемого инфицированными птицами с фекалиями и респираторными секретами в течение различного периода времени [20, 21], а также через конъюнктиву. При этом эффективность передачи возбудителя от птицы к птице зависит от наличия вируса в инфекционной форме [22]. Заражение может произойти в результате вдыхания крупных капель или мелкодисперсных аэрозолей, содержащих инфекционный вирус, однако алиментарный путь инфицирования, вероятно, является основным [23]. Болезнь развивается быстро, ее признаки проявляются у всего стада уже через 2 сут (в среднем через 4–6 сут) при аэрогенной передаче возбудителя инфекции, но инкубационный период может достигать и 15 сут при заражении фекально-оральным способом, особенно у птиц, содержащихся в клетках
[24][25]. По данным некоторых авторов, при экспериментальном инфицировании длительность инкубационного периода составляет от 2 до 5 сут [23]. Согласно данным Всемирной организации здравоохранения животных (ВОЗЖ), максимальный инкубационный период при ньюкаслской болезни составляет 21 сут.
Клинически болезнь проявляется нарушениями со стороны пищеварительной, дыхательной и нервной систем, при этом симптомы могут отличаться в зависимости от вирулентности вируса, возраста, иммунного статуса и восприимчивости организма птицы [26]. У зараженных птиц часто наблюдается угнетение, снижение аппетита, взъерошенность перьев, конъюнктивиты, возможна диарея с зеленым или белым цветом фекальных масс [23]. Зеленый цвет кала обусловлен нарушением выработки печенью и поджелудочной железой желчи и пищеварительных ферментов [27]. К респираторным симптомам относятся кашель и хрипы, к нервным – тремор, паралич крыльев и ног, кривошея и манежные движения. Неврологические симптомы могут проявляться одновременно с другими, но, как правило, возникают позднее по мере прогрессирования болезни [23].
Для ньюкаслской болезни описан ряд характерных патолого-анатомических изменений, хотя их выраженность также может значительно отличаться в зависимости от вирулентности конкретного изолята и восприимчивости организма. Значительные патолого-анатомические изменения обычно наблюдаются только при инфицировании велогенными штаммами вируса ньюкаслской болезни. Для патолого-анатомической картины характерны петехии на серозных оболочках, кровоизлияния в слизистую оболочку преджелудка и серозную оболочку кишечника, сопровождаемые многоочаговыми некротическими геморрагическими поражениями, особенно в лимфоидных образованиях, таких как слепокишечные (цекальные) миндалины [25]. Селезенка может быть увеличена, покрыта пятнами и некротизирована [28]. В легочной ткани возможно наличие гиперемии, а также многоочаговых кровоизлияний (от точечных до экхиматозных) и некротических участков. В области гребня иногда наблюдаются небольшие кровоподтеки и цианоз [29]. У кур, инфицированных велогенным висцеротропным вирусом ньюкаслской болезни, могут обнаруживаться застойные явления и кровоизлияния в трахею. Также сообщается, что у кур, в отличие от гусей, вирус присутствует в головном мозге и, как следствие, оказывает на его структуры патологическое воздействие [30]. Другие авторы подтверждают данную информацию, указывая, что при заражении цыплят некоторыми штаммами вируса ньюкаслской болезни в оболочках головного мозга могут наблюдаться гиперемия и многоочаговые точечные кровоизлияния [25]. Поражения при инфекциях, обусловленных лентогенными штаммами, обычно связаны с утолщением мембран воздушных мешочков в результате воспаления и пневмонии, вызванных вирусом или вторичной бактериальной инфекцией [29].
В Российской Федерации в 2019 г. произошло резкое обострение ситуации по ньюкаслской болезни с распространением вируса субгенотипа VII-L (VII 1.1) по всей территории страны – от Приморского края до Курской области. В итоге зарегистрировано 17 неблагополучных пунктов, все – в личных подсобных хозяйствах, где содержалось невакцинированное поголовье [31]. По данным ВОЗЖ, всего в 2023 г. было зафиксировано 289 вспы-
шек ньюкаслской болезни среди домашней птицы, 13 из которых – в пределах Российской Федерации1. В 2024 г. ньюкаслская болезнь была зарегистрирована в 15 странах Америки, Азии, Африки и Европы, а из 518 официально зафиксированных вспышек наибольшее число пришлось на Нигерию (212) и Ирак (187)2. Несмотря на интенсивные программы вакцинации, вспышки ньюкаслской болезни, вызванные вирусом генотипа VII, и спорадические случаи периодически возникают даже в вакцинированных хозяйствах в Южной Америке [32] и азиатских странах [33]. Более того, штаммы генотипа VII способны расширять ареал своего распространения, что иногда приводит к заболеванию водоплавающих птиц [34]. Повторные вспышки ньюкаслской болезни среди иммунизированного поголовья могут указывать на неэффективность существующих вакцин ввиду антигенных различий между вакцинным и полевым штаммами или схем вакцинаций, применяемых для борьбы с заболеванием [13].
В настоящее время наиболее широко используемые вакцины против ньюкаслской болезни созданы на основе вируса ранних генотипов, в основном I и II, которые были выделены около 70 лет назад, в то время как преобладающие штаммы возбудителя ньюкаслской болезни у домашней птицы относятся к поздним генотипам, включая генотип V в Америке, генотип VII в Азии и Африке, а также генотип VI у голубей на разных континентах, которые генетически и антигенно отличаются [35].
Анализ эпизоотической ситуации в мире свидетельствует о наличии рисков заноса возбудителя на территорию нашей страны, что делает значимыми вопросы
профилактики данной болезни с целью предотвращения
ее появления и распространения. Научные исследования, посвященные изучению инфекционного процесса при заражении кур велогенными штаммами вируса ньюкаслской болезни, проведены многими авторами из различных стран мира. Однако в отечественной литературе существует мало публикаций, затрагивающих указанную проблему. Таким образом, проведение сравнительной оценки инфекционного процесса у кур при различных способах заражения вирулентным вирусом ньюкаслской болезни является актуальной задачей.
Воспроизведение инфекционного процесса при ньюкаслской болезни, вызванной вирусом генотипа VII, в экспериментальных условиях имеет важное значение для изучения свойств возбудителя и определения стандартных признаков развития болезни у восприимчивых животных с целью дальнейшего совершенствования мер специфической профилактики.
МАТЕРИАЛЫ И МЕТОДЫ
Вирус. Для заражения использовали вирулентный изолят вируса ньюкаслской болезни NDV/chicken/rus/Saratov/2403–3/22 субгенотипа VII.1.1 (VII-L) генотипа VII
в заражающей дозе 6,0 lgЭИД50 согласно рекомендациям ВОЗЖ3. Данный изолят относится к группе велогенных на основании результатов секвенирования сайта расщепления белка F, а также значения индекса интрацеребральной патогенности, равного 1,62 [36].
Птица. Эксперимент был поставлен на цыплятах, полученных из SPF-яиц (VALO BioMedia GmbH, Германия). На момент инокуляции вируссодержащего материала возраст цыплят составлял 30 сут. Отсутствие специфических антител к вирусу ньюкаслской болезни подтверждали путем исследования сыворотки крови птиц, полученной до заражения, в реакции торможения гемагглютинации.
Способы заражения. Для моделирования инфекционного процесса использовали три различных способа заражения. Интраназальный метод заключался в закапывании в нос вируссодержащей суспензии в заражающей дозе в объеме 0,1 см3; пероральный – в выпаивании с водой вируссодержащей суспензии в заражающей дозе в объеме 1,0 см3; внутримышечный – в инъекционном введении в область бедра вируссодержащей суспензии в заражающей дозе в объеме 0,5 см3.
Контрольных птиц не заражали.
Схема опыта. Подопытных птиц разделили на три равные группы по 8 гол. в каждой и заразили вышеуказанными методами. Через 48 ч после инфицирования к опытным группам поместили по 6 интактных цыплят. Опытные группы формировались в соответствии с «Правилами регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза» (решение Совета Евразийской экономической комиссии от 21 января 2022 г. № 1)4. В течение последующих 10 сут оценивали клиническое состояние зараженной и контактной птицы согласно ГОСТ Р 58090–2018 «Клиническое обследование непродуктивных животных. Общие требования»5. Осуществляли сбор ротоглоточных и клоакальных смывов в период разгара болезни в соответствии с «Методическими рекомендациями по отбору, хранению и транспортировке проб биоматериала для проведения диагностических исследований на грипп птиц и болезнь Ньюкасла»6. Также проводили патолого-анатомическое вскрытие павших птиц согласно ГОСТ Р 57547–2017 «Услуги для непродуктивных животных. Патологоанатомическое исследование трупов непродуктивных животных. Общие требования»7. Процедура вскрытия включала в себя наружный осмотр трупа животного и исследование внутренних органов различных систем на предмет наличия в них патологических изменений. Оценка состояния органов репродуктивной системы была затруднена в силу возраста опытной птицы.
Проводили ежедневное наблюдение за клиническим состоянием опытных птиц с фиксацией фаз течения болезни, различных проявлений и признаков болезни, а также гибели птиц. Павших птиц вскрывали и фиксировали все патологические изменения. Специфичность гибели подтверждали с использованием полимеразной цепной реакции (ПЦР).
Все эксперименты на животных проводились в строгом соответствии с межгосударственным стандартом по содержанию и уходу за лабораторными животными ГОСТ 33215-2014, принятым Межгосударственным советом по стандартизации, метрологии и сертификации, а также согласно требованиям Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Исследования одобрены комиссией по биоэтике ФГБУ «ВНИИЗЖ» (заключение от 25.07.2025).
Индикация вируса. Выявление генома вируса ньюкаслской болезни в ротоглоточных и клоакальных мазках проводили методом ПЦР в режиме реального времени в соответствии с «Методическими указаниями по выявлению РНК и дифференциации вирулентных изолятов вируса ньюкаслской болезни методом ОТ-ПЦР в режиме реального времени»8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Инфекционный процесс. В ходе поставленного эксперимента было установлено, что исследуемый вирус ньюкаслской болезни генотипа VII субгенотипа VII.1.1 является контагиозным для кур во всех опытных группах. Была продемонстрирована способность возбудителя передаваться от больных птиц здоровым и вызывать 100%-ю гибель как экспериментально зараженных, так и контактных птиц. Основные показатели, характеризующие течение инфекционного процесса в каждой опытной группе, представлены в таблице 1.
Установлено, что наиболее короткий инкубационный период наблюдался при внутримышечном и пероральном способах заражения (2 сут), а наиболее длинный (3 сут) – при интраназальном заражении, что соответствует данным, представленным ВОЗЖ, а также некоторыми другими источниками [23, 25].
Срок гибели цыплят был самым коротким при внутримышечном заражении, средним – при пероральном, а самым длинным – при интраназальном (5, 6 и 7 сут соответственно). Птицы во всех опытных группах, как исходно зараженные, так и контактные, выделяли вирус с фекалиями и ротоглоточными истечениями. Динамика инфекционного процесса у цыплят контактной группы в целом соответствовала динамике инфекционного процесса у экспериментально инфицированных цыплят.
Экспериментальные способы инокуляции вируса, имитирующие естественный путь заражения, за исключением парентерального (внутримышечного), вызывают развитие острого инфекционного процесса, характерного для велогенных штаммов вируса ньюкаслской болезни. Клинически болезнь у контактных цыплят проявлялась практически в одинаковые сроки с экспериментально зараженными цыплятами, что свидетельствует о высокой контагиозности и патогенности возбудителя.
Клинические признаки. Помимо данных об инфекционном процессе, в ходе исследования учитывались клинические признаки, зафиксированные в результате мониторинга состояния экспериментально зараженной и контактной птицы. Вариабельность клинических признаков ньюкаслской болезни у кур разных опытных групп представлена в таблице 2.
Как следует из полученных данных, неспецифические признаки болезни, такие как гипертермия (рис. 1), диарея, отсутствие аппетита и угнетение (рис. 2), были характерны для птиц во всех опытных группах. При диарее фекалии имели жидкую консистенцию и зеленоватый цвет.
По окончании инкубационного периода зараженные внутримышечно птицы демонстрировали более тяжелое и стремительное течение болезни с ранней гибелью, однако клиническая картина не всегда была четко выражена и могла быть ограничена неспецифическими проявлениями. Тем не менее у особей, инфицированных внутримышечно и перорально, отмечались ярко выраженные неврологические симптомы. При этом респираторные признаки заболевания, такие как кашель, чихание и хрипы, были характерны для особей в группах, где вируссодержащую суспензию вводили перорально и интраназально, а истечения из носа – только в случае интраназального заражения. Тем не менее ни в одной из групп нативно инфицированных цыплят, а также у контактной птицы не наблюдалось истечений из глаз или конъюнктивита, несмотря на то, что многие авторы указывают данный признак как характерный при заражении вирусом ньюкаслской болезни [25, 37]. Клинические признаки ньюкаслской болезни у контактной птицы всех трех групп были аналогичны клинической картине, наблюдаемой у птиц, инфицированных внутримышечно.
Патолого-анатомическое исследование. В результате патолого-анатомического вскрытия было установлено, что у птиц, павших в первые 24 ч после проявления клинических признаков, отсутствовали явные патолого-анатомические изменения внутренних органов, характерные для ньюкаслской болезни. Упитанность птиц оценивалась ниже средней, перьевой покров был взъерошен. Клюв и глазная щель закрыты, выделения отсутствовали. Под серозной оболочкой в области грудины отмечались незначительные петехии. Среди изменений внутренних органов брюшной полости присутствовали слабо выраженная гиперемия слизистой оболочки кишечника, без кровоизлияний
и/или очагов некроза, а также незначительное увеличение селезенки. Головной мозг отечен, с гиперемированными сосудами и кровоизлияниями.
У птиц, павших после 24 ч с момента проявления признаков ньюкаслской болезни, был обнаружен ряд патолого-анатомических изменений, которые отличались в зависимости от метода заражения и клинических проявлений. Упитанность туши оценивалась ниже средней, перья были взъерошены. Клоака закрыта, перья вокруг нее запачканы фекальными массами зеленоватого цвета. В интерстициальной ткани в области головы и шеи, особенно в области грудной части, наблюдали серозные отеки. Гребень и сережки бледные, иногда с синюшностью. У павших птиц, зараженных интраназально, были отмечены скопления экссудата на поверхности клюва и вокруг носовых отверстий. Слизистая оболочка ротовой полости у птиц всех опытных групп цианотичная, катарально-набухшая, слизистая оболочка глотки и пищевода покрасневшая, с множественными кровоизлияниями. Глотка и ротовая полость заполнены слизистым экссудатом (рис. 3). Наличие кровоизлияний на задней стенке глотки и трахеи (рис. 4) было отмечено у птиц, зараженных перорально и интраназально. Кровь в полости сердца и в крупных сосудах свернувшаяся, в некоторых случаях сердечная мышца дряблая. Легкие гиперемированы и отечны. Селезенка синеватого цвета, капсула напряженная. Слизистая оболочка кишечника гиперемирована на всем протяжении, с кровоизлияниями и очагами некроза. Лимфатические узлы увеличены. В некоторых случаях печень дряблая, неравномерно окрашена, почки увеличены в объеме, выходят за пределы костных впадин. Головной мозг отечен, с гиперемированными сосудами и кровоизлияниями.
У птиц, павших спустя 72–96 ч после начала болезни, были зафиксированы явные патологические изменения при наружном и внутреннем осмотрах. Трупы истощенные, перья взъерошены и загрязнены жидкими фекальными массами зеленого цвета. Кожа головы, гребень и бородка с выраженным цианозом, без кровоизлияний. На слизистой оболочке преджелудка присутствовали петехии и небольшие экхимозы. Кутикула желудка рыхлая, легко отслаивается. У некоторых особей слизистая оболочка на границе преджелудка и желудка была гиперемирована и пронизана кровоизлияниями в виде пояска (рис. 5). Селезенка темного цвета, с очагами некроза. Кишечник катарально воспален, с кровоизлияниями и очагами некроза, в том числе в области слепокишечных миндалин и лимфатической ткани. Головной мозг отечен, с гиперемированными сосудами и кровоизлияниями (рис. 6).
Описанные признаки в целом соответствуют результатам, полученным другими авторами при проведении аналогичных исследований [23, 37]. Патологические изменения со стороны головного мозга были обнаружены у всех опытных птиц вне зависимости от наличия или степени выраженности неврологических симптомов, способа заражения или срока гибели. Изменение цвета и увеличение селезенки являлось часто встречаемым признаком, несмотря на то, что некоторые источники указывают на отсутствие изменений данного органа при патолого-анатомической диагностике ньюкаслской болезни [38]. Специфические патолого-анатомические признаки развивались у особей, павших не ранее 24 ч с момента окончания инкубационного периода, и прогрессировали по мере развития болезни. При острой форме заболевания и ранней гибели птицы патолого-анатомические изменения носили слабо выраженный и неспецифический характер, а процедура вскрытия не являлась информативной для посмертной диагностики ньюкаслской болезни.
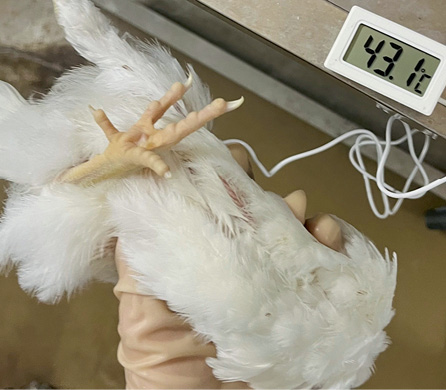
Рис. 1. Гипертермия у зараженной птицы
Fig. 1. Hyperthermia in infected chicks
Таблица 1
Характеристика инфекционного процесса при ньюкаслской болезни при различных методах заражения
Table 1
Infectious process in Newcastle disease following different routes of exposure
Исследуемые показатели | Экспериментально зараженная птица | Контакт- ная птица | Контроль | ||
Способ заражения | |||||
Внутри- мышечный | Пероральный | Интра-назальный | |||
Инкубационный период, сут | 2 | 2 | 3 | 3 | – |
Срок гибели цыплят после заражения, сут | 5 | 6 | 7 | 6 | – |
Летальность, % | 100 | 100 | 100 | 100 | – |
Присутствие генома вируса в клоакальных мазках | + | + | + | + | – |
Присутствие генома вируса в ротоглоточных мазках | + | + | + | + | – |
Таблица 2
Клинические проявления ньюкаслской болезни у кур в зависимости от способа заражения
Table 2
Influence of exposure route on the clinical manifestation of Newcastle disease in chickens
Клинические признаки | Экспериментально зараженная птица | Контактная птица | ||
Способ заражения | ||||
Внутри- мышечный | Пероральный | Интра- назальный | ||
Угнетение | + | + | + | + |
Отсутствие аппетита | + | + | + | + |
Диарея | + | + | + | + |
Гипертермия | + | + | + | + |
Кашель, чихание | – | + | + | – |
Хрипы | – | + | + | – |
Истечения из носа | – | – | + | – |
Истечения из глаз, конъюнктивит | – | – | – | – |
Неврологические симптомы (шаткость походки, кривошея, тремор головы и конечностей) | + | + | – | + |

Рис. 2. Взъерошенные перья и общее угнетение зараженной птицы (справа) и клинически здоровая контактная птица (слева)
Fig. 2. Ruffled feathers and general depression (right chick) and a clinically healthy contact chick (left)
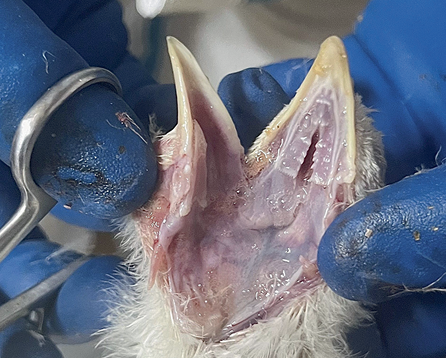
Рис. 3. Скопление слизистого экссудата в ротовой полости и ротоглотке
Fig. 3. Accumulation of mucosal exudate in the mouth and pharynx
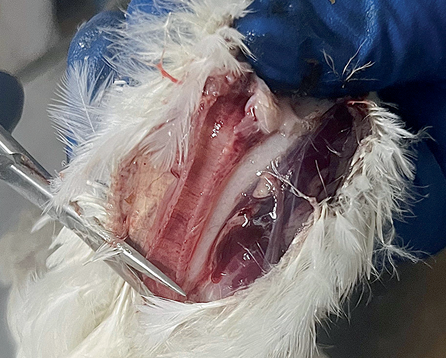
Рис. 4. Кровоизлияния на задней стенке глотки и слизистой оболочке трахеи
Fig. 4. Submucosal hemorrhages in the posterior oropharynx and trachea
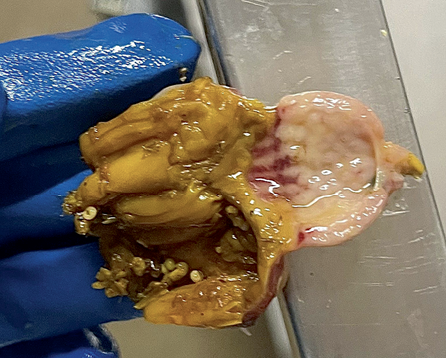
Рис. 5. Кровоизлияния в виде пояска на границе железистого и мышечного желудков
Fig. 5. Hemorrhagic banding at the proventricular-ventricular junction
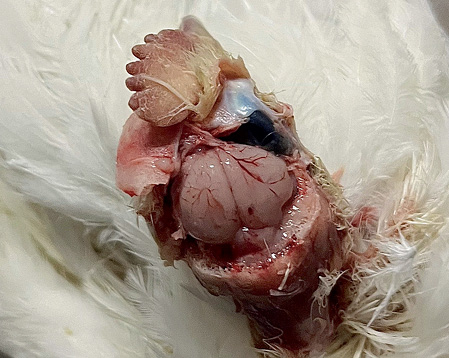
Рис. 6. Отечный головной мозг с кровоизлияниями
Fig. 6. Cerebral edema with associated hemorrhages
ЗАКЛЮЧЕНИЕ
Изучение биологических свойств штаммов вируса ньюкаслской болезни генотипа VII и вызываемого ими инфекционного процесса лежит в основе улучшения мер профилактики данной болезни и, как следствие, предупреждения новых вспышек.
В ходе настоящего исследования была экспериментально подтверждена контагиозность изолята вируса ньюкаслской болезни генотипа VII субгенотипа VII-L NDV/chicken/rus/Saratov/2403–3/22 для кур при внутримышечном, пероральном и интраназальном способах заражения, а также доказана его способность выделяться во внешнюю среду органами респираторной и пищеварительной систем. Было установлено, что заражающая доза, равная 6,0 lgЭИД50, является абсолютно летальной для цыплят SPF-стада в возрасте 30 сут, поскольку вызывает в экспериментальных условиях 100%-ю гибель опытных птиц.
Специфические клинические признаки ньюкаслской болезни у птиц зависели от способа инфицирования и отличались по исследуемым группам: с преобладанием неврологических симптомов после внутримышечного заражения и у контактных птиц; с преобладанием респираторных признаков при интраназальном введении вируссодержащей суспензии. Птицы, зараженные перорально, демонстрировали и неврологические, и респираторные симптомы болезни. В результате вскрытия павших птиц было установлено, что патолого-анатомическая картина ньюкаслской болезни характеризуется разнообразием патологических изменений, которые в большей степени определяются сроком гибели птицы с момента проявления болезни, чем способом заражения.
Установлено, что при внутримышечном введении велогенного изолята вируса ньюкаслской болезни генотипа VII субгенотипа VII–L NDV/chicken/rus/Saratov/2403–3/22 инкубационный период сокращается и гибель птиц наступает быстрее. Невзирая на то, что внутримышечный метод введения не является естественным, он широко применяется при контрольном заражении и рекомендован ВОЗЖ для оценки эффективности вакцин против ньюкаслской болезни. Следовательно, данный метод введения вируссодержащей суспензии изолята NDV/chicken/rus/Saratov/2403–3/22 можно считать наиболее предпочтительным при экспериментальном моделировании болезни.
1 Эпизоотическая ситуация по болезни Ньюкасла в мире (ВОЗЖ, 2023 г.). https://fsvps.gov.ru/wp-content/uploads/2023/10/БН-мир-2023.pdf
2 Эпизоотическая ситуация по болезни Ньюкасла в мире (ВОЗЖ, 2024 г.). https://fsvps.gov.ru/wp-content/uploads/2024/06/БН-мир-2024-2.pdf
3 Newcastle disease (infection with Newcastle disease virus). In: WOAH. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Сhapter 3.3.10. https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/3.03.10_NEWCASTLE_DIS.pdf
4 https://www.alta.ru/tamdoc/22sr0001/?ysclid=mghl9evtve540241408
5 https://files.stroyinf.ru/Data2/1/4293738/4293738274.pdf?ysclid=mghllls82495439970
6 Андрейчук Д. Б., Андриясов А. В., Волкова М. А., Чвала Ир. А., Волков М. С., Чвала Ил. А. Методические рекомендации по отбору, хранению и транспортировке проб биоматериала для проведения диагностических исследований на грипп птиц и болезнь Ньюкасла: утв. ФГБУ «ВНИИЗЖ» 24.06.2019. Владимир; 2019. 17 с.
7 https://files.stroyinf.ru/Data2/1/4293744/4293744536.pdf?ysclid=mghmownxuy341824070
8 МУ 47-16. Методические указания по выявлению РНК и дифференциации вирулентных изолятов вируса ньюкаслской болезни методом ОТ-ПЦР в режиме реального времени: утв. Россельхознадзором 06.06.2016. Владимир; 2016. 11 с.
Список литературы
1. Hassanzadeh M., Abedi M., Bashashati M., Yousefi A. R., Abdoshah M., Mirzaie S. Evaluation of the Newcastle disease virus genotype VII-mismatched vaccines in SPF chickens: A challenge efficacy study. Veterinary and Animal Science. 2024; 24:100348. https://doi.org/10.1016/j.vas.2024.100348
2. Rima B., Balkema- Buschmann A., Dundon W. G., Duprex P., Easton A., Fouchier R., et al. ICTV Virus Taxonomy Profile: Paramyxoviridae. Journal of General Virology. 2019; 100 (12): 1593–1594. https://doi.org/10.1099/jgv.0.001328
3. Ibrahim M., Wahba M. А., Yehia N. Molecular characterization of Newcastle disease virus genotype VII.1.1 from Egyptian mallard ducks with nervous manifestations. Journal of World’s Poultry Research. 2024; 14 (2): 219–235. https://doi.org/10.36380/jwpr.2024.23
4. Lamb R. A., Collins P. L., Kolakofsky D., Melero J. A., Nagai Y., Oldstone M. B., et al. Paramyxoviridae. In: Virus Taxonomy: Eighth Report of the International Committee on Taxonomy of Viruses. Ed. by C. M. Fauquet, M. A. Mayo, J. Maniloff, U. Desselberger, L. A. Ball. San Diego: Elsevier Academic Press; 2005; 655–668.
5. Alexander D. J. Newcastle disease. British Poultry Science. 2001; 42 (1): 5–22. https://doi.org/10.1080/713655022
6. Miller P. J., Koch G. Newcastle Disease. In: Disease of Poultry. Ed. by D. E. Swayne. 13th ed. John Wiley & Sons; 2013; Chapter 3: 89–107. https://doi.org/10.1002/9781119421481.ch3
7. Mossie T., Abera D. A compressive review on Newcastle disease virus in Ethiopia. Journal of Veterinary Science and Technology. 2024; 15 (4). https://doi.org/10.37421/2157-7579.2024.15.254
8. Courtney S. C., Gomez D., Susta L., Hines N., Pedersen J. C., Miller P. J., Afonso C. L. Complete genome sequencing of a novel Newcastle disease virus isolate circulating in layer chickens in the Dominican Republic. Journal of Virology. 2012; 86 (17):9550. https://doi.org/10.1128/jvi.01491-12
9. Dzogbema K. F.-X., Talaki E., Batawui K. B., Dao B. B. Review on Newcastle disease in poultry. International Journal of Biological and Chemical Sciences. 2021; 15 (2): 773–789. https://doi.org/10.4314/ijbcs.v15i2.29
10. Czeglédi A., Ujvári D., Somogyi E., Wehmann E., Werner O., Lomniczi B. Third genome size category of avian paramyxovirus serotype 1 (Newcastle disease virus) and evolutionary implications. Virus Research. 2006; 120 (1–2): 36–48. https://doi.org/10.1016/j.virusres.2005.11.009
11. Sultan H. A., Talaat S., Elfeil W. K., Selim K., Kutkat M. A., Amer S. A., Choi K.-S. Protective efficacy of the Newcastle disease virus genotype VII-matched vaccine in commercial layers. Poultry Science. 2020; 99 (3): 1275–1286. https://doi.org/10.1016/j.psj.2019.10.063
12. Wajid A., Dimitrov K. M., Wasim M., Rehmani S. F., Basharat A., Bibi T., et al. Repeated isolation of virulent Newcastle disease viruses in poultry and captive non-poultry avian species in Pakistan from 2011 to 2016. Preventive Veterinary Medicine. 2017; 142: 1–6. https://doi.org/10.1016/j.prevetmed.2017.04.010
13. Shahsavandi Sh., Ebrahimi M. M., Tebianain M. The predominance of Newcastle disease virus genotype VII: genome diversity or poor cross-immunity of non-matched vaccines. Vaccine Research. 2021; 8 (2): 4–16. https://doi.org/10.52547/vacres.8.2.4
14. Aldous E. W., Mynn J. K., Irvine R. M., Alexander D. J., Brown I. H. A molecular epidemiological investigation of avian paramyxovirus type 1 viruses isolated from game birds of the order Galliformes. Avian Pathology. 2010; 39 (6): 519–524. https://doi.org/10.1080/03079457.2010.530938
15. Molouki A., Mehrabadi M. H. F., Bashashati M., Akhijahani M. M., Lim S. H. E., Hajloo S. A. NDV subgenotype VII(L) is currently circulating in commercial broiler farms of Iran, 2017–2018. Tropical Animal Health and Production. 2019; 51 (5): 1247–1252. https://doi.org/10.1007/s11250-019-01817-1
16. Dimitrov K. M., Abolnik C., Afonso C. L., Albina E., Bahl J., Berg M., et al. Updated unified phylogenetic classification system and revised nomenclature for Newcastle disease virus. Infection, Genetics and Evolution. 2019; 74:103917. https://doi.org/10.1016/j.meegid.2019.103917
17. Mihiretu B. D., Usui T., Chibssa T. R., Yamaguchi T. Genetic and antigenic characteristics of genotype VII.1.1 Newcastle disease viruses currently circulating in Ethiopian chickens. Virology Journal. 2025; 22:63. https://doi.org/10.1186/s12985-025-02686-x
18. Getabalew M., Alemneh T., Akeberegn D., Getahun D., Zewdie D. Epidemiology, diagnosis & prevention of Newcastle disease in poultry. American Journal of Biomedical Science and Research. 2019; 3 (1): 50–59. https://doi.org/10.34297/AJBSR.2019.03.000632
19. Dortmans J. C., Koch G., Rottier P. J., Peeters B. P. Virulence of Newcastle disease virus: what is known so far? Veterinary Research. 2011; 42:122. https://doi.org/10.1186/1297-9716-42-122
20. Leighton F. A., Heckert R. A. Newcastle disease and related avian paramyxoviruses. In: Infectious Diseases of Wild Birds. Ed. by N. J. Tomas, D. B. Hunter, C. T. Atkinson. 2007; Chapter 1: 1–16. https://doi.org/10.1002/9780470344668.ch1
21. Brown V. R., Bevins S. N. A review of virulent Newcastle disease viruses in the United States and the role of wild birds in viral persistence and spread. Veterinary Research. 2017; 48:68. https://doi.org/10.1186/s13567-017-0475-9
22. Alexander D. J. Newcastle disease: methods of spread. In: Newcastle Disease. Ed. by D. J. Alexander. Boston: Springer; 1988; Chap- ter 14: 256–272. https://doi.org/10.1007/978-1-4613-1759-3_14
23. Murree B., Nizamani Z. A., Leghari I. H., Soomro N. M., Samo T. M., Samo F. Pathology and transmission of experimental velogenic viscerotropic Newcastle disease in wild pigeons, broiler and Aseel chickens. Science International. 2016; 28 (4): 3965–3971. https://sci-int.com/Search?catid=71
24. Animal Health Australia. Disease strategy: Newcastle disease (Version 3.3). Australian Veterinary Emergency Plan (AUSVETPLAN). Ed. 3. Agriculture Ministers’ Forum. Canberra; 2014. https://animalhealthaustralia.com.au/wp-content/uploads/2015/12/ND-23-FINAL25Jun14.pdf
25. Dimitrov K. Newcastle Disease in Poultry (Avian Pneumoencephalitis, Exotic Newcastle Disease). MSD Veterinary Manual. 2023. https://www.msdvetmanual.com/poultry/newcastle-disease-and-other-paramyxovirus-infections/newcastle-disease-in-poultry
26. Alexander D. J., Gough R. E. Newcastle disease, other avian paramyxoviruses, and pneumovirus infections. In: Disease of Poultry. Ed. by Y. M. Saif et al. 11th ed. Ames: Iowa State University Press; 2003; 63–100.
27. Hewajuli D. A., Dharmayanti N. L. P. I. Patogenitas virus Newcastle disease pada ayam. Balai Besar Veteriner Bogor. 2011; 21 (2): 72–80.
28. Wakamatsu N., King D. J., Kapczynski D. R., Seal B. S., Brown C. C. Experimental pathogenesis for chickens, turkeys, and pigeons of exotic Newcastle disease virus from an outbreak in California during 2002–2003. Veterinary Pathology. 2006; 43 (6): 925–933. https://doi.org/10.1354/vp.43–6–925
29. Miller P. J. Improved Newcastle disease vaccine strategies to reduce shedding of virulent virus from infected birds: Author’s thesis for the degree doctor of philosophy. Athens; 2008. 186 p. https://openscholar.uga.edu/record/18089?ln=en&v=pdf
30. Xiang B., Chen R., Liang J., Chen L., Lin Q., Sun M., et al. Phylogeny, pathogenicity and transmissibility of a genotype XII Newcastle disease virus in chicken and goose. Transboundary and Emerging Diseases. 2020; 67 (1): 159–170. https://doi.org/10.1111/tbed.13335
31. Фролов С. В., Мороз Н. В., Чвала Ил. А., Ирза В. Н. Эффективность вакцин против ньюкаслской болезни производства ФГБУ «ВНИИЗЖ» в отношении актуальных вирусов VII генотипа. Ветеринария сегодня. 2021; (1): 44–51. https://doi.org/10.29326/2304-196X-2021-1-36-44-51
32. Diel D. G., Susta L., Cardenas Garcia S., Killian M. L., Brown C. C., Miller P. J., Afonso C. L. Complete genome and clinicopathological characterization of a virulent Newcastle disease virus isolate from South America. Journal of Clinical Microbiology. 2012; 50 (2): 378–387. https://doi.org/10.1128/jcm.0601-11
33. Roohani K., Tan S. W., Yeap S. K., Ideris A., Bejo M. H., Omar A. R. Characterisation of genotype VII Newcastle disease virus (NDV) isolated from NDV vaccinated chickens, and the efficacy of LaSota and recombinant genotype VII vaccines against challenge with velogenic NDV. Journal of Veterinary Science. 2015; 16 (4): 447–457. https://doi.org/10.4142/jvs.2015.16.4.447
34. Sabouri F., Vasfi Marandi M., Bashashati M. Characterization of a novel VIIL sub-genotype of Newcastle disease virus circulating in Iran. Avian Pathology. 2017; 47 (1): 90–99. https://doi.org/10.1080/03079457.2017.1376735
35. Hu Z., He X., Deng J., Hu J., Liu X. Current situation and future direction of Newcastle disease vaccines. Veterinary Research. 2022; 53:99. https://doi.org/10.1186/s13567–022–01118-w
36. Вершинина М. А., Мороз Н. В., Фролов С. В. Определение индекса интрацеребральной патогенности полевого изолята вируса болезни Ньюкасла VII генотипа. Материалы Международной научной конференции молодых ученых и специалистов, посвященной 150-летию со дня рождения А. Я. Миловича: сборник статей (Москва, 3–5 июня 2024 г.). М.: РГАУ – МСХА имени К. А. Тимирязева; 2024; Том 2: 247–250. https://elibrary.ru/njalpm
37. Terregino C., Capua I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. In: Avian Influenza and Newcastle Disease. Ed. by I. Capua, D. J. Alexander. Milan: Springer; 2009; Chapter 9: 113–122. https://link.springer.com/chapter/10.1007/978-88-470-0826-7_9
38. Смердова М. Д. Патологическая анатомия, секционный курс, судебно-ветеринарная экспертиза: электронный учебно- методический комплекс. Красноярск: ФГБОУ ВПО «Красноярский государственный аграрный университет»; 2010. 731 c. http://www.kgau.ru/distance/vet_03/patanatomia/index.html
Об авторах
М. А. ВершининаРоссия
Вершинина Мария Андреевна, аспирант, специалист лаборатории профилактики болезней птиц,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Н. В. Мороз
Россия
Мороз Наталья Владимировна, канд. вет. наук, заведующий лабораторией профилактики болезней птиц,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
С. В. Фролов
Россия
Фролов Сергей Владимирович, канд. вет. наук, начальник отдела профилактики болезней птиц,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Д. Л. Долгов
Россия
Долгов Дмитрий Львович, канд. вет. наук, заведующий сектором лаборатории профилактики болезней птиц,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Е. В. Курненкова
Россия
Курненкова Елена Викторовна, канд. вет. наук, ведущий научный сотрудник лаборатории профилактики болезней птиц,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Л. О. Щербакова
Россия
Щербакова Лидия Олеговна, канд. биол. наук, ведущий научный сотрудник референтной лаборатории вирусных болезней птиц,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Рецензия
Для цитирования:
Вершинина М.А., Мороз Н.В., Фролов С.В., Долгов Д.Л., Курненкова Е.В., Щербакова Л.О. Изучение инфекционного процесса у кур при различных способах заражения вирусом ньюкаслской болезни генотипа VII. Ветеринария сегодня. 2025;14(4):401-409. https://doi.org/10.29326/2304196X-2025-14-4-401-409
For citation:
Vershinina M.A., Moroz N.V., Frolov S.V., Dolgov D.L., Kurnenkova E.V., Scherbakova L.O. Investigating the infectious process in chickens infected with Newcastle disease virus genotype VII via different routes. Veterinary Science Today. 2025;14(4):401-409. (In Russ.) https://doi.org/10.29326/2304196X-2025-14-4-401-409
JATS XML



































