Перейти к:
Рекомбинантные антигены в серологической диагностике трансграничных и эмерджентных инфекций рогатого скота
https://doi.org/10.29326/2304-196X-2025-14-4-372-382
Аннотация
Введение. Трансграничные и эмерджентные инфекции крупного и мелкого рогатого скота, такие как чума мелких жвачных животных, болезнь Шмалленберга и другие, в условиях развивающейся глобализации представляют серьезную эпизоотическую и экономическую угрозу. С учетом текущей геополитической обстановки необходимость в современных диагностических системах отечественного производства ощущается особенно остро. Подобные системы могут быть разработаны с использованием методов генной инженерии.
Цель исследования. Анализ отечественных и зарубежных публикаций, посвященных получению рекомбинантных белков возбудителей трансграничных и эмерджентных инфекций крупного и мелкого рогатого скота. Создание на основе обработанных данных генетических конструкций для дальнейшей разработки на их основе диагностических средств, в частности иммуноферментных тест-систем.
Материалы и методы. При помощи инструментов биоинформатики проведен анализ и оптимизация кодонного состава последовательностей, кодирующих нуклеокапсидные белки вирусов чумы мелких жвачных животных и болезни Шмалленберга. Оптимизированные фрагменты генов были синтезированы de novo и клонированы в экспрессирующий вектор pET-32b(+). Успешность вставки целевой последовательности в вектор подтверждали методом полимеразной цепной реакции и рестрикционного анализа.
Результаты. Представлена информация о разработанных на основе рекомбинантных антигенов иммуноферментных тест-системах для диагностики чумы мелких жвачных животных и болезни Шмалленберга. Освещены основные технологические аспекты получения рекомбинантных антигенов для дальнейшего их использования в диагностической системе с учетом особенностей биологии конкретного инфекционного агента, а также описана собственная методология создания векторов для экспрессии белков возбудителей обозреваемых болезней.
Заключение. Наиболее перспективными для использования в качестве рекомбинантных антигенов в иммуноферментных тест-системах, направленных на выявление антител к вирусам чумы мелких жвачных животных и болезни Шмалленберга, являются полные и усеченные нуклеокапсидные белки вирионов. При этом биофизические свойства и антигенная структура данных белков позволяют получать их в культуре клеток Escherichia coli. Следует отметить, что для получения значительных количеств функциональных белков в растворимой форме может понадобиться их экспрессия в составе слитых белков с повышающими растворимость и облегчающими корректный фолдинг тегами.
Ключевые слова
Для цитирования:
Тенитилов Н.А., Ярыгина Н.А., Спрыгин А.В. Рекомбинантные антигены в серологической диагностике трансграничных и эмерджентных инфекций рогатого скота. Ветеринария сегодня. 2025;14(4):372-382. https://doi.org/10.29326/2304-196X-2025-14-4-372-382
For citation:
Tenitilov N.A., Yarygina N.A., Sprygin A.V. Recombinant antigens in serological diagnostics of transboundary and emerging bovine infections. Veterinary Science Today. 2025;14(4):372-382. (In Russ.) https://doi.org/10.29326/2304-196X-2025-14-4-372-382
ВВЕДЕНИЕ
На сегодняшний день трансграничные и эмерджентные инфекции крупного и мелкого рогатого скота представляют серьезную угрозу. В первую очередь это связано со значительным влиянием на экономику и международную торговлю.
Такие инфекционные болезни рогатого скота, как чума мелких жвачных животных и болезнь Шмалленберга, отличаются высокой контагиозностью и в условиях развития процессов глобализации и формирования устойчивых международных отношений могут легко распространяться за пределы энзоотичных и неблагополучных регионов. Вспышки данных инфекций сопровождаются значительными экономическими потерями, которые связаны с мероприятиями по ликвидации и предотвращению распространения эпизоотии, со снижением продуктивности животных и с ограничениями на экспорт животных и продукции животного происхождения. При этом необходимость в надежных диагностических средствах становится особенно актуальной.
Текущий уровень развития молекулярной биологии и биотехнологии, в частности технология рекомбинантных ДНК, позволяет создавать высокочувствительные, специфичные и безопасные диагностические средства.
Наиболее ценным инструментом серологической диагностики вирусных болезней животных является иммуноферментный анализ (ИФА). При этом возможность производить рекомбинантные белки гарантирует, что тест-системы ИФА будут безопасными ввиду отсутствия необходимости использования инфекционных агентов на этапах их производства. Кроме того, они будут обладать гораздо большей чувствительностью и специфичностью благодаря более эффективному методу очистки. Возможность синтезировать рекомбинантные белки в лаборатории позволяет легко масштабировать производство антигенов, позволяя подстраивать производство под существующие запросы.
Необходимо отметить, что тест-системы ИФА для диагностики инфекционных болезней животных на основе рекомбинантных белков успешно разрабатываются за рубежом такими компаниями, как IDvet (Франция), IDEXX Laboratories (США), Ingenasa (входит в состав холдинга Eurofins Scientific, Люксембург). Высокая чувствительность и специфичность являются решающими факторами, способствующими применению данных средств диагностики в том числе в отечественных диагностических лабораториях.
Чума мелких жвачных животных (ЧМЖ) – остро или подостро протекающая вирусная болезнь овец и коз, сопровождающаяся лихорадкой, конъюнктивитом, ринитом, некротическим стоматитом, гастроэнтеритом, пневмонией и гибелью зараженных животных [1][2]. Первые упоминания о данной болезни относятся к началу прошлого века. С 1917 по 1929 г. среди овец и коз в Сенегале, Гвинее и Нигерии были зарегистрированы вспышки болезни, по клиническим признакам похожей на чуму крупного рогатого скота. В период с 1940 по 1942 г. L. Gargadennec and А. Lalanne была описана болезнь, поражающая мелких жвачных животных в Западной Африке [3]. Ими было выявлено заболевание, схожее по клиническим признакам с чумой крупного рогатого скота, но поражающее только овец и коз. Позднее, в 1968 г., чума мелких жвачных животных была установлена как самостоятельная нозологическая единица [4].
Возбудителем болезни является оболочечный РНК-содержащий полиморфный вирус, принадлежащий к роду Morbillivirus семейства Paramyxoviridae. Он родственен вирусам чумы крупного рогатого скота, чумы плотоядных, чумы морских млекопитающих и кори человека [1][2] Размер вириона может варьироваться от 150 до 700 нм. В его состав входит молекула РНК, которая вместе с фосфопротеином и L-белком покрыта нуклеокапсидной оболочкой, помещенной внутрь суперкапсида.
Геном вируса ЧМЖ представлен одноцепочечной несегментированной линейной молекулой РНК с отрицательной полярностью. Размер генома составляет около 16 000 нуклеотидов и кодирует 6 структурных белков, таких как нуклеокапсидный белок (N), фосфопротеин (P), полимеразный белок (L), гемагглютинин (H), белок слияния (F) и мембранный белок (M). Кроме того, из транскрипта, кодирующего фосфопротеин, при использовании альтернативной рамки считывания транслируются 2 неструктурных белка: С и V [1].
На сегодняшний день ЧМЖ энзоотична на большей части территории Африки, Ближнего Востока, Южной Азии и Китая. Ввиду высокой заболеваемости и летальности в первичных очагах инфекции, вплоть до 100%, данная болезнь имеет важное экономическое значение для энзоотичных регионов [2]. Следует отметить, что в последние годы вспышки ЧМЖ регистрируют на территории стран, с которыми у Российской Федерации существуют торгово-экономические отношения. Это свидетельствует о наличии угрозы заноса вируса ЧМЖ в Россию из неблагополучных по данной инфекции стран [5].
Основным источником возбудителя данной инфекции являются больные и/или переболевшие животные. Наиболее распространенные пути передачи: контактный и аэрогенный. К вирусу ЧМЖ чувствительны козы, овцы и мелкие дикие жвачные животные. Кроме того, есть сообщения о выявлении возбудителя ЧМЖ у крупного рогатого скота, верблюдов, свиней и буйволов. Следует отметить, что подобные хозяева нетипичны для данного вируса, и в случае заражения дальнейшего заболевания и распространения возбудителя не происходит [2][6].
После проникновения вируса в организм восприимчивого животного через ротовую полость или носоглотку вирионы захватываются клетками моноцитарно-макрофагальной системы и транспортируются в регионарные лимфатические узлы и скопления лимфоидной ткани, где происходит первичная и вторичная репликация возбудителя. Далее происходит диссеминация вируса в отдаленные от очагов первичной репликации органы и ткани. Необходимо отметить, что вирус ЧМЖ обладает ярко выраженным тропизмом к лимфоидным тканям. Его распространение по организму вызывает глубокую иммуносупрессию из-за разрушения значительной части лейкоцитов. Кроме того, наблюдаются некротические поражения селезенки, тимуса, легочных лимфатических узлов [1].
Инкубационный период при ЧМЖ составляет от 2 до 7 дней. Виремия развивается за 1–2 дня до наступления клинических признаков, при этом начинается активное выделение вируса в окружающую среду, что способствует распространению инфекции [2]. Клинические признаки ЧМЖ включают в себя пирексию, эрозивный стоматит, истечения из глаз и носа, а также диарею. Смерть обычно наступает в течение 4–6 дней после начала лихорадки. Следует отметить, что форма заболевания и его тяжесть может варьироваться в зависимости от индивидуальных особенностей животных, таких как вид, возраст, порода и направление продуктивности [7].
После проникновения в организм восприимчивого животного вируса ЧМЖ, несмотря на значительную иммуносупрессию, наблюдается сильный вирусспецифический иммунный ответ. Основные защитные реакции клеточного и гуморального иммунитета направлены против H-, F- и N-белков вириона. Наблюдается активация цитотоксических Т-клеток, которые уничтожают пораженные вирусом клетки организма. Кроме того, происходит выработка большого количества вируснейтрализующих антител, в основном против белков гликопротеидной оболочки вириона – H- и F-белков. В случае выздоровления животное приобретает устойчивый пожизненный иммунитет к повторному заражению.
Успешный контроль за распространением болезни, в частности предотвращение заноса в ранее благополучные по ЧМЖ регионы, включает в себя использование ряда диагностических средств, направленных в первую очередь на выявление специфических антител.
Для серологической диагностики ЧМЖ разработано несколько методов, таких как реакция нейтрализации, реакция диффузной преципитации, реакция непрямой иммунофлуоресценции, прямой и непрямой ИФА, а также конкурентный ИФА [8]. Важно отметить, что реакция нейтрализации, считающаяся наиболее точным методом, несмотря на все преимущества, имеет существенные недостатки – трудоемкость и длительность постановки. В связи с этим чаще всего для рутинных исследований применяют ИФА [7].
В первых системах для выявления специфичных к возбудителю ЧМЖ антител методом ИФА использовался инактивированный и очищенный вирус. Следует отметить, что подобный подход отличался низкой специфичностью из-за присутствия балластных белков культуры клеток. Использование технологии рекомбинантных белков позволило решить данную проблему. Кроме того, значительно возросла безопасность производства. По этой причине на сегодняшний день большая часть серодиагностики ЧМЖ разработана на основе рекомбинантных белков [9].
В качестве антигена для иммуноферментных тест-систем для выявления антител к вирусу ЧМЖ используется рекомбинантный N-белок, что связано с высокой консервативностью гена, кодирующего данный белок. Этот протеин участвует в образовании нуклеокапсида вириона, потому экспрессируется пораженными клетками в большом количестве [10]. Кроме того, N-белок имеет различные эпитопы, что позволяет использовать его для выявления антител к вирусам ЧМЖ разных генетических линий [11], так как все генетические линии не имеют серологических различий.
Одна из первых работ, посвященная получению рекомбинантного нуклеокапсидного белка вируса ЧМЖ, была опубликована в 1995 г. G. Libeau et al. [12]. Для получения белка ими была использована экспрессирующая система клеток насекомых Spodoptera frugiperda (Sf9). Кодирующая белок последовательность была получена из штамма Nigeria 75/1 вируса ЧМЖ. В качестве вектора для переноса выступал рекомбинантный бакуловирус Autographa californica, полученный при рекомбинации с вектором переноса pAcYM1 с встроенным целевым геном под контролем бакуло- вирусного промотора.
Конкурентный ИФА, разработанный на основе рекомбинантного белка и моноклональных антител к нему, обладал высокой чувствительностью и специфичностью. Кроме того, показана хорошая корреляция результатов (r = 0,94) при сравнении данного метода с реакцией нейтрализации [12].
В 2005 г. K.-S. Choi et al. [13] на основе рекомбинантного N-белка разработали вариант конкурентного ИФА, отличающийся малым временем проведения анализа – менее одного часа. Рекомбинантный антиген для данной системы также был получен в системе клеток насекомых Sf9. Кроме того, выделение антигена включало в себя дополнительную очистку методами аффинной хроматографии.
В 2006 г. сотрудниками ФГБУ «ВНИИЗЖ» Н. В. Вавиловой и А. В. Щербаковым был разработан непрямой вариант ИФА для диагностики ЧМЖ. В отличие от ранее приведенных работ, рекомбинантный антиген для данного диагностического метода получен на культуре Escherichia coli. Кодирующая последовательность N-белка была амплифицирована с РНК нативного вируса, имеющегося в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ», при помощи полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) и встроена в плазмидный вектор pQE под контролем T5 промотора. Очистку белка проводили методом металл-хелатной аффинной хроматографии. Разработанная тест-система соответствовала необходимым показателям чувствительности, специфичности и воспроизводимости. С ее помощью было исследовано более 200 образцов сывороток крови мелкого рогатого скота из различных регионов Российской Федерации [8].
Кроме полноразмерного N-белка на пригодность использования в качестве антигенов в различных вариантах ИФА также тестировались и его усеченные формы. В 2006 г. V. Yadav et al., амплифицировав методом ОТ-ПЦР полную и укороченные кодирующие последовательности N-белка, клонировали их в вектор pET33b под контролем T7 промотора. С помощью данных генетических конструкций были трансформированы культуры E. coli штамма BL21 и получены рекомбинантные N-белки вируса ЧМЖ, которые при использовании в диагностических целях показали успешные результаты [10].
Существенно отличающийся от традиционных методик способ получения рекомбинантных белков показали в опубликованной в 2011 г. работе G.-R. Zhang et al. Кодирующая N-белок вируса ЧМЖ нуклеотидная последовательность была получена из базы данных GenBank (FJ905304), а ее сборка проводилась при помощи набора из 20 пар праймеров в результате нескольких перекрывающихся ПЦР. Кроме того, после завершения синтеза целевой последовательности методом сайт-направленного мутагенеза была произведена замена нескольких азотистых оснований в цепи. После верификации собранной генетической конструкции она была введена в культуру E. coli штамма BL21 для наработки рекомбинантного белка. Чувствительность и специфичность непрямого варианта ИФА на основе полученного антигена по результатам исследования 697 образцов сыворотки крови составила 96,7 и 96,1% соответственно [11].
В 2019 г. Д. Ю. Морозовой и соавт. была опубликована работа, посвященная получению рекомбинантного N-белка вируса ЧМЖ. Следует отметить, что полученная рекомбинантная плазмида, помимо кодирующей последовательности, полученной путем амплификации фрагмента генома нативного вируса, содержала ген тиоредоксина. Это позволило увеличить количество синтезируемого бактериями белка в растворимой форме [9]. Позднее на основе полученного белка была разработана методика ИФА, которая показала успешные результаты [8].
Таким образом, наиболее перспективным антигеном для рутинной диагностики является широко используемый в зарубежной и отечественной практике частичный или полноразмерный нуклеопротеид N, получаемый с помощью различных генно-инженерных систем.
Болезнь Шмалленберга – эмерджентная вирусная трансмиссивная болезнь жвачных животных, сопровождающаяся угнетением, диареей, снижением молочной продуктивности, а также абортами, мертворождением и врожденными пороками развития молодняка [14, 15].
В 2011 г. на территории Германии и соседних Нидерландов среди поголовья крупного рогатого скота были зарегистрированы вспышки инфекции неустановленной этиологии. Заболевание сопровождалось легким течением [16].
В стадах, где регистрировалась новая болезнь, в течение последующих месяцев наблюдалось увеличение числа телят с врожденными патологиями. Отмечали тяжелые неврологические нарушения, а также патологии опорно-двигательного аппарата. Как правило, телята с подобными отклонениями были нежизнеспособны и умирали в течение нескольких дней или недель. Кроме этого, увеличилось количество абортов и мертворождений [16][17].
При помощи метагеномного исследования образцов крови от пораженных животных был выявлен новый вирус, получивший название в честь места, где были зарегистрированы первые случаи заболевания – вирус болезни Шмалленберга [18]. В дальнейшем при экспериментальном заражении телят кровью коров, показавших положительный результат при тестировании на наличие вируса методом ОТ-ПЦР, были воспроизведены клинические признаки болезни [17]. Таким образом было установлено, что причиной вспышек является новый, ранее не встречавшийся на территории Европы вирус.
Филогенетический анализ последовательностей вирусного генома позволил отнести вирус болезни Шмалленберга к семейству Bunyaviridae, роду Orthobunyavirus, серогруппе Симбу (Simbu serogroup), которая насчитывает более 170 вирусов, среди которых представлены возбудители, вызывающие заболевания как у людей (вирусы лихорадки Оропуша и энцефалита Ла Кросса), так и у жвачных животных (вирусы болезни Акабане, болезни Айно и лихорадки долины Кэш). Следует отметить, что большинство представителей серогруппы Симбу распространены в регионах Ближнего Востока, Африки и Океании [14][19].
Геном вируса представлен одноцепочечной РНК с отрицательной полярностью и включает в себя три сегмента: большой, средний и малый, – которые кодируют РНК-полимеразу, поверхностные гликопротеины и нуклеокапсидные белки соответственно [14][20].
Установлено, что к вирусу болезни Шмалленберга восприимчивы домашние и дикие парнокопытные животные. При этом восприимчивость не зависит от пола и возраста. Необходимо отметить, что среди домашних парнокопытных заражению наиболее подвержены овцы, в меньшей степени – крупный рогатый скот и козы. Кроме того, при помощи различных методов специфические к вирусу болезни Шмалленберга антитела были выявлены у домашних свиней, диких кабанов, собак и слонов [14][19][20].
Передача возбудителя возможна как горизонтально, так и вертикально. При первом варианте вирус попадает в организм восприимчивого животного при укусах кровососущих насекомых, в основном мокрецов рода Culicoides. Во втором случае патоген передается от инфицированной матери плоду [14][15][19]. При заражении вирусом болезни Шмалленберга инкубационный период может составлять от одного дня до 4–5 сут. Эффективность и скорость распространения инфекции зависит от природно-климатических особенностей региона и активности насекомых-переносчиков. За относительно короткий промежуток времени может быть инфицировано до 90% поголовья. Смертность при заболевании низкая и редко превышает 3–5%. При этом количество абортов и мертворождений может составлять до 60% от общего числа беременных животных [2][15][21].
Необходимо отметить, что после обнаружения заболевания в Германии вирус достаточно быстро распространился по территории Европы. Он был выявлен в образцах биоматериала, полученных от крупного рогатого скота, овец, коз, бизонов и косуль. Антитела к данному вирусу были обнаружены в сыворотке крови альпак, ланей, муфлонов, оленей и водяных буйволов [18].
Установлено, что вирус болезни Шмалленберга обладает ярко выраженным тропизмом к нервной ткани. При проникновении возбудителя в организм восприимчивого животного развивается виремия продолжительностью до нескольких дней. При этом параллельно формируется стойкий защитный иммунитет. Однако при заражении беременного животного, ранее не встречавшегося с возбудителем, вирус может преодолевать гематоплацентарный барьер и поражать плод. Необходимо отметить, что восприимчивость развивающихся эмбрионов и плодов зависит от срока гестации и стадии развития плаценты [22][23].
Для болезни характерно субклиническое или подострое течение с неярко выраженными клиническими признаками, среди которых отмечают лихорадку, диарею, снижение надоев у животных молочного направления продуктивности, с последующим восстановлением до среднего показателя по стаду в течение 2–3 недель. Повышается число мертворождений, а также частота рождения молодняка с патологиями развития, такими как артрогрипоз, брахигнатия, анкилоз, тортиколлис, гипоплазия головного и спинного мозга [20].
Для эффективного контроля за распространением новой вирусной инфекции и дальнейшего мониторинга эпизоотической ситуации был разработан ряд диагностических средств, среди которых несколько серологических тест-систем для ИФА на основе рекомбинантного нуклеокапсидного белка вируса.
В качестве мишени был выбран N-белок ввиду его наибольшей распространенности – данный антиген обнаруживается как в вирионах, так и в инфицированных клетках. Кроме того, рекомбинантные N-белки родственных вирусу болезни Шмалленберга хантавирусов (Hantaviridae), полученные в культуре E. coli, клетках насекомых или дрожжах, успешно используются для серологической диагностики хантавирусных инфекций человека [17].
В 2013 г. E. Bréard et al. опубликовали работу, посвященную разработке иммуноферментных тест-систем для выявления антител к вирусу болезни Шмалленберга на основе рекомбинантного N-белка. Основой для получения рекомбинантного нуклеокапсидного белка стала искусственно синтезированная нуклеотидная последовательность, полученная из базы данных GenBank (HE649914). Она была клонирована в экспрессирующий вектор под контролем T7 промотора. Результатом экспрессии такой генетической конструкции в культуре E. coli штамма BL21 DE3 pLysS стало получение рекомбинантного белка, содержащего, кроме аминокислотной последовательности нуклеокапсидного белка вируса болезни Шмалленберга, 6 гистидиновых остатков на N-конце. После экспрессии белок подвергся денатурации в присутствии мочевины и был очищен методом металл-хелатной аффинной хроматографии. Полученный таким образом антиген затем был использован в качестве антигена для исследования сывороток крови от зараженных и интактных животных. Следует отметить, что иммуноферментная тест-система на основе полученного рекомбинантного нуклеокапсидного белка показала высокие значения чувствительности и специфичности. Кроме того, эффективность выявления положительных образцов сравнили с реакцией нейтрализации, в результате сходимость результатов составила 98,9% [16].
В том же 2013 г. группа китайских исследователей во главе с Y. Zhang получила рекомбинантный N-белок вируса болезни Шмалленберга. Принципиальным отличием их работы являлось использование нативной нуклеотидной последовательности получаемого белка. Кроме того, для экспрессии рекомбинантного белка использовались два типа генетических конструкций на основе векторов pET-28a-c(+) и pMAL-c5X. Они кодировали белки, содержащие гексагистидиновые метки и мальтоза-связывающий белок соответственно. Следует отметить, что экспрессия рекомбинантного белка с мальтоза-связывающим белком повышает его растворимость. Это существенно облегчает последующее выделение и очистку белка. После экспрессии белки были очищены в нативных условиях и в дальнейшем использованы для создания моноклональных антител и в качестве антигена для ИФА [18].
Позднее, в 2014 г., J. Lazutka et al. [17] получили нуклеокапсидный белок вируса болезни Шмалленберга в культуре клеток дрожжей. В своей работе они, так же как и E. Bréard et al. [16], использовали искусственно синтезированную последовательность, кодирующую N-белок вируса. Ген был встроен в экспрессирующую плазмиду pFX7-SBV-6-HisN под контролем галактоза-индуцируемого промотора. Конструкция также содержала N-концевую гексагистидиновую метку для последующей очистки. Полученный белок был протестирован в качестве антигена в ИФА на сыворотках крови крупного рогатого скота. При этом чувствительность составила 95%.
Опубликованные данные позволяют сделать вывод о том, что болезнь Шмалленберга представляет собой эмерджентную вирусную инфекцию жвачных животных с высокой экономической значимостью ввиду ярко выраженного влияния на репродуктивные качества восприимчивого поголовья.
Для серологической диагностики болезни Шмалленберга целесообразно использовать рекомбинантный антиген, представленный нуклеокапсидным белком, при этом накопление рекомбинантного белка во время прокариотической экспрессии сопровождается образованием телец-включений, что и обуславливает использование денатурирующих условий очистки.
Целью работы было создание плазмидных векторов на основе плазмиды pET-32b(+) и кодон-оптимизированных последовательностей генов, кодирующих нуклеокапсидные белки вирусов ЧМЖ и болезни Шмалленберга, для их экспрессии в клетках E. coli.
МАТЕРИАЛЫ И МЕТОДЫ
Нуклеотидные последовательности генов, кодирующих нуклеокапсидные белки вирусов ЧМЖ и болезни Шмалленберга, были получены из базы данных GenBank – NC_006383.2 и NC_043582.1 соответственно. Оптимизация кодонного состава для экспрессии в E. coli выполнялась с использованием программы GenScript Rare Codon Analysis tool [24] с учетом CAI (codon adaptation index). Для исключения участков вторичной структуры мРНК и сайтов рестрикции применялась программа UGENE [25]. Синтез генов осуществлен компанией «ДНК-Cинтез» (Россия) с последующим клонированием в вектор pUC57.
Для клонирования использовали штамм E. coli XL1-Blue (ЗАО «Евроген», Россия), генотип: recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F’ proAB lacIq ZΔM15 Tn10 (Tetr)]. Клетки культивировали в среде LB (ООО «Компания Хеликон», Россия) в шейкере-инкубаторе при 37 °C и 180 об/мин. Для селекции рекомбинантных клонов в среду добавляли ампициллин до конечной концентрации в 100 мкг/мл.
Плазмидный вектор pET-32b(+) (Novagen, США) линеаризовали с помощью рестриктаз NcoI и HindIII (TransGen Biotech, Китай) при 37 °C в течение 1 ч. Синтезированные гены амплифицировали с применением высокоточной ДНК-полимеразы и праймеров, содержащих сайты рестрикции (табл.). Очистку фрагментов ДНК проводили с использованием набора для выделения ДНК из геля (ЗАО «Евроген», Россия). Лигирование осуществляли ферментом T4 ДНК-лигазой (ЗАО «Евроген», Россия) при молярном соотношении вектора к вставке 1/3 при 14 °C в течение 16 ч.
Компетентные клетки трансформировали методом теплового шока, после чего добавляли 1 мл среды LB и инкубировали 1 ч при 37 °C. Отбор проводили на чашках с агаризованной средой LB, содержащей 100 мкг/мл ампициллина.
Для первичного скрининга использовали ПЦР с бактериальных колоний. Для этого применяли праймеры, комплиментарные участкам, фланкирующим место вставки – T7 Promoter (TAA TAC GAC TCA CTA TAG GG) и T7 Terminal (GCT AGT TAT TGC TCA GCG G). Реакцию проводили с использованием Taq-полимеразы (Синтол, Россия). Для подтверждения клонирования выделяли плазмидную ДНК при помощи набора CleanUp S-Cap (ЗАО «Евроген», Россия) и проводили рестрикционный анализ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для экспрессии нуклеокапсидных белков вирусов ЧМЖ и болезни Шмалленберга на основе вектора pET-32b(+) были разработаны генетические конструкции. Последовательности генов, полученные из базы данных GenBank (NC_006383.2 и NC_043582.1), подверглись оптимизации кодонного состава. Схема разработанных векторов представлена на рисунке 1.
После синтеза целевых генов de novo они были амплифицированы при помощи высокоточной полимеразы и праймеров, содержащих сайты узнавания рестриктаз. Результаты амплификации отражены на рисунке 2.
Полученные ампликоны были очищены из агарозного геля и подготовлены для дальнейшей рестрикции вместе с вектором. Результаты рестрикции представлены на рисунке 3.
Полученные фрагменты ДНК после очистки и лигирования по липким концам при помощи Т4 ДНК-лигазы были использованы для химической трансформации компетентных клеток E. coli штамма XL-1 Blue. Наличие вставки в клонах трансформантов проверяли при помощи ПЦР с колоний с применением праймеров, фланкирующих область вставки. Результаты представлены на рисунке 4.
После наработки необходимого количества плазмидной ДНК, содержащей вставки целевых генов, был проведен рестрикционный анализ. Результаты отражены на рисунке 5.
Таким образом, были получены два рекомбинантных плазмидных вектора на основе плазмиды pET-32b(+). Они содержат кодон-оптимизированные последовательности, кодирующие нуклеокапсидные белки вирусов ЧМЖ и болезни Шмалленберга.
Необходимо отметить, что экспрессия кодон-оптимизированных генов в прокариотических системах, таких как E. coli, обладает рядом ключевых преимуществ, обусловленных особенностями трансляционного аппарата бактерий.
Во-первых, частота использования кодонов у прокариот существенно отличается от таковой у эукариот, что может приводить к дефициту соответствующих тРНК и, как следствие, к задержкам в трансляции, неправильному сворачиванию белка или его преждевременной терминации. Кодон-оптимизация позволяет адаптировать нуклеотидную последовательность гена под предпочтительные кодоны организма-хозяина, тем самым увеличивая скорость и эффективность трансляции [26].
Во-вторых, это способствует повышению выхода рекомбинантного белка за счет снижения вероятности образования вторичных структур мРНК, которые могут препятствовать движению рибосомы.
В-третьих, оптимизация кодонного состава минимизирует риск включения аминокислотных ошибок, которые могут возникать при использовании редких кодонов из-за ошибочного связывания с неканоническими тРНК. Кроме того, в случае экспрессии гетерологичных белков (например, человеческих) в E. coli кодон-оптимизация часто необходима для достижения физиологически значимых уровней продукции, поскольку исходные последовательности могут содержать множественные редкие для бактерий кодоны. Таким образом, применение кодон-оптимизированных генов в прокариотических системах экспрессии является важным инструментом для увеличения выхода, стабильности и функциональности рекомбинантных белков, что особенно актуально для биотехнологических и биофармацевтических применений [27].
Такие опасные болезни животных, как ЧМЖ и болезнь Шмалленберга, учитывая их текущее распространение, продолжают быть актуальными. Международное сотрудничество и торговля мелким и крупным рогатым скотом создают условия для переноса возбудителей данных болезней. В настоящее время в Российской Федерации идет активная программа импортозамещения в сфере медицины и ветеринарии, в частности в области разработки и производства диагностических тест-систем, что обусловлено отсутствием качественных отечественных аналогов. Отсюда вытекает проблема своевременной и качественной диагностики с использованием собственного технологического арсенала. Отечественными производителями разработано множество иммуноферментных тест-систем, основанных на применении нативных антигенов. Но такие системы достаточно часто могут демонстрировать неспецифичные результаты. Рекомбинантные белки, в свою очередь, перед нативными антигенами демонстрируют значительные преимущества, среди которых более высокая чистота препарата, воспроизводимость результатов и возможность получения больших объемов материала. К тому же иммуноферментные тест-системы на основе рекомбинантных белков являются более безопасными для персонала ввиду отсутствия необходимости наработки инфекционного материала в больших количествах для получения препарата вирусного антигена.
Необходимо отметить, что существует ряд ограничений для серологической диагностики ЧМЖ. Это связано с особенностями течения болезни. Зачастую гибель заболевших животных наступает раньше, чем успевают выработаться вирусспецифические антитела. Таким образом, наиболее подходящим для экстренного тестирования животных является прямой вариант ИФА. При этом непрямой вариант, в том числе и на основе рекомбинантных антигенов, позволяет отслеживать вакцинированных, переболевших и иммунных животных, например, при мониторинговых исследованиях.
Таблица
Характеристики использованных праймеров
Table
Specifications of the primers used
Инфекционная болезнь | Праймер | Последовательность 5´→3´ | Фермент |
Чума мелких жвачных | PPRV Hind 3620 | ATATAAGCTTCTGCGAGGCAATCTCGCTAAC | HindIII |
PPRV NcoI 3620 | AAAACCATGGCTACACTGTTAAAATCGCTC | NcoI | |
Болезнь Шмалленберга | SBV_HindIII_R | CTCTAAGCTTGTGTATATTTATCCCGAACTGTTGCAGGAATG | HindIII |
SBV_NcoI | ATATCCATGGATGAGCTCGCAGTTTATCTTCGAG | NcoI |
Полужирным шрифтом обозначены сайты узнавания рестриктаз (recognition sites for restriction enzymes are in bold).
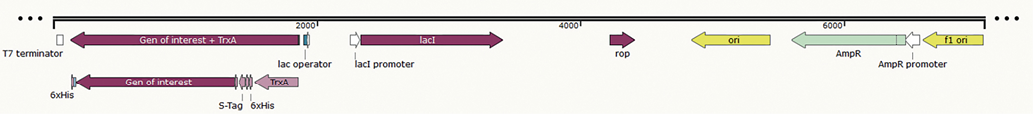
Рис. 1. Схема разработанного вектора на основе плазмиды pET-32b(+): Т7 terminator – терминатор транскрипции фага T7; 6×His – гистидиновый тег; Gen of interest – целевой ген, кодирующий нуклеокапсидный белок вируса ЧМЖ или вируса болезни Шмалленберга; S-Tag – фрагмент рибонуклеазы A; TrxA – тиоредоксиновый тег; Lac operator – оператор lac промотора; LacI promoter – промотор белка lacI; LacI – репрессорный белок; Rop – белок-регулятор репликации плазмиды; Ori – точка начала репликации плазмиды; AmpR – ген устойчивости к ампициллину; AmpR promoter – промотор для гена AmpR. Схема составлена при помощи программы SnapGene1
Fig. 1. Design of pET-32b(+) plasmid-based vector: Т7 terminator – T7 phage transcription terminator; 6×His – histidine tag; Gen of interest – target gene encoding PPRV or SBV nucleocapsid protein; S-Tag – ribonuclease A fragment; TrxA – thioredoxin tag; Lac operator – lac promotor operator; LacI promoter – promotor of lacI protein; LacI – repressor protein; Rop – plasmid replication regulator; Ori – plasmid origin of replication; AmpR – ampicillin resistance gene; AmpR promoter – AmpR gene promoter. The scheme was constructed using SnapGene software1
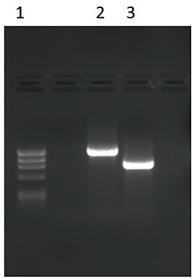
Рис. 2. Результаты амплификации целевых генов вирусов ЧМЖ и болезни Шмалленберга: 1 – маркер молекулярного веса ДНК (310, 603, 872, 1078, 1353 п. о.); 2 – ампликон целевого гена, кодирующего нуклеокапсидный белок вируса ЧМЖ, расчетный размер 1053 п. о.; 3 – ампликон целевого гена, кодирующего нуклеокапсидный белок вируса болезни Шмалленберга, расчетный размер 719 п. о.
Fig. 2. Target PPRV and SBV gene amplification results: 1 – DNA molecular weight marker (310, 603, 872, 1,078, 1,353 bp); 2 – amplicon of the target PPRV nucleocapsid protein-encoding gene, estimated size – 1,053 bp; 3 – amplicon of the target SBV nucleocapsid protein-encoding gene, estimated size – 719 bp
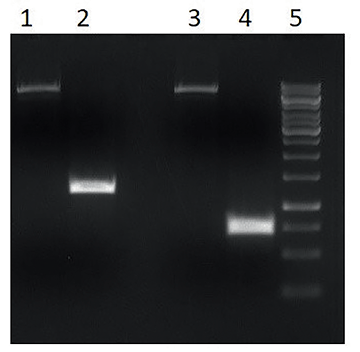
Рис. 3. Рестрикция ампликонов целевых генов и вектора pET-32b(+): 1, 3 – вектор pET-32b(+), обработанный рестриктазами NcoI и HindIII, расчетный размер 5861 п. о.; 2 – ампликон целевого гена, кодирующего нуклеокапсидный белок вируса ЧМЖ и обработанный рестриктазами NcoI и HindIII, расчетный размер 1045 п. о.; 4 – ампликон целевого гена, кодирующего нуклеокапсидный белок вируса болезни Шмалленберга и обработанный рестриктазами NcoI и HindIII, расчетный размер 710 п. о.; 5 – маркер молекулярного веса ДНК (250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 5000, 6000, 8000, 10 000 п. о.)
Fig. 3. Restriction digestion of target gene amplicons and pET-32b(+) vector: 1, 3 – pET-32b(+) vector, digested with NcoI and HindIII restriction enzymes, estimated size 5,861 bp; 2 – target gene amplicon encoding PPRV nucleocapsid proteins and digested with NcoI and HindIII restriction enzymes, estimated size 1,045 bp; 4 – target gene amplicon encoding SBV nucleocapsid protein and digested with NcoI and HindIII restriction enzymes, estimated size 710 bp; 5 – DNA molecular weight market (250, 500, 750, 1,000, 1,500, 2,000, 2,500, 3,000, 3,500, 4,000, 5,000, 6,000, 8,000, 10,000 bp)
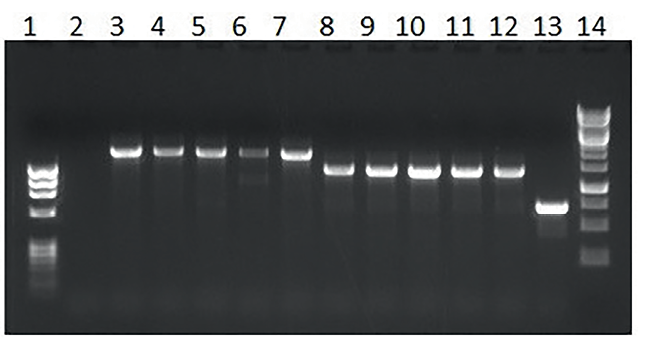
Рис. 4. Скрининг клонов на наличие плазмиды со вставкой целевого гена: 1 – маркер молекулярного веса ДНК (310, 603, 872, 1078, 1353 п. о.); 2 – отрицательный контроль ПЦР; 3–7 – клоны, содержащие плазмиду pET-32b(+) c геном, кодирующим нуклеокапсидный белок вируса ЧМЖ, расчетный размер 1876 п. о.; 8–12 – клоны, содержащие плазмиду pET-32b(+) c геном, кодирующим нуклеокапсидный белок вируса болезни Шмалленберга, расчетный размер 1653 п. о.; 13 – положительный контроль ПЦР (вектор pET-32b(+) без вставки); 14 – маркер молекулярного веса ДНК (250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 5000, 6000, 8000, 10 000 п. о.)
Fig. 4. Screening clones for target gene-containing plasmid inserts: 1 – DNA molecular weight marker (310, 603, 872, 1,078, 1,353 bp); 2 – negative PCR control; 3–7 – clones containing pET-32b(+) plasmid with PPRV nucleocapsid protein-encoding gene, estimated size 1,876 bp; 8–12 – clones containing pET-32b(+) plasmid with SBV nucleocapsid protein-encoding gene, estimated size 1,653 bp; 13 – positive PCR control (insertion-free pET-32b(+) vector); 14 – DNA molecular weight marker (250, 500, 750, 1,000, 1,500, 2,000, 2,500, 3,000, 3,500, 4,000, 5,000, 6,000, 8,000, 10,000 bp)
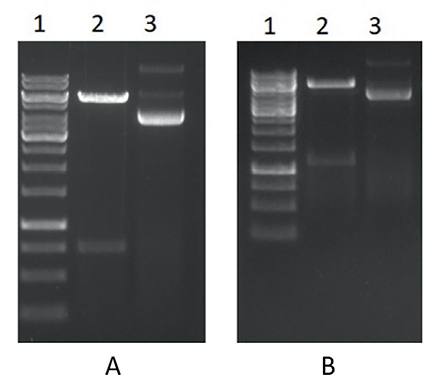
Рис. 5. Результаты рестрикционного анализа рекомбинантных плазмид, выделенных из клонов, положительных после скрининга. А: 1 – маркер молекулярного веса ДНК (250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 5000, 6000, 8000, 10 000 п. о.); 2 – плазмида,содержащая ген нуклеокапсидного белка вируса болезни Шмалленберга и обработанная рестриктазами NcoI и HindIII, расчетный размер 5861 и 785 п. о.; 3 – отрицательный контроль, плазмида, не обработанная рестриктазами; В: 1 – маркер молекулярного веса ДНК (250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 5000, 6000, 8000, 10 000 п. о.); 2 – плазмида, содержащая ген нуклеокапсидного белка вируса ЧМЖ и обработанная рестриктазами NcoI и HindIII, расчетный размер 5861 и 1202 п. о.; 3 – отрицательный контроль, плазмида, не обработанная рестриктазами
Fig. 5. Results of the restriction analysis of recombinant plasmids isolated from screening-positive clones. А: 1 – DNA molecular weight marker (250, 500, 750, 1,000, 1,500, 2,000, 2,500, 3,000, 3,500, 4,000, 5,000, 6,000, 8,000, 10,000 bp); 2 – plasmid containing SBV nucleocapsid protein gene and digested with NcoI and HindIII restriction enzymes, estimated size 5,861 and 785 bp; 3 – negative control, plasmid not digested with restrictases; В: 1 – DNA molecular weight marker (250, 500, 750, 1,000, 1,500, 2,000, 2,500, 3,000, 3,500, 4,000, 5,000, 6,000, 8,000, 10,000 bp); 2 – plasmid containing PPRV nucleocapsid protein gene and digested with NcoI and HindIII restriction enzymes, estimated size 5,861 and 1,202 bp; 3 – negative control, plasmid not digested with restriction enzymes
ЗАКЛЮЧЕНИЕ
Следует отметить, что технологии ИФА на основе рекомбинантных белков продолжают эволюционировать, позволяя повышать чувствительность и специфичность тестов, тем самым открывая новые возможности для лабораторной диагностики и фундаментальных исследований. Особое внимание следует уделить оптимизации условий экспрессии, очистки и конъюгации белков, что напрямую влияет на качество конечного диагностического продукта.
Важным преимуществом ИФА на основе рекомбинантных белков является то, что, если вирус по тем или иным причинам невозможно культивировать, при условии доступности генной последовательности можно быстро реагировать на появляющиеся новые вирусные штаммы существующих патогенов. Кроме того, полученные рекомбинантные антигены можно использовать для получения поли- и моноклональных антител и разработки соответствующих вакцин.
Дальнейшее совершенствование технологии создания рекомбинантных белков будет способствовать развитию ветеринарной медицины и повышению эффективности диагностики инфекционных болезней.
1 https://www.snapgene.com
Список литературы
1. Kumar N., Maherchandani S., Kashyap S. K., Singh S. V., Sharma S., Chaubey K. K., Ly H. Peste des petits ruminants virus infection of small ruminants: A comprehensive review. Viruses. 2014; 6 (6): 2287–2327. https://doi.org/10.3390/v6062287
2. Das A., Mahanta D., Choudhury F. A., Barua A., Talukdar M. J. Peste des petits ruminants: A comprehensive overview. The Pharma Innovation Journal. 2022; 11 (9S): 776–782. https://www.thepharmajournal.com/archives/2022/vol11issue9S/PartJ/S-11-8-235-850.pdf
3. Закутский Н. И., Балышев В. М., Книзе А. В., Гузалова А. Г., Юрков С. Г. Чума мелких жвачных животных (современное состояние, эпизоотология, специфическая профилактика и меры борьбы). Научный журнал КубГАУ. 2012; (83). http://ej.kubagro.ru/2012/09/pdf/31.pdf
4. Калантаенко Ю. Ф., Михалкин И. П., Балышев В. М., Коломыцев А. А., Горшкова Т. Ф., Сурков В. Б. Чума мелких жвачных – распространение, диагностика и профилактика. Ветеринарная патология. 2007; (2): 38–43. https://elibrary.ru/oezjed
5. Мищенко А. В., Мищенко В. А., Черных О. Ю., Шевкопляс В. Н., Кривонос Р. А., Лысенко А. А., Чернов А. Н. Эпизоотические особенности чумы мелких жвачных животных. Ветеринарный врач. 2018; (6): 40–47. https://elibrary.ru/yqvekl
6. Baron M. D., Diallo A., Lancelot R., Libeau G. Peste des petits ruminants virus. Advances in Virus Research. 2016; 95: 1–42. https://doi.org/10.1016/bs.aivir.2016.02.001
7. Середа А. Д., Морозова Д. Ю., Иматдинов А. Р., Лыска В. М., Живодеров С. П., Сливко И. А., Луницин А. В. Конструирование тест-систем на основе рекомбинантного нуклеокапсидного белка для серодиагностики чумы мелких жвачных. Сельскохозяйственная биология. 2019; 54 (6): 1225–1235. https://doi.org/10.15389/agrobiology.2019.6.1225rus
8. Вавилова Н. В., Щербаков А. В. Применение рекомбинантного нуклеокапсидного белка в непрямом варианте ИФА для выявления антител к вирусу чумы мелких жвачных. Ветеринарная патология. 2006; (4): 76–78. https://elibrary.ru/oedrer
9. Морозова Д. Ю., Иматдинов А. Р., Живодеров С. П., Титов И. А., Лыска В. М., Луницин А. В., Середа А. Д. Получение рекомбинантного нуклеокапсидного белка вируса чумы мелких жвачных для применения в серодиагностике. Сельскохозяйственная биология. 2019; 54 (2): 337–346. https://doi.org/10.15389/agrobiology.2019.2.337rus
10. Yadav V., Balamurugan V., Bhanuprakash V., Sen A., Bhanot V., Venkatesan G., et al. Expression of peste des petits ruminants virus nucleocapsid protein in prokaryotic system and its potential use as a diagnostic antigen or immunogen. Journal of Virological Methods. 2009; 162 (1–2): 56–63. https://doi.org/10.1016/j.jviromet.2009.07.014
11. Zhang G.-R., Zeng J.-Y., Zhu Y.-M., Dong S.-J., Zhu S., Yu R.-S., et al. Development of an indirect ELISA with artificially synthesized N protein of PPR virus. Intervirology. 2012; 55 (1): 12–20. https://doi.org/10.1159/000322220
12. Libeau G., Préhaud C., Lancelot R., Colas F., Guerre L., Bishop D. H. L., Diallo A. Development of a competitive ELISA for detecting antibodies to the peste des petits ruminants virus using a recombinant nucleoprotein. Research in Veterinary Science. 1995; 58 (1): 50–55. https://doi.org/10.1016/00345288(95)90088-8
13. Choi K.-S., Nah J.-J, Ko Y.-J., Kang S.-Y., Jo N.-I. Rapid competitive enzyme-linked immunosorbent assay for detection of antibodies to peste des petits ruminants virus. Clinical and Diagnostic Laboratory Immunology. 2005; 12 (4): 542–547. https://doi.org/10.1128/CDLI.12.4.542-547.2005
14. Бурова О. А., Захарова О. И., Торопова Н. Н., Лискова Е. А., Яшин И. В., Блохин А. А. Болезнь Шмалленберг: обзор литературы и эпизоотическая ситуация в мире и России. Аграрная наука Евро- Северо- Востока. 2022; 23 (1): 7–15. https://doi.org/10.30766/2072-9081.2022.23.1.7-15
15. Макаров В. В., Гулюкин М. И., Львов Д. К. Зоопатогенные ортобуньявирусы (Orthobunyavirus, Bunyaviridae). Вопросы вирусологии. 2016; 61 (2): 53–58. https://doi.org/10.18821/0507-4088-2016-61-2-53-58
16. Bréard E., Lara E., Comtet L., Viarouge C., Doceul V., Desprat A., et al. Validation of a commercially available indirect ELISA using a nucleocapside recombinant protein for detection of Schmallenberg virus antibodies. PLoS ONE. 2013; 8 (1): e53446. https://doi.org/10.1371/journal.pone.0053446
17. Lazutka J., Zvirbliene A., Dalgediene I., Petraityte-Burneikiene R., Spakova A., Sereika V., et al. Generation of recombinant Schmallenberg virus nucleocapsid protein in yeast and development of virus- specific monoclonal antibodies. Journal of Immunology Research. 2014; 2014:160316. https://doi.org/10.1155/2014/160316
18. Zhang Y., Wu S., Wang J., Wernike K., Lv J., Feng C., et al. Expression and purification of the nucleocapsid protein of Schmallenberg virus, and preparation and characterization of a monoclonal antibody against this protein. Protein Expression and Purification. 2013; 92 (1): 1–8. https://doi.org/10.1016/j.pep.2013.08.012
19. Кухаркина О. В., Борисова О. А. Болезнь Шмалленберга (обзор). Труды Федерального центра охраны здоровья животных. 2014; 12: 86–102. https://elibrary.ru/sysyff
20. Спрыгин А. В., Кононов А. В., Бабин Ю. Ю., Мищенко В. А. Болезнь Шмалленберга: молекулярно- биологические особенности и клиническая картина (обзор). Сельскохозяйственная биология. 2012; (6): 24–34. https://doi.org/10.15389/agrobiology.2012.6.24rus
21. Луницин А. В., Сальников Н. И., Никитина Е. Г., Цыбанов С. Ж., Колбасов Д. В. Болезнь Шмалленберг – новое заболевание жвачных в Европе. Ветеринария. 2012; (4): 23–26. https://elibrary.ru/ownuxr
22. Varela M., Schnettler E., Caporale M., Murgia C., Barry G., McFarlane M., et al. Schmallenberg virus pathogenesis, tropism and interaction with the innate immune system of the host. PLoS Pathogens. 2013; 9 (1): e1003133. https://doi.org/10.1371/journal.ppat.1003133
23. Collins Á. B., Doherty M. L., Barrett D. J., Mee J. F. Schmallenberg virus: a systematic international literature review (2011–2019) from an Irish perspective. Irish Veterinary Journal. 2019; 72:9. https://doi.org/10.1186/s13620-019-0147-3
24. Fan K., Li Y., Chen Z., Fan L. GenRCA: a user-friendly rare codon analysis tool for comprehensive evaluation of codon usage preferences based on coding sequences in genomes. BMC Bioinformatics. 2024; 25 (1):309. https://doi.org/10.1186/s12859-024-05934-z
25. Okonechnikov K., Golosova O., Fursov M, the UGENE team. Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics. 2012; 28 (8): 1166–1167. https://doi.org/10.1093/bioinformatics/bts091
26. Elena C., Ravasi P., Castelli M. E., Peirú S., Menzella H. G. Expression of codon optimized genes in microbial systems: current industrial applications and perspectives. Frontiers in Microbiology. 2014; 5:21. https://doi.org/10.3389/fmicb.2014.00021
27. Menzella H. G. Comparison of two codon optimization strategies to enhance recombinant protein production in Escherichia coli. Microbial Cell Factories. 2011; 10:15. https://doi.org/10.1186/1475-2859-10-15
Об авторах
Н. А. ТенитиловРоссия
Тенитилов Никита Алексеевич, аспирант, ветеринарный врач лаборатории молекулярных и генетических исследований,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Н. А. Ярыгина
Россия
Ярыгина Наталья Анатольевна, аспирант, ветеринарный врач лаборатории молекулярных и генетических исследований,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
А. В. Спрыгин
Россия
Спрыгин Александр Владимирович, доктор биологических наук, заведующий лабораторией молекулярных и генетических исследований,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Рецензия
Для цитирования:
Тенитилов Н.А., Ярыгина Н.А., Спрыгин А.В. Рекомбинантные антигены в серологической диагностике трансграничных и эмерджентных инфекций рогатого скота. Ветеринария сегодня. 2025;14(4):372-382. https://doi.org/10.29326/2304-196X-2025-14-4-372-382
For citation:
Tenitilov N.A., Yarygina N.A., Sprygin A.V. Recombinant antigens in serological diagnostics of transboundary and emerging bovine infections. Veterinary Science Today. 2025;14(4):372-382. (In Russ.) https://doi.org/10.29326/2304-196X-2025-14-4-372-382
JATS XML



































