Перейти к:
Хламидиоз кошек (обзор)
https://doi.org/10.29326/2304-196X-2025-14-4-326-336
Аннотация
Введение. Хламидиоз кошек – болезнь, вызываемая Chlamydia felis, характеризуется конъюнктивитом (одно- или двухсторонним), слезотечением, поражением респираторного и репродуктивного трактов. Данный возбудитель относится к грамотрицательным бактериям со строго облигатным внутриклеточным паразитизмом, однако в начале 40-х гг. ХХ века хламидии считали промежуточным звеном между вирусами и бактериями. До 1960-х гг. из-за малых размеров и неспособности развиваться на искусственных питательных средах хламидии классифицировали как вирусы. Необычный цикл развития, состоящий из двух фаз, позволяет возбудителю долгое время персистировать в организме животного или человека без клинических проявлений. Лечение хламидиоза должно быть системным и затрагивать как этиологическую терапию (применение антибиотиков), так и симптоматическую. Иммунитет против хламидиоза слабый, клеточный иммунитет имеет большее значение, чем гуморальный. В настоящее время на рынке представлены аттенуированные и инактивированные вакцины, позволяющие защитить от клинического проявления болезни, но не от заражения. Распространен хламидиоз практически повсеместно, при этом заметна тенденция к росту выявляемости из года в год.
Цель исследования. Актуализация и систематизация данных по хламидиозу кошек, вызываемому Chlamydia felis.
Результаты. В статье обозреваются данные о распространенности хламидиоза кошек в мире. Рассмотрены биологические свойс тва описываемого инфекционного агента, клинические признаки хламидиоза кошек и патолого- анатомическая картина, приведены данные об иммунитете, освещаются меры контроля болезни.
Заключение. Chlamydia felis является распространенным патогеном, способным поражать не только кошек и других животных, но и человека, то есть имеющим зоонозный потенциал. Сложный цикл развития, наличие способности обходить иммунитет хозяина, продолжительная персистенция в организме усложняет его эрадикацию. Длительный курс лечения и переход в хроническую форму снижают качество жизни животных-к омпаньонов и создают угрозу передачи патогена человеку. Для разработки схем успешного лечения и профилактики хламидиоза требуется более детальное практическое изучение Chlamydia felis.
Для цитирования:
Цыганов И.С., Щербинин С.В., Галкина Т.С., Груздев К.Н. Хламидиоз кошек (обзор). Ветеринария сегодня. 2025;14(4):326-336. https://doi.org/10.29326/2304-196X-2025-14-4-326-336
For citation:
Tsyganov I.S., Shcherbinin S.V., Galkina T.S., Gruzdev K.N. Feline chlamydiosis (review). Veterinary Science Today. 2025;14(4):326-336. https://doi.org/10.29326/2304-196X-2025-14-4-326-336
ВВЕДЕНИЕ
Хламидиоз кошек – контагиозная болезнь кошачьих (Felidae) с симптомами поражения глаз и органов респираторного тракта, вызываемая бактерией рода Chlamydia. Данная болезнь может вызываться разными видами хламидий, такими как C. pneumoniae, С. psittaci, C. abortus, но основной является Chlamydia felis (ранее известная как Chlamydophila felis, до этого классифицированная как Chlamydia psittaci variant felis). Опираясь на историческую классификацию C. felis и C. psittaci как представителей одного и того же вида, можно предположить, что предыдущие обусловленные C. psittaci случаи регистрировались у домашних кошек, но не отличались от случаев, вызванных C. felis, из-за ограничений молекулярной диагностики того времени. Несмотря на то что C. psittaci и C. felis обладают разной избирательностью к хозяевам и вызывают разные симптомокомплексы болезни, эти патогены тесно связаны [1-5]. Эталонным штаммом C. felis является штамм FP Baker [6-11]. Хламидия данного вида также является патогеном, способным вызывать инфекционный процесс у человека [12-14]. Что касается видовой принадлежности, C. felis способна бессимптомно инфицировать собак, при этом манифестация конъюнктивита у последних – редкое явление, однако сероконверсия к данному патогену происходит [13]. Следовательно, видна потенциальная роль собак в зоонозной передаче хламидий, что делает C. felis важной нозоединицей, подлежащей диагностике и у собак. У людей C. felis способна вызывать симптомы кератоконъюнктивита, фолликулярного конъюнктивита, патологии дыхательных путей, гепатоспленомегалии, гломерулонефрита и эндокардита [15-20]. Также сообщалось, что C. felis была обнаружена в мазках с конъюнктивы у взрослой евразийской рыси с односторонним поражением глаз [21].
В начале 40-х гг. ХХ века хламидии считали промежуточным звеном между вирусами и бактериями. До 1960-х гг. из-за малых размеров и неспособности развиваться на искусственных питательных средах их классифицировали как вирусы. В начале ХХI века, после секвенирования генома, данный возбудитель был отнесен к бактериям [22][23]. Первые упоминания о заражении кошек хламидиями с симптомами поражения глаз и дыхательной системы были в 1971 г. [17].
Актуальность данной работы состоит в представлении биологии возбудителя C. felis, описании особенности болезни, вызванной данным патогеном, которая распространена практически повсеместно среди безнадзорных и домашних кошек (Felis catus). Этому способствует низкий уровень культуры содержания домашних животных, бесконтрольное их разведение, рост численности безнадзорных особей. Данная тема представляет большой интерес для изучения возможностей оздоровления домашних и племенных животных в век значительных экономических затрат на содержание и лечение животных-компаньонов, а также для снижения риска заболевания хламидиозом людей. Хламидийная инфекция охватывает все континенты, поэтому ее диагностика и профилактика играют важную роль.
Новизна статьи определяется анализом современной информации об эпизоотической ситуации по хламидиозу кошек, клинических признаках и патолого-анатомических изменениях, средствах диагностики и вакцинопрофилактики хламидиоза.
Целью данного обзора является актуализация и систематизация данных по хламидиозу кошек, вызываемому C. felis.
ЭПИЗООТИЧЕСКАЯ СИТУАЦИЯ
Информация об эпизоотической ситуации по хламидиозу кошек не отражает реального распространения данной болезни. Сведения о частоте случаев хламидиоза кошек, вызванного C. felis, из различных географических регионов получены на основании результатов молекулярных исследований. Так, в США за 2014 г. количество положительных на наличие C. felis кошек составило 24% [24]. В Китае за период с ноября 2022 по октябрь 2023 г. доля ПЦР-положительных проб от кошек была равна 15,75% [25]. В европейских странах за последние 20 лет лидерами по выявляемости C. felis были: Словакия (45,16%), Венгрия (33,3%), Польша (25%), Италия (20%), Швейцария (16%) и Швеция (15,3%) [9][13][26][27]. В России в период с 2018 по сентябрь 2019 г. доля положительных на C. felis результатов составила 11,2% [28]; отдельно по Москве за 2019 г. – 7,2% [29]. По некоторым данным, бактерии данного вида обнаруживались примерно у 26,3% бездомных кошек в Японии [26]. Полученные сведения, без учета выборки и темпов диагностических мероприятий, демонстрируют высокую заболеваемость кошек хламидиозом. Случаи, вызванные C. felis, характеризуются энзоотичностью, и эпизоотологические исследования, проведенные в разных странах, указывают на наличие данного патогена у 23% кошек, страдающих от конъюнктивита. Более высокие показатели заболеваемости наблюдаются у кошек, содержащихся в группах, приютах для животных [2].
БИОЛОГИЧЕСКИЕ СВОЙСТВА ВОЗБУДИТЕЛЯ
Chlamydia felis – грамотрицательная кокковидная бактерия со строго облигатно внутриклеточным паразитизмом, относится к семейству Chlamydiaceae, роду Chlamydia (рис.). Размер зависит от фазы цикла развития, который проходит в два этапа: неинфекционные ретикулярные тельца (диаметр от 0,5 до 1,6 мкм) и инфекционные элементарные тельца (диаметр от 0,2 до 0,6 мкм) [7][30].
Все изоляты хламидий, выделенные начиная с 1942 г. от кошек с симптомами поражения верхних дыхательных путей, первоначально были сгруппированы в вид C. psittaci. Позже, на основе последовательности 16S рРНК, представителей существовавшего на тот момент семейства Chlamydiaceae разделили на два рода: Chlamydia и Chlamydophila, а возбудитель хламидиоза кошачьих отнесли к роду Chlamydophila [8][22][30][31]. В 2009 г. после полногеномного секвенирования хламидий было принято решение о включении четырех семейств в порядок Chlamydiales и объединении всех патогенных хламидий в семейство Chlamydiaceae, в рамках которого выделен единственный род Chlamydia [11].
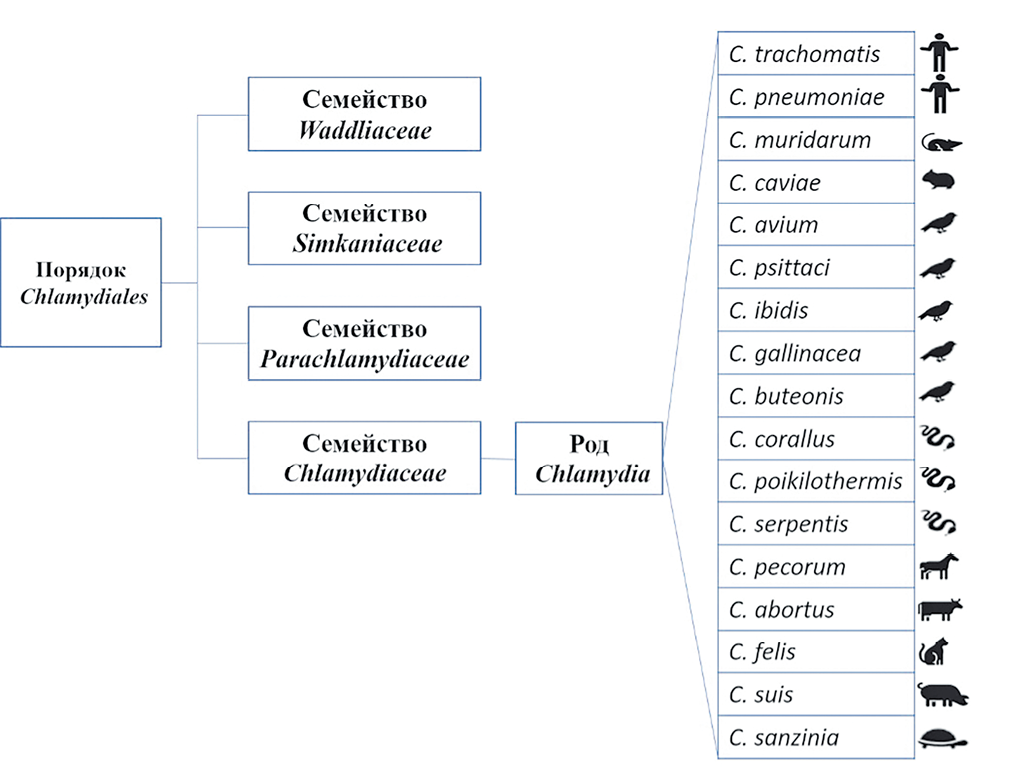
Рис. Классификация хламидий по данным анализа последовательности генов 16S и 23S рРНК на 2019 г. [32]. Иконками на рисунке изображены первичные хозяева штаммов хламидий, однако стоит учитывать тот факт, что представители рода Chlamydia являются полигостальными микроорганизмами
Fig. Phylogenetic classification of Chlamydia species according to 16S and 23S rRNA gene sequence analysis as of 2019 [32]. Icons indicate the primary host species for each strain, though all members of the Chlamydia genus are considered polyhostal
УСТОЙЧИВОСТЬ ВОЗБУДИТЕЛЯ К ФАКТОРАМ ОКРУЖАЮЩЕЙ СРЕДЫ И ДЕЗИНФЕКТАНТАМ
При нагревании хламидий до 55, 70 и 75 °C гибель наступает через 45, 2, и 1 мин соответственно. Низкие температуры обладают консервирующим эффектом. Дезинфицирующие средства, такие как растворы формальдегида, хлорамина, фенола и другие, в стандартных концентрациях эффективны против хламидий [28][32]. Низкие значения рН губительны, оптимальное значение рН среды 7,0–7,4. Хламидии сохраняются в течение 2–3 дней в водопроводной воде комнатной температуры, чувствительны к действию ультрафиолета [33].
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ВОЗБУДИТЕЛЯ
Возбудитель хламидиоза имеет одну кольцевую хромосому с размером генома чуть больше 1,166 млн пар нуклеотидов, содержание гуанин-цитозиновых пар составляет 39,1–39,4%. Также содержит криптическую (скрытую) плазмиду pCfe1 размером около 7,6 тыс. пар нуклеотидов с восемью генами [31][34].
Геном хламидий высококонсервативен, компактен, и эта особенность характерна и для C. felis [20][35]. В связи с внутриклеточным образом жизни у хламидий произошло сокращение генома, что является адаптацией, а не деградацией [22]. Оболочка хламидий состоит из трех слоев: внутренней билипидной мембраны, межмембранной структуры (периплазматическое пространство) и наружной липополисахаридной мембраны с включениями главного белка внешней мембраны (MOMP – major outer membrane protein) и полиморфных белков внешней мембраны (POMP – polymorphic outer membrane protein, pmp1, pmp7, pmp13 и другие), а также белков, богатых цистеином. В число POMP входят внешние мембранные белки OMP1 и OMP2. Эти белки участвуют в адгезии возбудителя на эпителиальных клетках хозяина [31][34][33][36]. Белки MOMP и ОМР2 содержат родо-, видо- и типоспецифические эпитопы, что обусловливает возможность появления перекрестных реакций. Белок МОМР (он же OmpA – outer membrane protein A) обнаруживается как у элементарных, так и у ретикулярных телец и выполняет функции как адгезина, так и порина [31][35][37]. Белки внешней мембраны являются высококонсервативными между изолятами [38].
В оболочке хламидий отсутствует пептидогликан, но присутствует полипептид, который совместно с ковалентно связанными с ним липопротеинами и липополисахаридами, а также белками внешней мембраны обеспечивает механическую прочность оболочки [26][31][39]. Экспериментальные данные показывают, что полиморфные мембранные белки (pmp) обладают множеством биологических и иммунных функций, включая уклонение от иммунного ответа хозяина, индукцию воспалительных и иммунных реакций, тканевой тропизм. Гены рmp демонстрируют высокий уровень внутри- и межвидовой гетерогенности в их аминокислотных последовательностях и размерах, но их можно идентифицировать по присутствию консервативных аминокислотных последовательностей GGA(I, L, V) и FххN, повторяющихся в N-концевой области и С-концевом транслокационном блоке / β-домене [40-42]. Количество генов pmp у разных видов хламидий варьируется от 9 до 21, у C. felis их обнаружено 12. Степень схожести между нуклеотидными последовательностями pmp высокая, несинонимичные однонуклеотидные полиморфизмы (SNPs) ограничены одним участком в каждом из генов pmp1, pmp9 и pmp20. Можно предположить, что гены pmp C. felis высококонсервативны между штаммами из разных географических регионов [9][37][41][42]. Вероятно, pmp1 и pmp7 представляют собой иммунодоминантные белки [42].
Гены криптической плазмиды были найдены у кошек с тяжелыми клиническими симптомами хламидийной инфекции. Криптическая плазмида часто связана с вирулентностью хламидий [18, 43]. Плазмиды содержат некодирующую РНК и восемь открытых рамок считывания (ORF1–8), функции пяти из них достаточно изучены. Анализ нуклеотидных последовательностей открытых рамок считывания показал, что белки, кодируемые ORF1 (pgp7) и ORF2 (pgp8), являются гомологами интегразы и рекомбиназы соответственно и отвечают за регуляцию репликации плазмиды, а ORF3 (pgp1) является аналогом хеликазы DnaB и участвует в разматывании двойных нитей ДНК при их репликации. ORF4 кодирует белок pgp2, его функция пока не определена. Одной из основных рамок является ORF5, кодирующая белок pgp3, который может быть маркером хламидийных инфекций. ORF6 кодирует белок pgp4, содержащий 101–102 аминокислоты, а ORF7 и ORF8 – белки pgp5 и pgp6 соответственно, которые могут участвовать в репликации плазмид. Плазмиды кодируют различные белки, участвующие в репликации самой плазмиды, но не установлено, влияют ли они на коммуникацию с клеткой хозяина; было лишь продемонстрировано, что белок pgp3 продуцируется в цитозоль клеток, инфицированных хламидиями. Роль плазмид еще не до конца изучена, хотя было показано, что наиболее важными для плазмид являются гены pgp1 (ORF3), pgp2 (ORF4), pgp6 (ORF8) и pgp8 (ORF2), а менее важными – pgp3 (ORF5), pgp5 (ORF7) и pgp7 (ORF1) [43].
Хламидии имеют узконаправленный секреторный аппарат III типа (T3SS), который дает возможность этим бактериям вводить вирулентные факторы прямо в цитозоль клетки-мишени чувствительного организма, что приводит к нарушению механизмов адаптивного иммунного ответа (препятствие слиянию фагосомы с лизосомой клетки хозяина) [32][33]. Секретируемые эффекторы III типа включают в себя транслоцированный актин-восстанавливающий фосфопротеин (TARP), необходимый на начальном этапе инфекции, семейство белков мембраны включения (внутренние компартменты), необходимых для развития этого включения, и эффекторный хламидийный внешний белок N (CopN), участвующий в позднем нарушении активности секреции III типа. Среди других ключевых факторов – белки, играющие центральную роль в развитии хламидий и регуляции генов, например гистоноподобные белки HctA и HctB; белки, богатые цистеином (OmрA и OmрB); белки, ответственные за проницаемость внешней мембраны для питательных веществ (OmpA и PorB), а также глобальный фактор регуляции генов Euo [11].
При сравнении генома C. felis с другими представителями рода Chlamydia было установлено, что 795 генов у них являются общими, а 47 генов характерны только для C. felis. Также выявлено, что ортологичные гены демонстрируют сходную дивергентную картину, кроме 14 генов, которые накопили больше всего мутаций, отсюда следует, что эти гены C. felis могут участвовать в эволюционной адаптации [31]. Существует разно- образие штаммов C. felis, которые отличаются по своей вирулентности [5][8].
Хламидии отличаются особым циклом развития, который состоит из двух фаз: внеклеточная и внутриклеточная. При внеклеточной фазе возбудитель представлен элементарными тельцами (ЭТ), являющимися инфекционными. При внутриклеточной фазе патоген представляет из себя неинфекционные ретикулярные тельца (РТ) [8][26][32]. ЭТ, ответственные за заражение клеток-мишеней, защищены трехслойной оболочкой, что в совокупности с шаровидной формой придает устойчивость к физическим и химическим факторам во внеклеточной среде. РТ также сферические, но имеют сетчатую структуру, из-за чего обладают полиморфностью и тонкой оболочкой [14][17][32]. Кратко цикл репродукции состоит из последовательных этапов: 1) адсорбция на рецепторах клетки хозяина; 2) проникновение ЭТ в клетку посредством эндоцитоза и пребывание в фагосоме; 3) подавление слияния фагосом с лизосомами; 4) дифференцировка ЭТ в РТ; 5) размножение РТ путем бинарного деления; 6) дифференцировка РТ в ЭТ; 7) выход ЭТ из клетки с ее лизисом [44].
Цикл начинается с контакта восприимчивой клетки хозяина с патогеном, в ходе которого ЭТ адгезируют к сиаловой кислоте на мембране клеток, в последующем проникая внутрь цитоплазмы. Внутри клетки ЭТ образуют внутрицитоплазматические включения, которые локализуются вблизи ядра клетки хозяина, аппарата Гольджи и эндоплазматической сети. Из-за малого набора ферментов метаболическая активность ЭТ осуществляется за счет резервов клетки хозяина, получая необходимые метаболиты и аденозинтрифосфат (АТФ) для репликации. Внутри включений ЭТ переходят в РТ, которые проходят последовательные этапы внутриклеточной репликации при помощи бинарного деления. После репликации РТ дифференцируются в ЭТ, которые выходят из клетки хозяина путем лизиса или экструзии, что позволяет им распространяться по организму. Весь цикл занимает от 48 до 72 ч [8][17][30-33][45].
В настоящий момент выделяют еще одну стадию цикла развития хламидий, которая возникает в стрессовых условиях, таких как использование β-лактамных антибиотиков (пенициллинов, цефалоспоринов, карбапенемов), – стадию персистенции (латентная форма, или неинфекционные аберрантные тельца, АТ). Они не трансформируются в ЭТ и представляют собой внутриклеточную неразмножающуюся форму. АТ не имеют МОМР и секретируют в большом количестве стрессовые протеины (Chsp60 – chlamydial heat shock protein 60, белки теплового шока массой 60 кД), которые могут приводить к персистенции инфекции, что способствует хроническому воспалению. Латентная форма обратима, если причина стресса будет устранена. АТ вернутся к форме РТ, начнут фазу репликации и продолжат развитие, превращаясь в ЭТ [31][45]. РТ отличаются от ЭТ, так как они ориентированы на усвоение питательных веществ и участвуют в процессе репликации, что может привести к их асинхронной дифференциации обратно в ЭТ. Последние способны длительное время сохраняться в межклеточном пространстве нефагоцитированными. Между хозяином и возбудителем существует постоянное противоборство, и некоторые клинические хламидийные инфекции могут протекать без проявления симптомов в течение нескольких месяцев [17][31][33].
Хламидии обладают эпителиотропностью. Размножение хламидий в эпителиальных клетках приводит к разрушению эпителиального слоя с образованием рубцов и спаек. При длительной персистенции в эпителиальных клетках возбудитель может попадать в кровь и гематогенно – в паренхиматозные органы и лимфоидные ткани. С. felis поражает глаза и верхние дыхательные пути (нос или горло) кошек [8][33]. Возбудитель чаще всего обитает в местах содержания нескольких кошек, приютах, питомниках. Основным переносчиком патогена являются больные кошки, однако собаки тоже могут являться резервуаром для C. felis. Передача возбудителя происходит главным образом при контакте с инфицированным материалом, например с выделениями из глаз [46]. Есть данные, что животные могут заразиться при половом контакте. У кошек возбудитель локализуется в шейке матки, у котов инфицированы семенники, и возбудитель выделяется во время эякуляции [47]. Было доказано, что C. felis можно выделить из ректальных и вагинальных мазков, отобранных от больных хламидийным конъюнктивитом кошек при естественном и экспериментальном заражении, но возможность передачи возбудителя при половом контакте не ясна, вероятно, кишечник и репродуктивные органы могут являться местами персистенции инфекции [8][35]. Экспериментальная глазная инфекция кошек привела к выделению хламидий из влагалища и прямой кишки в 50 и 40% случаев соответственно, демонстрируя, что C. felis не ограничивается слизистой оболочкой конъюнктивы [35].
ПАТОГЕНЕЗ И КЛИНИЧЕСКИЕ ПРИЗНАКИ
Инкубационный период варьирует от 5 до 15 дней [32]. Инфекция, вызываемая C. felis, приводит к развитию острого или хронического конъюнктивита у кошек. Начальным симптомом является одностороннее поражение глаз, которое может прогрессировать на второй глаз, вызывая двухсторонний конъюнктивит. Также в числе клинических проявлений односторонняя или двухсторонняя эпифора, гиперемия мигательной перепонки, блефароспазм, мукоидные/слизистые/серозные/серозно-гнойные выделения, воспаление и хемоз конъюнктивальных оболочек. Данные симптомы сохраняются в течение 22–45 дней. При этом легкая форма конъюнктивита может длиться несколько месяцев [9][35][46][48][49]. Клинические симптомы со стороны респираторной системы обычно минимальны [48][49]. У некоторых кошек может наблюдаться снижение веса. Также возможны лихорадка, снижение или потеря аппетита, вялость, чихание, серозные истечения из носа, увеличение подчелюстных лимфатических узлов [8][32][35]. Состояние большинства кошек остается удовлетворительным, но у незначительного числа животных возникают серьезные нарушения дыхания, сильные хрипы, что при отсутствии лечения может привести к летальному исходу от отека легких или асфиксии из-за недостаточно развитого дыхания через рот. В случае генерализованной инфекции, что бывает редко, патоген с током крови распространяется практически по всем органам, в суставы, к головному и спинному мозгу, что с большой вероятностью приводит к летальному исходу [8][17][32]. У большинства кошек без лечения развивается хронический (слабая гиперемия конъюнктивы, формирование скудного отделяемого во внутренних уголках глаз) или фолликулярный конъюнктивит [32][35]. Выделения из глаз прекращаются через 60 дней, но отсутствие клинических симптомов не является гарантией выздоровления, хламидийная инфекция может сохраняться в течение нескольких месяцев и протекать бессимптомно [17][35]. Ко-инфекция, вызванная сочетанием C. felis с другими возбудителями (калицивирус кошек, вирус герпеса кошек первого типа, микоплазмы), увеличивает тяжесть болезни и продолжительность выделения хламидий во внешнюю среду. Хламидийная инфекция может проявляться перитонитом [8][50]. При экспериментальном заражении кошек хламидии обнаруживались в мазках с конъюнктивы в течение 8 мес. после инфицирования, что позволяет предположить длительный период бессимптомного носительства. Аэрозольное и пероральное введение патогена кошкам приводило к развитию патологии верхних дыхательных путей и легкой формы гастрита. Также выявлена связь между хламидийной инфекцией и хромотой у больных кошек, которая проявлялась через две недели после возникновения конъюнктивита у 10 из 19 инфицированных особей, однако этот факт требует более детального исследования [8][17][35]. Кроме того, при экспериментальном инокулировании возбудителя в половые пути развивался хронический сальпингит с последующим распространением на яйцевод [46]. Литературные данные расходятся в описании нарушений со стороны репродуктивной функции: высказывалось предположение о том, что патоген является причиной абортов или замершей беременности у кошек. У некоторых авторов имеются косвенные доказательства того, что C. felis может вызвать аборт, неонатальную смертность и бесплодие, но определенных причинно-следственных связей не установлено [8][10]. Бесплодие, аборты животных являются наиболее серьезным последствием хронической формы хламидиоза [40]. Считается, что некоторые метаболиты (изолейцин) могут выступать в качестве ингибиторов роста хламидий и способствовать латентному течению хламидийной инфекции [32]. Несмотря на то что хламидиоз может протекать без явных симптомов и обычно не приводит к летальному исходу, инфицированное животное остается носителем, способным передавать возбудитель [51].
ПАТОЛОГО-АНАТОМИЧЕСКИЕ ИЗМЕНЕНИЯ ПРИ ХЛАМИДИОЗЕ
При вскрытии отмечаются следующие патолого-анатомические изменения: гиперемия и увеличение размеров печени и селезенки, лимфатических узлов; признаки пневмонии и перикардита; кровоизлияния на серозных оболочках и под капсулой почек; поражения пищеварительного тракта. Наиболее характерные изменения наблюдаются в тканях легких, средостенных и бронхиальных лимфатических узлах [32][47]. На макроскопическом уровне видны следующие явления: серозный конъюнктивит, гиперплазия лимфоидных узелков селезенки, катаральный бронхит, субтотальная и тотальная интерстициальная пневмония и пневмосклероз, гиперплазия и серозный лимфаденит регионарных лимфоузлов. При гистологическом исследовании морфологическими критериями хламидийной инфекции на микроскопическом уровне являются: интерстициальная пневмония, пневмосклероз, фибринозно-гнойная плевропневмония, интерстициальная бронхопневмония (утолщение интерстициальных альвеолярных перегородок из-за инфильтрации воспалительных клеток и экссудата в бронхиальной ткани), гиперплазия и серозный лимфаденит средостенных и бронхиальных лимфатических узлов, гиперплазия лимфоидных узелков селезенки, слизистой оболочки кишечника, венозная гиперемия печени и почек, жировая и зернистая дистрофии печени. Также наблюдается резкое полнокровие органов с явлениями диапедеза вокруг капилляров и гиперплазия островковых отделов, секретирующих инсулин в поджелудочной железе. Слабо выраженные внешние клинические симптомы могут сочетаться с серьезными дегенеративными, деструктивными изменениями во внутренних органах и тканях [17][41][52].
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ХЛАМИДИОЗА
Лабораторная диагностика основывается на прямом выявлении возбудителя в материале и определении противохламидийных антител посредством серологических реакций (иммуноферментный анализ, реакция связывания комплемента, реакция длительного связывания комплемента). Серологические реакции в диагностике хламидиоза являются скрининговыми, требующими дальнейшего подтверждения другими методами. Существуют лабораторные методы, позволяющие выявлять РТ и ЭТ. Они включают в себя цитологический (данный анализ не требует специального оборудования, но его чувствительность и специфичность достаточно низкая), иммунологический (прямой и непрямой иммунофлюоресцентный анализ, иммуноферментный анализ), культуральный (считается золотым стандартом, но трудоемкий и длительный, используется в научной практике), молекулярно-биологический (полимеразная цепная реакция – наиболее чувствительный быстрый и надежный) методы [33][53][54]. Молекулярный анализ наиболее достоверен для постановки окончательного диагноза «хламидиоз кошек», поскольку заболевание может иметь различные клинические проявления, протекать в субклинической форме (бактерионосительство) [51].
Из-за неспособности хламидий расти на искусственных питательных средах для их культивирования используют 6–7-суточные эмбрионы кур категории SPF (specific pathogen free), которые заражают в желточный мешок. Гибель эмбриона в первые двое суток после инфицирования считается неспецифической. Период инкубации длится до 13 дней, что является основным недостатком. Культивирование на куриных эмбрионах до 1965 г. было единственным методом изоляции и размножения хламидий, однако впоследствии применение клеточных культур упростило данную процедуру [17][55]. Для сокращения сроков культивирования до 48–72 ч используют чувствительные культуры клеток, в частности для выращивания С. felis применяются такие линии клеток, как Vero (перевиваемая линия клеток почки африканской зеленой мартышки Chlorocebus aethiops), МсСоу (гибридная линия синовиальных клеток человека и фибробластов мыши), CrFK (перевиваемая культура клеток почки кошки), BHK-21 (клеточная линия из почки новорожденного сирийского хомячка), HeLa (клетки раковой опухоли шейки матки человека), L929 (клеточная линия фибробластов мыши) [17][42][50]. Для повышения адсорбции и проникновения хламидий в клетку используют центрифугирование или физико-химические способы снижения резистентности культур клеток. Например, поликатионы (DEAE-декстран – диэтиламиноэтилдекстран) применяют для обработки монослоя перед заражением культур клеток, они нейтрализуют анионную поверхность хламидий, создавая условия для контакта. После контакта в питательную среду добавляют антиметаболиты, которые замедляют метаболизм клеток, но не влияют на хламидии, и косвенным путем стимулируют их репродукцию. Чаще всего хламидии культивируют на культурах клеток, обработанных циклогексимидом или аналогами (L-цистеин гидрохлорид, гидрокортизон, колхицин) [56]. Для выделения бактерий используют конъюнктивальные, ректальные, вагинальные смывы, помещаемые во время транспортировки в специальную среду, начать исследование биологического материала необходимо не позднее 24 ч после отбора, заморозка и оттаивание на С. felis может действовать губительно [50].
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ХЛАМИДИОЗА
В связи с системным течением хламидиоза местная терапия является неэффективной [8]. Длительным курсом применяются такие антибиотики, как доксициклин, азитромицин, амоксициллин, местное лечение назначается дополнительно. Для профилактики можно использовать мелатонин, серотонин или их производные. По некоторым данным, мелатонин ингибирует начальное прогрессирование цикла развития хламидий, препятствует возникновению внутриклеточной инфекции и превращению ЭТ в РТ [57]. Также в качестве терапии можно использовать хламидийные бактериофаги как альтернативу антибиотикам, тем самым решая проблему антибиотикорезистентности. В частности, антибиотики не способны подавлять хламидийные ЭТ, которые являются метаболически инертными и сложно поддаются эрадикации [42]. Хламидиофаги провоцируют торможение цикла развития и задерживают переход РТ в ЭТ, таким образом снижая возможность заражения других клеток. Хламидийные бактериофаги имеются только у шести видов, включая C. felis [43].
Вакцинация для профилактики хламидийной инфекции обычно начинается с 8–9-недельного возраста с последующей ревакцинацией через 2–4 недели и далее ежегодно. Следует отметить, что информация о продолжительности иммунитета ограниченна. На рынке доступны живые аттенуированные и инактивированные адъювантные вакцины. Достоверных данных для сравнения их эффективности нет. Вакцины эффективны в протективном отношении от клинических симптомов болезни, но не от возникновения инфекции. Они снижают репликацию хламидий в организме и уменьшают клинические проявления инфекции. По рекомендации WSAVA (World Small Animal Veterinary Association) вакцинация против хламидиоза, вызываемого С. felis, является дополнительной и рекомендована в случаях, когда существует риск заражения (самовыгул), в рамках мероприятий по борьбе с данной болезнью, при скученном содержании животных, в приютах, а также животным, участвующим в выставках и племенном разведении [30][50][58]. Не выявлено сильной и убедительной зависимости между уровнем специфических антител и устойчивостью вакцинированных кошек к заражению C. felis [50].
Иммунитет против возбудителя хламидийной инфекции слабый или непродолжительный и не защищает от повторного инфицирования. У кошек с возрастом появляется устойчивость к заражению. В ответ на инфицирование хламидиями задействуется как гуморальный, так и клеточный иммунитет [8]. Считается, что клеточный иммунитет играет решающую роль в защите организма от данного патогена. Белки MOMP и POMP являются мишенями для защитных иммунных реакций организма. Котята изначально защищены антителами на 9–12 недель при получении молозива от переболевших кошек [8][30].
На начальной стадии инфекционного процесса в иммунный ответ вовлечены полиморфноядерные лимфоциты. Ведущее значение в защите от хламидиоза занимает поликлональная активация В-лимфоцитов. Тем не менее главенствующая роль в иммунной защите от хламидиоза принадлежит Т-хелперам, которые активируют фагоцитарную активность макрофагов [59].
Одним из ключевых факторов патогенности хламидий является протеасомный белок CPAF (сhlamydial protease / proteasome-like activity factor), который подавляет активацию нейтрофилов. В присутствии CPAF индуцируется экспрессия антиапоптотического белка дифференцировки клеток миелоидного лейкоза (Mcl-1), который способствует деградации проапоптотических молекул, таких как BCL-2-подобный белок 11 (Bim). Таким образом, Chlamydia препятствует апоптозу клеток-хозяев, что приводит к длительному периоду персистенции, то есть репликации внутри клеток-хозяев. CPAF разрушает основной комплекс гистосовместимости (MHC), препятствуя презентации антигена к Т-клеткам. Кроме того, представители рода Chlamydia увеличивают экспрессию PD-L1 (лиганд программированной клеточной смерти 1) в клетках-хозяевах. Связывание PD-L1 с рецептором PD-1 (программируемая клеточная смерть 1) на поверхности Т-клеток представляет собой негативный сигнал, подавляющий активацию Т-клеточного рецептора (TCR) [60]. Таким образом, хламидия является бактерией, хорошо приспособленной ко многим защитным механизмам организма хозяина, что усложняет процесс ее элиминации и подтверждает необходимость в разработке эффективных методов профилактики.
ЗАКЛЮЧЕНИЕ
Анализ современных научных данных о хламидиозе кошек позволяет заключить, что сведения об эпизоотической ситуации не отражают реального распространения данной болезни. C. felis является патогеном, способным поражать не только кошек, но и других животных, а также человека.
Сложный цикл развития, наличие способности преодолевать иммунитет хозяина, длительная персистенция в организме усложняют его эрадикацию. Диагностика хламидиоза затруднена в связи с низкой устойчивостью возбудителя вне организма, наиболее чувствительным методом является ПЦР. Длительный курс лечения, переход в хроническое течение и регулярные рецидивы снижают качество жизни животных-компаньонов, а терапия требует высоких экономических затрат.
Профилактика заключается в своевременной вакцинации, иммунитет против возбудителя хламидийной инфекции слабый или непродолжительный и не защищает от повторного инфицирования. При этом клеточный иммунитет имеет большее значение, чем гуморальный. Отсюда складывается необходимость в превентивных мерах по защите животных от болезни.
Для целей разработки схем успешного лечения и профилактики хламидиоза кошек требуется более детальное изучение C. felis.
Список литературы
1. Sostaric- Zuckermann I. C., Borel N., Kaiser C., Grabarevic Z., Pospischil A. Chlamydia in canine or feline coronary arteriosclerotic lesions. BMC Research Notes. 2011; 4:350. https://doi.org/10.1186/1756-0500-4-350
2. Sibitz C., Rudnay E. C., Wabnegger L., Spergser J., Apfalter P., Nell B. Detection of Chlamydophila pneumoniae in cats with conjunctivitis. Veterinary Ophthalmology. 2011; 14 (Suppl. 1): 67–74. https://doi.org/10.1111/j.1463-5224.2011.00919.x
3. Fukushi H., Hirai K. Genetic diversity of avian and mammalian Chlamydia psittaci strains and relation to host origin. Journal of Bacteriology. 1989; 171 (5): 2850–2855. https://doi.org/10.1128/jb.171.5.2850-2855.1989
4. Sanderson H., Vasquez M., Killion H., Vance M., Sondgeroth K., Fox J. Fatal Chlamydia psittaci infection in a domestic kitten. Journal of Veterinary Diagnostic Investigation. 2021; 33 (1): 101–103. https://doi.org/10.1177/1040638720966960
5. Lewin A. C., Hicks S. K., Carter R. T. A review of evidence- based management of infectious ocular surface disease in shelter-housed domestic cats. Veterinary Ophthalmology. 2023; 26 (Suppl. 1): 47–58. https://doi.org/10.1111/vop.13063
6. Chan I., Dowsey A., Lait P., Tasker S., Blackwell E., Helps C. R., Barker E. N. Prevalence and risk factors for common respiratory pathogens within a cohort of pet cats in the UK. Journal of Small Animal Practice. 2023; 64 (9): 552–560. https://doi.org/10.1111/jsap.13623
7. Longbottom D., Coulter L. J. Animal chlamydioses and zoonotic implications. Journal of Comparative Pathology. 2003; 128 (4): 217–244. https://doi.org/10.1053/jcpa.2002.0629
8. Sykes J. E. Feline chlamydiosis. Clinical Techniques in Small Animal Practice. 2005; 20 (2): 129–134. https://doi.org/10.1053/j.ctsap.2004.12.018
9. Halánová M., Sulinová Z., Čisláková L., Trbolová A., Páleník L., Weissová T., et al. Chlamydophila felis in cats – are the stray cats dangerous source of infection? Zoonoses and Public Health. 2011; 58 (7): 519–522. https://doi.org/10.1111/j.1863-2378.2011.01397.x
10. Fontbonne A. Infertility in queens: Clinical approach, experiences and challenges. Journal of Feline Medicine and Surgery. 2022; 24 (9): 825–836. https://doi.org/10.1177/1098612x221118752
11. Sachse K., Bavoil P. M., Kaltenboeck B., Stephens R. S., Kuo C.-C., Rosselló- Móra R., Horn M. Emendation of the family Chlamydiaceae: proposal of a single genus, Chlamydia, to include all currently recognized species. Systematic and Applied Microbiology. 2015; 38 (2): 99–103. https://doi.org/10.1016/j.syapm.2014.12.004
12. Wu S.-M., Huang S.-Y., Xu M.-J., Zhou D.-H., Song H.-Q., Zhu X.-Q. Chlamydia felis exposure in companion dogs and cats in Lanzhou, China: A public health concern. BMC Veterinary Research. 2013; 9:104. https://doi.org/10.1186/1746-6148-9-104
13. Ulbert Á. B., Juhász H., Karácsony Z., Bencze K., Deim Z., Burián K., Terhes G. The occurrence of Chlamydia felis in cats and dogs in Hungary. Pathogens. 2024; 13 (9):771. https://doi. org/10.3390/pathogens13090771
14. Hughes L., Visser S., Heddema E., de Smet N., Linssen T., Wijdh R. J., Huis in ‘t Veld R. Zoonotic transmission of Chlamydia felis from domestic cats; A case series of chronic follicular conjunctivitis in humans. New Microbes and New Infections. 2024; 59:101412. https://doi.org/10.1016/j.nmni.2024.101412
15. Jazi S., Mokhtari A., Kahrizsangi A. E. Molecular detection of Chlamydia psittaci and Chlamydia felis in human keratoconjunctivitis cases. Bulgarian Journal of Veterinary Medicine. 2020; 23 (1): 130–137. https://doi.org/10.15547/bjvm.2124
16. Wons J., Meiller R., Bergua A., Bogdan C., Geißdörfer W. Follicular conjunctivitis due to Chlamydia felis – case report, review of the literature and improved molecular diagnostics. Frontiers in Medicine. 2017; 4:105. https://doi.org/10.3389/fmed.2017.00105
17. Chen J., Long J., Zhou H., Huang C., Zhu Y., Wang R., et al. Isolation and characterization of Chlamydia felis and its pathogenesis in cats. Veterinary Microbiology. 2024; 295:110128. https://doi.org/10.1016/j.vetmic.2024.110128
18. Miyashita N., Fukano H., Mouri K., Fukuda M., Yoshida K., Kobashi Y., et al. Community-acquired pneumonia in Japan: a prospective ambulatory and hospitalized patient study. Journal of Medical Microbiology. 2005; 54 (4): 395–400. https://doi.org/10.1099/jmm.0.45920-0
19. Corsaro D., Venditti D. Detection of novel Chlamydiae and Legionellales from human nasal samples of healthy volunteers. Folia Microbiologica. 2015; 60 (4): 325–334. https://doi.org/10.1007/s12223-015-0378-y
20. Laroucau K., Di Francesco A., Vorimore F., Thierry S., Pingret J. L., Bertin C., et al. Multilocus variable- number tandem- repeat analysis scheme for Chlamydia felis genotyping: comparison with multilocus sequence typing. Journal of Clinical Microbiology. 2012; 50 (6): 1860–1866. https://doi.org/10.1128/jcm.00417-12
21. Marti I., Pisano S. R. R., Wehrle M., Meli M. L., Hofmann- Lehmann R., Ryser- Degiorgis M. P. Severe conjunctivitis associated with Chlamydia felis infection in a free-ranging Eurasian lynx (Lynx lynx). Journal of Wildlife Diseases. 2019; 55 (2): 522–525. https://doi.org/10.7589/2018–05–142
22. Luu L. D.W., Kasimov V., Phillips S., Myers G. S. A., Jelocnik M. Genome organization and genomics in Chlamydia: whole genome sequencing increases understanding of chlamydial virulence, evolution, and phylogeny. Frontiers in Cellular and Infection Microbiology. 2023; 13:1178736. https://doi.org/10.3389/fcimb.2023.1178736
23. Федорова В. А. Геномные и постгеномные технологии в изучении и диагностике хламидиозов. Методы компьютерной диагностики в биологии и медицине – 2020: сборник статей Всероссийской школы- семинара (Саратов, 18–19 ноября 2020 г.). Саратов: Саратовский источник; 2020; 19–22. https://elibrary.ru/jgjgai
24. McManus C. M., Levy J. K., Andersen L. A., McGorray S. P., Leutenegger C. M., Gray L. K., et al. Prevalence of upper respiratory pathogens in four management models for unowned cats in the Southeast United States. The Veterinary Journal. 2014; 201 (2): 196–201. https://doi.org/10.1016/j.tvjl.2014.05.015
25. Ju H., Yang D., Jin J., Wang J., Li X., Yang X., et al. Spectrum detection and analysis of the epidemiological characteristics of infectious pathogens in the feline respiratory tract. Archives of Virology. 2024; 169 (9):177. https://doi.org/10.1007/s00705-024-06093-5
26. Ohya K., Takahara Y., Kuroda E., Koyasu S., Hagiwara S., Sakamoto M., et al. Chlamydophila felis CF0218 is a novel TMH family protein with potential as a diagnostic antigen for diagnosis of C. felis infection. Clinical and Vaccine Immunology. 2008; 15 (10): 1606–1615. https://doi.org/10.1128/cvi.00134-08
27. Kiełbowicz Z., Płoneczka-Janeczko K., Bania J., Bierowiec K., Kiełbowicz M. Characteristics of the bacterial flora in the conjunctival sac of cats from Poland. Journal of Small Animal Practice. 2015; 56 (3): 203–206. https://doi.org/10.1111/jsap.12304
28. Коняев С. В. Распространенность возбудителей респираторных инфекций кошек и собак в России. Российский ветеринарный журнал. 2020; (1): 9–13. https://doi.org/10.32416/25004379-2020-2020-1-9-13
29. Струговщиков А. Ю., Пудовкин Н. А., Салаутин В. В. Особенности распространения хламидийной инфекции в городе Москва. Международный вестник ветеринарии. 2020; (2): 21–25. https://elibrary.ru/qikmft
30. Gruffydd-Jones T., Addie D., Belák S., Boucraut-Baralon C., Egberink H., Frymus T., et al. Chlamydophila felis infection: ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery. 2009; 11 (7): 605–609. https://doi.org/10.1016/j.jfms.2009.05.009
31. Azuma Y., Hirakawa H., Yamashita A., Cai Y., Rahman M. A., Suzuki H., et al. Genome sequence of the cat pathogen, Chlamydophila felis. DNA Research. 2006; 13 (1): 15–23. https://doi.org/10.1093/dnares/dsi027
32. Федорова В. А., Ляпина А. М., Хижнякова М. А., Зайцев С. С., Салтыков Ю. В., Субботина И. А. и др. Хламидиозы животных и человека. М.: Наука; 2019. 135 с. https://doi.org/10.7868/9785020402492
33. Borel N., Polkinghorne A., Pospischil A. A review on chlamydial diseases in animals: still a challenge for pathologists? Veterinary Pathology. 2018; 55 (3): 374–390. https://doi.org/10.1177/0300985817751218
34. Ravichandran K., Anbazhagan S., Karthik K., Angappan M., Dhayananth B. A comprehensive review on avian chlamydiosis: a neglected zoonotic disease. Tropical Animal Health and Production. 2021; 53 (4):414. https://doi.org/10.1007/s11250-021-02859-0
35. Bressan M., Rampazzo A., Kuratli J., Marti H., Pesch T., Borel N. Occurrence of Chlamydiaceae and Chlamydia felis pmp9 typing in conjunctival and rectal samples of Swiss stray and pet cats. Pathogens. 2021; 10 (8):951. https://doi.org/10.3390/pathogens10080951
36. Вафин Р. Р., Равилов Р. Х., Гаффаров Х. З., Равилов А. З., Исхаков Г. М., Бакиров И. Х. Сравнительная характеристика штаммов хламидий по omp1-гену. Ветеринарная практика. 2007; (3): 54–59. https://elibrary.ru/knpdej
37. Harley R., Herring A., Egan K., Howard P., Gruffydd- Jones T., Azuma Y., et al. Molecular characterisation of 12 Chlamydophila felis polymorphic membrane protein genes. Veterinary Microbiology. 2007; 124 (3–4): 230–238. https://doi.org/10.1016/j.vetmic.2007.04.022
38. Di Francesco A., Baldelli R. Feline chlamydiosis in Italy: PCR amplification and analysis of the ompA and groEL-homolog genes. New Microbiologica. 2002; 25 (3): 341–344. https://pubmed.ncbi.nlm.nih.gov/12173777
39. Семенов В. М., Семенов Д. М., Хворик Д. Ф., Козин В. М., Бажин Ю. А., Дмитраченко Т. И. и др. Хламидийная инфекция. Витебск: ВГМУ; 2006. 205 с. https://elibrary.ru/emcwop
40. Альдяков А. В., Конанова Т. Е. Хламидиоз у кошек. Вестник Чувашской государственной сельскохозяйственной академии. 2021; (2): 53–57. https://elibrary.ru/nsylpm
41. Равилов А. З., Гаффаров Х. З., Равилов Р. Х. Хламидиоз животных. Казань: Фэн; 2004. 368 с.
42. Klose S. M., De Souza D. P., Devlin J. M., Bushell R., Browning G. F., Vaz P. K. A ,, plus one” strategy impacts replication of felid alphaherpesvirus 1, Mycoplasma and Chlamydia, and the metabolism of coinfected feline cells. mSystems. 2024; 9 (10): e00852–24. https://doi.org/10.1128/msystems.00852-24
43. Pawlikowska- Warych M., Śliwa- Dominiak J., Deptuła W. Chlamydial plasmids and bacteriophages. Acta Biochimica Polonica. 2015; 62 (1): 1–6. https://doi.org/10.18388/abp.2014_764
44. Гладин Д. П., Королюк А. М., Дробот И. В., Кириллова Н. П., Козлова Н. С., Анненкова И. Д. Хламидии и хламидиозы. Российские биомедицинские исследования. 2021; 6 (4): 37–46. https://elibrary.ru/olcqbo
45. Elwell C., Mirrashidi K., Engel J. Chlamydia cell biology and pathogenesis. Nature Reviews Microbiology. 2016; 14 (6): 385–400. https://doi.org/10.1038/nrmicro.2016.30
46. Cheong H. C., Lee C. Y. Q., Cheok Y. Y., Tan G. M. Y., Looi C. Y., Wong W. F. Chlamydiaceae: diseases in primary hosts and zoonosis. Microorganisms. 2019; 7 (5):146. https://doi.org/10.3390/microorganisms7050146
47. Лисовая В. В., Савченко А. Патоморфологическая характеристика хламидиоза у котов. Науковий вісник ЛНУВМБТ імені С. З. Ґжицького. 2017; 19 (77): 11–14. https://elibrary.ru/ytalpz (на украинском)
48. Caspe S. G., Hill H. Chlamydiosis in animals. Animals. 2024; 14 (21):3130. https://doi.org/10.3390/ani14213130
49. Nguyen D., Barrs V. R., Kelman M., Ward M. P. Feline upper respiratory tract infection and disease in Australia. Journal of Feline Medicine and Surgery. 2019; 21 (10): 973–978. https://doi. org/10.1177/1098612x18813248
50. Диагностика и профилактика инфекционных болезней собак и кошек: руководство для практикующих ветеринарных врачей. Под ред. Т. И. Алипера. М.: ЗооВетКнига; 2017. 300 с.
51. Wasissa M., Lestari F. B., Nururrozi A., Tjahajati I., Indarjulianto S., Salasia S. I. O. Investigation of chlamydophilosis from naturally infected cats. Journal of Veterinary Science. 2021; 22 (6): e67. https://doi.org/10.4142/jvs.2021.22.e67
52. Лисовая В. В., Савченко А. Гистологические изменения у котов при хламидиозе. Науковий вісник ЛНУВМБ імені С. З. Ґжицького. 2017; 19 (78): 158–161. https://elibrary.ru/zswrst (на украинском)
53. Mills D. Diagnosis of Chlamydophila felis by conjunctival cytology in shelter cats. BSAVA Congress Proceedings. 2016; 527. https://www.bsavalibrary.com/content/chapter/10.22233/9781910443446.ch66sec5
54. Белова Е. В., Капустина Т. А., Маркина А. Н., Парилова О. В. Лабораторная диагностика респираторного хламидиоза. Сибирское медицинское обозрение. 2019; (1): 5–16. https://doi.org/10.20333/2500136-2019-1-5-16
55. Scidmore M. A. Cultivation and laboratory maintenance of Chlamydia trachomatis. Current Protocols in Microbiology. 2006; 11A.1.1–11A.1.25. https://doi.org/10.1002/9780471729259.mc11a01s00
56. Зур Н. В., Миронов А. Ю., Алешкин В. А., Афанасьев С. С., Рубальская Е. Е., Афанасьев М. С., Рубальский Е. О. Актуальные аспекты лабораторной диагностики урогенитальной хламидийной инфекции. Астраханский медицинский журнал. 2016; 11 (2): 16–32. https://elibrary.ru/wfaqab
57. Rahman M. A., Azuma Y., Fukunaga H., Murakami T., Sugi K., Fukushi H., et al. Serotonin and melatonin, neurohormones for homeostasis, as novel inhibitors of infections by the intracellular parasite Chlamydia. Journal of Antimicrobial Chemotherapy. 2005; 56 (5): 861–868. https://doi.org/10.1093/jac/dki331
58. Squires R. A., Crawford C., Marcondes M., Whitley N. 2024 guidelines for the vaccination of dogs and cats – compiled by the Vaccination Guidelines Group (VGG) of the World Small Animal Veterinary Association (WSAVA). Journal of Small Animal Practice. 2024; 65 (5): 277–316. https://doi.org/10.1111/jsap.13718
59. Медова Е. В., Пивоваренко Е. А. Разрешающая способность методов прижизненной диагностики хламидийной инфекции в популяции плотоядных в условиях урбанизированных территорий. Ветеринарная патология. 2005; (4): 132–134. https://elibrary.ru/hsqenl
60. Wong W. F., Chambers J. P., Gupta R., Arulanandam B. P. Chlamydia and its many ways of escaping the host immune system. Journal of Pathogens. 2019; 2019:8604958. https://doi.org/10.1155/2019/8604958
Об авторах
И. С. ЦыгановРоссия
Цыганов Илья Сергеевич, аспирант, ветеринарный врач лаборатории профилактики болезней мелких домашних животных,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
С. В. Щербинин
Россия
Щербинин Сергей Владимирович, канд. вет. наук, научный сотрудник информационно-аналитического центра,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Т. С. Галкина
Россия
Галкина Татьяна Сергеевна, канд. вет. наук, заведующий лабораторией профилактики болезней мелких домашних животных,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
К. Н. Груздев
Россия
Груздев Константин Николаевич, д-р биол. наук, профессор, главный научный сотрудник информационно-аналитического центра,
ул. Гвардейская, 6, мкр. Юрьевец, г. Владимир, 600901.
Рецензия
Для цитирования:
Цыганов И.С., Щербинин С.В., Галкина Т.С., Груздев К.Н. Хламидиоз кошек (обзор). Ветеринария сегодня. 2025;14(4):326-336. https://doi.org/10.29326/2304-196X-2025-14-4-326-336
For citation:
Tsyganov I.S., Shcherbinin S.V., Galkina T.S., Gruzdev K.N. Feline chlamydiosis (review). Veterinary Science Today. 2025;14(4):326-336. https://doi.org/10.29326/2304-196X-2025-14-4-326-336
JATS XML



































