Перейти к:
Исследование методом проточной цитометрии динамики трансформации ДНК в культуре клеток ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства
https://doi.org/10.29326/2304-196X-2024-13-1-87-94
Аннотация
Исследование посвящено изучению динамики трансформации ДНК клеток сублинии ВНК-21/SUSP/ARRIAH при репродукции в них вируса бешенства. Инфицированные возбудителем и контрольные интактные клетки культивировались в аналогичных условиях. При выявлении зависимости инфекционности вируса от времени репродукции установили, что титр его инфекционной активности увеличивался от (3,2 ± 0,2) lg ККИД50/см3 при инокуляции до (7,63 ± 0,3) lg ККИД50/см3 через 48 ч репродукции, но более интенсивно он возрастал в первые 24 ч. Концентрация клеток при этом изменилась с 0,5 до 1,9 млн/см3, то есть выросла в 3,8 раза. Спустя 24 ч кратность прироста клеток замедлялась. В процессе изучения фаз клеточного цикла при репродукции в клетке-хозяине вируса бешенства получены результаты, позволяющие оценить продолжительность и доминирование фаз G1, S, G2 + M на разных этапах культивирования. Динамика изменений популяции клеток, находящихся в апоптозе, в контроле и опыте была одинаковой в течение 36 ч культивирования. По прошествии данного времени инфицированных клеток в стадии апоптоза было на 28–42% больше по сравнению с таковыми в контроле. Доля клеток, находящихся в стадии фазы G1, через 9 ч в опытных образцах увеличилась на 11,7%, в контрольных, наоборот, уменьшилась на 16,6%. В дальнейшем количество клеток в G1-фазе и в контроле, и в опыте изменялось одинаково: через 15–18 ч наблюдали уменьшение на 40%, далее – ростовой скачок на 45–46%, потом опять снижение на 39–40%, затем вновь увеличение. После 33 ч репродукции и до окончания культивирования доля инфицированных клеток, находящихся в фазе G1, была значительно больше (на 12–21%), чем контрольных. Количество клеток в фазе S в опыте и контроле в первые сутки репродукции вируса было одинаковым, при этом наблюдали резкое скачкообразное увеличение через 15 и 24 ч в 3,4 и 2,4 раза соответственно. Через 24 ч между инфицированными и контрольными клетками начали проявляться различия, которые постепенно возрастали с 8 до 137% к окончанию репродукции. В фазе G2 + M через 30 ч репродукции количество клеток опытных образцов начинало уменьшаться на 17–28% по сравнению с контрольными. Перестройка клетки на синтез полных частиц вируса бешенства наступала через 24 ч репродукции. Об этом говорят изменения в фазах клеточного цикла клетки-хозяина и замедление прироста самой популяции клеток линии ВНК-21/SUSP/ARRIAH.
Ключевые слова
Для цитирования:
Гусева М.Н., Доронин М.И., Шевченко М.А., Михалишин Д.В., Борисов А.В., Елькина Ю.С., Оковытая Т.В., Захаров В.М., Михалишин В.В. Исследование методом проточной цитометрии динамики трансформации ДНК в культуре клеток ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства. Ветеринария сегодня. 2024;13(1):87-94. https://doi.org/10.29326/2304-196X-2024-13-1-87-94
For citation:
Guseva M.N., Doronin M.I., Shevchenko M.A., Mikhalishin D.V., Borisov A.V., El’kina Yu.S., Okovytaya T.V., Zakharov V.М., Mikhalishin V.V. Flow cytometry study of DNA transformation dynamics in ВНК-21/SUSP/ARRIAH cell culture during rabies virus reproduction. Veterinary Science Today. 2024;13(1):87-94. https://doi.org/10.29326/2304-196X-2024-13-1-87-94
ВВЕДЕНИЕ
Бешенство – остро протекающая болезнь теплокровных животных, характеризующаяся поражением центральной нервной системы. К заболеванию восприимчивы домашние и дикие животные всех видов, а также человек [1, 2, 3, 4, 5].
Цикл репродукции вируса включает его адсорбцию на поверхности клеток, проникновение в клетку, раздевание, транскрипцию, трансляцию, репликацию, сборку и почкование.
Для первичной транскрипции нет необходимости в синтезе структурных белков. Для вируса бешенства присущи 2 типа транскрипции: 1) с геномной РНК сначала транскрибируется лидерная РНК, затем последовательно 5 моноцистронных мРНК, с которых в цитоплазме транслируются белки N, P, M, L, а мРНК G-гена транслируется в полисомах, связанных с мембраной комплекса Гольджи; 2) транскрипция с геномной РНК антигеномных (позитивно-полярных) РНК, которые служат матрицами для синтеза новых генераций геномных РНК отрицательной полярности. В отличие от первичной транскрипции, репликация геномной РНК по описанному механизму может происходить только одновременно с трансляцией и синтезом структурных белков, в особенности N и Р, необходимых для инкапсидации РНК в нуклеокапсидные структуры. Если белки L, N и P контролируют главным образом транскрипцию и репликацию РНК, то М-белок занимает промежуточное положение между нуклеокапсидом и оболочкой вириона, участвуя в конденсации РНК. Кроме того, М-белок играет ключевую роль в регуляции синтеза РНК и почковании вируса [6, 7]. На финальной стадии сборки и почкования нуклеокапсиды «надевают» вирусную оболочку, представленную G-белком, который интегрирован в клеточную мембрану. Гликопротеин детерминирует нейровирулентность и нейроинвазивность вируса бешенства.
Место формирования вирусных частиц зависит от вируса и клеток хозяина. Для представителей рода Lyssavirus семейства Rhabdoviridae, к которому относится вирус бешенства, синтез и сборка нуклеокапсидов происходят в цитоплазме, а почкование – через плазматическую мембрану клетки, от которой вирион получает дополнительный липидный слой.
Вирус бешенства не вызывает в клетках характерные цитопатические изменения. Все события транскрипции и репликации происходят в цитоплазме внутри телец Бабеша – Негри. Данные структуры являются типичными при бешенстве и, таким образом, могут быть использованы в качестве патогномического симптома наличия инфекции [8].
Проточная цитометрия – это современная технология, обеспечивающая быстрый, качественный и мультипараметрический анализ клеток, которая получила широкое распространение в таких областях медицины, как иммунология, фармакология, цитология, онкология, гематология, генетика, инфектология [9-15].
Методом проточной цитометрии можно получить самые разные данные: определить содержание в клетке ДНК и РНК, суммарное количество белков и количество специфических белков, узнаваемых моноклональными антителами; исследовать клеточный метаболизм; изучить транспортировку ионов кальция и кинетику ферментативных реакций [15-20].
У каждой клетки есть период существования от момента ее образования путем деления материнской клетки до митоза или гибели, получивший название клеточного цикла. Он состоит из двух периодов: 1) период клеточного роста (интерфаза); 2) период клеточного деления – М-фаза (от греч. mitos – нить). В свою очередь, в каждом периоде выделяют несколько фаз. Обычно интерфаза занимает не меньше 90% времени всего клеточного цикла. Большая часть компонентов клетки синтезируется на протяжении всей интерфазы, это затрудняет выделение в ней отдельных стадий.
Интерфаза подразделяется на подфазы G1, S и G2. Период интерфазы, когда происходит репликация ДНК клеточного ядра, был назван «фаза S» (от греч. synthesis – синтез). Нужно отметить, что в интерфазе (в основном в фазе S) наблюдается не только репликация ДНК, но и основной биосинтез структурных и функциональных белков клетки. Период между фазой М и началом фазы S обозначен как фаза G1 (от англ. gap – промежуток), а период между концом фазы S и последующей фазой М – как фаза G2 [21].
Благодаря использованию в исследованиях проточных цитометров определены важные данные, касающиеся принадлежности клеток к фазам репродуктивного цикла, а также получены результаты, позволяющие оценить продолжительность и доминирование соответствующих фаз клеточного цикла G1, S, G2 + M на разных этапах культивирования [18-23]. С учетом вышеизложенного можно сделать вывод, что характер изменений клеточного цикла при репликации в клетке вируса является важным для понимания процесса его репродукции, но малоизученным фактом.
Целью работы было изучение методом проточной цитометрии динамики трансформации ДНК в культуре клеток ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточная линия. В работе использовали суспензионную перевиваемую культуру клеток почки новорожденного сирийского хомячка ВНК-21/SUSP/ARRIAH [24]. Клетки выращивали согласно «Промышленному регламенту на производство вакцины против ящура различных типов», утвержденному директором ФГБУ «ВНИИЗЖ», в культиваторах металлических с рабочим объемом до 1800 дм3.
Вирус бешенства. Для заражения клеток применяли производственный штамм «ВНИИЗЖ» вируса бешенства.
Питательная среда для выращивания клеток. Использовали среду Игла с добавлением 5% фетальной сыворотки крупного рогатого скота фирмы Serana (Германия) и 0,25%-го гидролизата белков крови (Россия).
Культивирование вируса бешенства. Репродукцию вируса бешенства проводили на протяжении 48 ч во флаконах объемом 0,5 дм3, используя фильтры к флакону Minisart® RC25 Syringe Filters 17764-ACK Ø 25 mm (Sartorius, Германия).
Кратность прироста высчитывали как отношение конечной (через 48 ч) и исходной концентрации клеток в пределах одного пассажа.
Заражение клеток вирусом бешенства. Культуральный вирус бешенства инокулировали в суспензионную культуру клеток ВНК-21/SUSP/ARRIAH в дозе 0,1 ККИД50/кл. Образцы с инфицированными клетками обозначали как опытные, не зараженные вирусом клетки служили контролем и культивировали в аналогичных условиях.
Определение стадий клеточного цикла осуществляли на проточном цитометре AccuriTM С6 с помощью набора для работы с цитометром BD CycletestTM, а также набора реактивов для анализа количества ДНК в клетках С6 Flow Cytometer Fluid Kit (Becton Dickinson and Company, США).
Определение титра инфекционной активности вируса бешенства проводили согласно «Методическим рекомендациям по опосредованному определению титра инфекционной активности культурального вируса бешенства штамма «ВНИИЗЖ» в сырье для вакцины методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР-РВ)»1.
Пробы отбирали каждые 3 ч в течение всего времени репродукции вируса бешенства. Концентрацию клеток ВНК-21/SUSP/ARRIAH в суспензии определяли с помощью камеры Горяева для счета форменных элементов крови dА0.000.851, которая соответствует ТУ 64-1-816-84. К 1 см3 клеточной взвеси добавляли равный объем 0,2%-го раствора трипановой сини, тщательно перемешивали и заправляли камеру. Количество клеток в 1 см3 суспензии рассчитывали по формуле [21]:
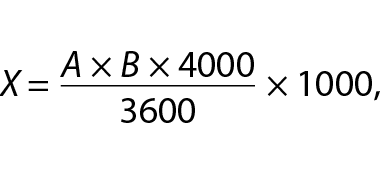
где Х – количество клеток в 1 см3; А – общее количество клеток в камере; В – разведение суспензии.
Подсчет проводили при 10-кратном увеличении микроскопа.
Статистическая обработка данных. Цифровой материал статистически обрабатывали на персональном компьютере общепринятыми методами вариационной статистики с использованием программы Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамику репродукции вируса оценивали по следующим показателям:
– зависимость титра инфекционной активности вируса от времени репродукции;
– изменения апоптоза и дебриса;
– изменения стадий клеточного цикла (G1, S, G2 + M).
При культивировании водородный показатель (рН) суспензии контролировали каждые 3 ч.
На рисунке 1 отображена динамика уровня инфекционной активности вируса бешенства при репродукции в культуре клеток ВНК-21/SUSP/ARRIAH.
Отмечено, что титр инфекционной активности вируса увеличивался от (3,2 ± 0,2) lg ККИД50/см3 при инокуляции до (7,63 ± 0,3) lg ККИД50/см3 через 48 ч репродукции, но более интенсивно он рос первые 24 ч (до 6,76 ККИД50/см3).
Концентрация клеток за 48 ч изменилась с 0,5 до 1,9 млн/см3, то есть выросла в 3,8 раза (рис. 2).
На следующем этапе были проведены опыты по исследованию изменения титра инфекционной активности вируса бешенства в клетках ВНК-21/SUSP/ARRIAH, имеющих разную исходную концентрацию: (0,77 ± 0,1); (3,0 ± 0,2) и (1,1 ± 0,1) млн/см3. Установлено, что накопление цельных вирусных частиц в зараженных клетках разных концентраций происходило в первые 12 ч репродукции (рис. 3). В дальнейшем в культуре с исходной концентрацией клеток (0,77 ± 0,1) млн/см3 вирус накапливался в 1,1–1,2 раза интенсивнее. Вероятно, это связано с ограниченным количеством питательных веществ для размножения и роста клеток с большей концентрацией.
Провели исследование, направленное на изучение изменений фаз клеточного цикла при культивировании вируса бешенства в клетках суспензионной линии ВНК-21/SUSP/ARRIAH. В стандартных оптимальных условиях интактные популяции распределяются по фазам клеточного цикла следующим образом: G1 – 30–75%, G2 + M – 2–18%, S – 2–33%, полиплоиды – до 4% и дебрис – 1–20% [23].
Отмечено, что динамика изменений популяции клеток, находящихся в апоптозе, в контроле и опыте была аналогичной в течение 36 ч культивирования (наблюдали небольшой временной сдвиг в 3 ч между опытом и контролем через 9 и 12 ч репродукции). После 36 ч культивирования инфицированных клеток в стадии апоптоза было на 28–42% больше по сравнению с таковыми в контроле (рис. 4).
Доля клеток, находящихся в стадии фазы G1, через 9 ч в опытных образцах увеличилась на 11,7%, а в контрольных, наоборот, уменьшилась на 16,6%. В дальнейшем количество клеток в G1-фазе и в контроле, и в опыте изменялось одинаково: через 15–18 ч отмечалось уменьшение на 40%, далее – ростовой скачок на 45–46%, затем опять снижение на 39–40%, после чего вновь наблюдалось увеличение. После 33 ч репродукции и до окончания культивирования доля инфицированных клеток, находящихся в фазе G1, была значительно больше (на 12–21%), чем контрольных.
При сравнении количества клеток, находящихся в апоптозе + дебрисе и фазе G1, установили некоторую синхронность между этими фазами: через 9 ч культивирования вируса фаза G1 увеличилась на 10–12%, в то же время уменьшился на 10–11% апоптоз, после чего пошло снижение процента клеток в фазе G1 и увеличение доли клеток в апоптозе и дебрисе. Более выраженную зеркальность данных фаз клеточного цикла наблюдали после 24 ч культивирования. Аналогичная закономерность была замечена и при исследовании клеточного цикла при репродукции вируса ящура [22].
В клеточном цикле интактной популяции ВНК-21/SUSP/ARRIAH также преобладала диплоидная фаза клеточного цикла (G1), во время которой начинался синтез мРНК, структурных белков, других клеточных компонентов. На эту фазу приходилось от 30 до 75% клеток в зависимости от условий культивирования, что отражено в более ранних исследованиях [23].
Известно, что в период G1-фазы клетки начинают увеличиваться в размерах, активируется мРНК и ферменты, необходимые для будущей репликации ДНК [21].
Клетки, находящиеся в фазе G1, в суспензионной культуре поддерживались на уровне 37–70% на протяжении всего времени репродукции вируса, то есть инфицированные вирусом клетки служили источником энергии и материалом для синтеза вирусных компонентов, а также для сборки цельных вирионов.
Переход от диплоидной фазы G1 в синтетическую (S-фазу) является одной из контрольных точек клеточного цикла. В зависимости от количества питательных веществ и энергии, а также от внешних факторов культивирования клетка «принимает решение» вступать в клеточный цикл или же перейти в неделящееся состояние покоя, известное как G0-фаза, которая переходит в апоптоз. Основным событием S-фазы является репликация ДНК, которая имеет свои особенности [21].
В наших исследованиях процент клеток в S-фазе в опыте и контроле в первые сутки репродукции вируса был одинаковым, при этом наблюдали резкое его увеличение в виде скачков через 15 и 24 ч в 3,4 и 2,4 раза соответственно (рис. 5). Через 24 ч между инфицированными и контрольными клетками начали проявляться различия, которые постепенно возрастали с 8 до 137% к окончанию репродукции. Можно предположить, что клетки, находящиеся в этой фазе, также участвовали в репродукции вируса.
В фазе G2 – последней из трех последовательных фаз интерфазной стадии клеточного цикла – и М-фазе образовывалась тетраплоидная популяция. В интактных и инфицированных вирусом бешенства клетках линии ВНК-21/SUSP/ARRIAH на фазу подготовки к митозу и сам митоз приходилось от 2 до 20% всей популяции. Через 30 ч репродукции количество клеток опытных образцов в данных фазах начинало уменьшаться на 17–28% по сравнению с контрольными (рис. 6). Вероятно, это было связано с тем, что ингибировались общий биосинтез и функции клетки-хозяина в результате биосинтеза компонентов вируса бешенства, поэтому уменьшался процент клеток, находящихся в фазе G2 + M.
Количество полиплоидных клеток в опыте было примерно равным на протяжении 45 ч, только в последние часы репродукции вируса наблюдали их резкий скачок в 2,0–2,5 раза, в то время как в контрольных клетках плоидность популяции имела скачкообразный характер: увеличение через 9, 21, 42 и 48 ч в 2,06; 2,7; 1,56 и 3,18 раза соответственно. Можно предположить, что имелась частичная резистентность полиплоидных клеток к вирусу. Данный факт уже был отмечен раньше при исследовании репродукции ящура в клетках ВНК-21 [22].
ДНК-гистограммы клеток ВНК-21/SUSP/ARRIAH при репродукции в них вируса бешенства через 24 ч после начала заражения и через 42 ч культивирования (рис. 7) обобщают графики, представленные на рисунках 4–6.
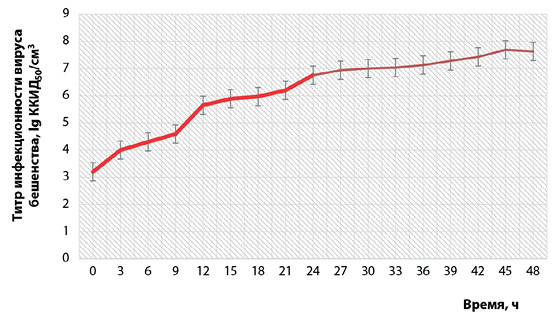
Рис. 1. Динамика уровня инфекционной активности вируса бешенства при репродукции в культуре клеток (n = 3, p < 0,05)
Fig. 1. Rabies virus infectivity dynamics during its reproduction in cell culture (n = 3, p < 0.05)

Рис. 2. Динамика изменения концентрации клеток ВНК-21/SUSP/ ARRIAH при репродукции вируса бешенства (n = 3, p < 0,05)
Fig. 2. BHK-21/SUSP/ARRIAH cell concentration dynamics during rabies virusreproduction (n = 3, p < 0.05)

Рис. 3. Динамика накопления вируса бешенства при репродукции в клетках с различной исходной концентрацией (n = 3, p < 0,05)
Fig. 3. Rabies virus accumulation dynamics during itsreproduction in cells with different initial concentrations (n = 3, p < 0.05)
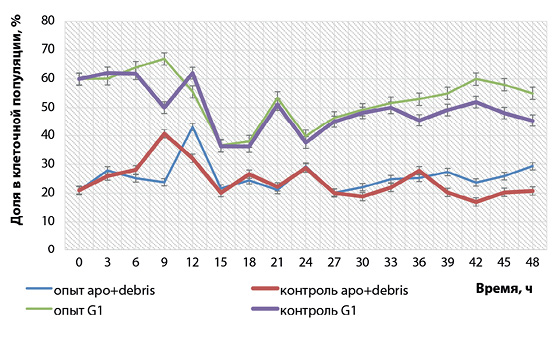
Рис. 4. Изменение процентного соотношения клеток, находящихся на стадиях апоптоза + дебриса и фазы G1, в культуре ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства (n = 3, p < 0,05)
Fig. 4. Changesin percentages of cells undergoing apoptosis + debris and G1 phase in ВНК-21/SUSP/ARRIAH culture during rabies virus reproduction (n = 3, p < 0.05)
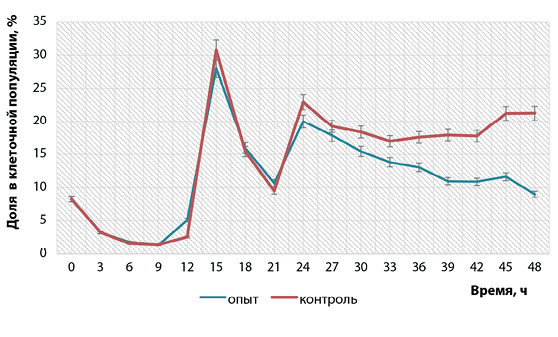
Рис. 5. Изменение процентного соотношения клеток, находящихся на стадии S-фазы, в культуре ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства (n = 3, p < 0,05)
Fig. 5. Changesin percentages of cells undergoing S phase in BHK-21/SUSP/ARRIAH culture during rabies virusreproduction (n = 3, p < 0.05)
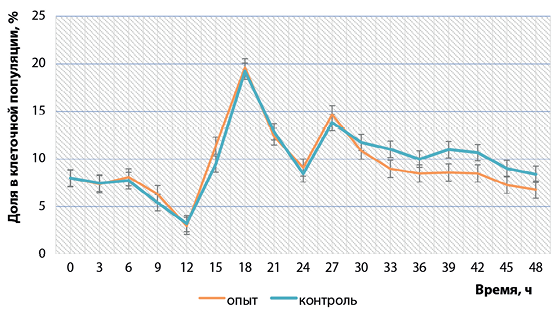
Рис. 6. Изменение процентного соотношения клеток, находящихся на стадии G2 + M, в культуре ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства (n = 3, p < 0,05)
Fig. 6. Changesin percentages of G2 + M phase cellsin ВНК-21/SUSP/ARRIAH culture during rabies virusreproduction (n = 3, p < 0.05)
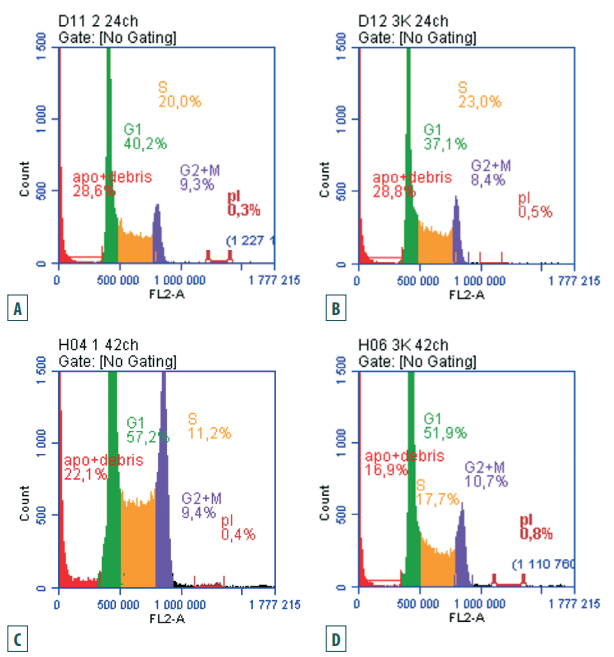
Рис. 7. Сравнение ДНК-гистограмм клеток ВНК-21/SUSP/ARRIAH при репродукции в них вируса бешенства и контрольных образцов через 24 ч (A – опыт, B – контроль) и через 42 ч (C – опыт, D – контроль)
Fig. 7. Comparison of DNA histograms of ВНК-21/SUSP/ARRIAH cells during rabies virusreproduction and those of controlsamples after 24 hours (A – test, B – control) and after 42 hours (C – test, D – control)
ЗАКЛЮЧЕНИЕ
Исследованы фазы клеточного цикла при репродукции в клетке-хозяине вируса бешенства, получены результаты, позволяющие оценить продолжительность и доминирование соответствующих фаз клеточного цикла G1, S, G2 + M на разных этапах культивирования.
При изучении динамики изменений, происходящих в ДНК инфицированных вирусом бешенства клеток линии ВНК-21/SUSP/ARRIAH, замечено, что через 24 ч культивирования вируса росло количество клеток в фазе G1 по сравнению с контролем (на 12–21%). Так как в фазе G1 идет синтез мРНК, структурных белков, других клеточных компонентов, которые необходимы и для сборки вирионов возбудителя бешенства, то рост клеток в данной фазе цикла можно считать закономерным.
Обнаружено, что поскольку главным событием фазы S является репликация ДНК, то линейное уменьшение фазы S при культивировании вируса бешенства после 24 ч репродукции также может указывать на перестройку клетки на синтез вирусной РНК, а не репликацию клеточной ДНК.
Выявлено, что фаза G2 и фаза M (постсинтетическая, или премитотическая, и сам митоз) жизненного цикла клеток опытных образцов относительно уменьшались (на 17–28%) по отношению к контрольным, то есть инфицированные клетки находились в стадии деления меньше, чем неинфицированные. Вероятно, это было связано с тем, что ингибировались общий биосинтез и функции клетки-хозяина в результате биосинтеза компонентов вируса бешенства.
Определено, что полиплоидные клетки, которые образовывались в процессе культивирования клеток и вируса, были частично резистентны к возбудителю бешенства и, вероятно, обладали наименьшей чувствительностью.
Установлено, что перестройка клеток ВНК-21/SUSP/ARRIAH на синтез полных частиц вируса бешенства наступала через 24 ч репродукции, о чем свидетельствуют изменения в фазах клеточного цикла клетки-хозяина, замедление прироста самой популяции клеток.
Список литературы
1. Сюрин В. Н., Самуйленко А. Я., Соловьев Б. В., Фомина Н. В. Вирусные болезни животных. М.: ВНИТИБП; 2001. 928 с.
2. Груздев К. Н., Метлин А. Е. Бешенство животных. Владимир: ФГБУ «ВНИИЗЖ»; 2019. 394 с. EDN: FCSNOH
3. Макаров В. В., Гулюкин А. М., Гулюкин М. И. Бешенство: естественная история на рубеже столетий. М.: ЗооВетКнига; 2015. 121 с. EDN: TXECJR
4. Макаров В. В., Лозовой Д. А., Брико Н. И. Бешенство рукокрылых и человек. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2015; 6: 46–53. EDN: VEAETL
5. Метлин А. Е. Современные аспекты классификации лиссавирусов. Ветеринария сегодня. 2017; (3): 52–57. EDN: ZIGAFP
6. Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. Под ред. Д. К. Львова. М.: Медицинское информационное агентство; 2013; 1200 с.
7. Bourhy H., Cowley J. A., Larrous F., Holmes E. C., Walker P. J. Phylogenetic relationships among rhabdoviruses inferred using the L polymerase gene. Journal of General Virology. 2005; 86 (10): 2849–2858. https://doi.org/10.1099/vir.0.81128-0
8. Albertini A. A. V., Schoehn G., Weissenhorn W., Ruigrok R. W. H. Structural aspects of rabies virus replication. Cellular and Molecular Life Sciences. 2008; 65 (2): 282–294. https://doi.org/10.1007/s00018-007-7298-1
9. Барабаш Е. Ю., Калинина Е. П., Гвозденко Т. А., Денисенко Ю. К., Новгородцева Т. П., Антонюк М. В., Ходосова К. К. Регуляция иммунного ответа у пациентов с частично контролируемой и контролируемой бронхиальной астмой. Медицинская иммунология. 2017; 19 (1): 65–72. https://doi.org/10.15789/1563-0625-2017-1-65-72
10. Войткова В. В. Изучение апоптоза методом проточной цитофлуориметрии (обзор литературы). Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2010; 6-1 (76): 220–225. EDN: OHWEVV
11. Ищенко И. О., Оппедизано М. Д. Л. Совершенствование оценки противоопухолевого иммунитета с использованием метода проточной цитометрии. Forcipe. 2019; 2 (4): 24–31. EDN: STCTRI
12. Козырева В. С., Шилова А. Н., Шкода О. С. Использование метода проточной цитометрии для контроля содержания остаточных лейкоцитов в плазме крови. Гематология и трансфузиология. 2019; 64 (1): 66–72. https://doi.org/10.35754/0234-5730-2019-64-1-66-72
13. Ягунов А. С., Карташев А. В., Токалов С. В., Киселева Л. Н. Основные этапы разработки и применения метода проточной цитометрии в ФГУ РНЦРХТ. Вопросы онкологии. 2008; 54 (4): 494–497. EDN: JVSUZB
14. Стахнёва Е. М., Рагино Ю. И. Современные методы исследования атеросклероза и ишемической болезни сердца: проточная цитометрия. Бюллетень сибирской медицины. 2021; 20 (2): 184–190. https://doi.org/10.20538/1682-0363-2021-2-184-190
15. Barnum K. J., O’Connell M. J. Cell cycle regulation by checkpoints. In: Cell Cycle Control. Methods in Molecular Biology. Eds. E. Noguchi, M. Gadaleta. 2014; 1170: 29–40. https://doi.org/10.1007/978-1-4939-0888-2_2
16. Манин Б. Л., Ночевный В. Т., Хайдуков С. В., Ласкавый В. Н. Эффективность метода проточной цитометрии в изучении механизмов репарации клеток ВНК-21 в процессе культивирования и криоконсервирования. Ветеринарна медицина. 2011; 95: 66–70. EDN: SMUJVJ
17. Sherman J., Wang R. Rapid profiling of G2 phase to mitosis progression by flow cytometry in asynchronous cells. Cell Cycle. 2020; 19 (21): 2897–2905. https://doi.org/10.1080/15384101.2020.1827510
18. Rieger A. M. Flow cytometry and cell cycle analysis: An overview. In: Cell-Cycle Synchronization. Methods in Molecular Biology. Еd. Z. Wang. 2022; 2579: 47–57. https://doi.org/10.1007/978-1-0716-2736-5_4
19. Kim K. H., Sederstrom J. M. Assaying cell cycle status using flow cytometry. Current Protocols in Molecular Biology. 2015; 111: 28.6.1–28.6.11. https://doi.org/10.1002/0471142727.mb2806s111
20. Nair A., Manohar S. M. A flow cytometric journey into cell cycle analysis. Bioanalysis. 2021; 13 (21): 1627–1644. https://doi.org/10.4155/bio-2021-0071
21. Клетки. Под ред. Б. Льюина, Л. Кассимериса, В. П. Лингаппы, Д. Плоппера. М.: БИНОМ. Лаборатория знаний; 2011. 951 с.
22. Гусева М. Н., Шевченко М. А., Михалишин Д. В., Михалишин В. В., Манин Б. Л. Изучение методом проточной цитометрии динамики трансформации ДНК в культуре клеток ВНК-21/2-17 при репродукции вируса ящура. Ветеринария сегодня. 2018; (4): 39–43. https://doi.org/10.29326/2304-196X-2018-4-27-39-43
23. Шевченко М. А., Гусева М. Н., Михалишин Д. В., Манин Б. Л., Шишкова А. А. Исследование клеточного цикла линии ВНК-21/2-17 методом проточной цитометрии. Ветеринария сегодня. 2017; (4): 58–62. EDN: YKWAND
24. Лозовой Д. А., Гусева М. Н., Михалишин Д. В., Доронин М. И., Манин Б. Л., Шишкова А. А. и др. ВНК-21/SUSP/ARRIAH – перевиваемая суспензионная сублиния клеток почки новорожденного сирийского хомячка, предназначенная для репродукции вирусов ящура, бешенства, парагриппа-3, болезни Ауески при производстве противовирусных вакцин, а также для изготовления диагностических и профилактических ветеринарных биопрепаратов. Патент № 2722671 С1 Российская Федерация, МПК С12N 5/10 (2006.01). ФГБУ «ВНИИЗЖ». № 2019131190. Заявл. 01.10.2019. Опубл. 02.06.2020. Бюл. № 16.
Об авторах
М. Н. ГусеваРоссия
Гусева Марина Николаевна, канд. биол. наук, старший научный сотрудник лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
М. И. Доронин
Россия
Доронин Максим Игоревич, д-р биол. наук, ведущий научный сотрудник лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
М. А. Шевченко
Россия
Шевченко Максим Александрович, ведущий ветеринарный врач лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Д. В. Михалишин
Россия
Михалишин Дмитрий Валерьевич, д-р вет. наук, заведующий лабораторией профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
А. В. Борисов
Россия
Борисов Алексей Валерьевич, канд. вет. наук, начальник отдела лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Ю. С. Елькина
Россия
Елькина Юлия Сергеевна, канд. вет. наук, младший научный сотрудник лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Т. В. Оковытая
Россия
Оковытая Татьяна Владимировна, канд. биол. наук, старший научный сотрудник лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
В. М. Захаров
Россия
Захаров Валерий Михайлович, д-р вет. наук, профессор
мкр. Юрьевец, г. Владимир, 600901
Author ID: 7402991265
В. В. Михалишин
Россия
Михалишин Валерий Васильевич, д-р вет. наук, профессор, главный научный сотрудник информационно-аналитического центра
мкр. Юрьевец, г. Владимир, 600901
Рецензия
Для цитирования:
Гусева М.Н., Доронин М.И., Шевченко М.А., Михалишин Д.В., Борисов А.В., Елькина Ю.С., Оковытая Т.В., Захаров В.М., Михалишин В.В. Исследование методом проточной цитометрии динамики трансформации ДНК в культуре клеток ВНК-21/SUSP/ARRIAH при репродукции вируса бешенства. Ветеринария сегодня. 2024;13(1):87-94. https://doi.org/10.29326/2304-196X-2024-13-1-87-94
For citation:
Guseva M.N., Doronin M.I., Shevchenko M.A., Mikhalishin D.V., Borisov A.V., El’kina Yu.S., Okovytaya T.V., Zakharov V.М., Mikhalishin V.V. Flow cytometry study of DNA transformation dynamics in ВНК-21/SUSP/ARRIAH cell culture during rabies virus reproduction. Veterinary Science Today. 2024;13(1):87-94. https://doi.org/10.29326/2304-196X-2024-13-1-87-94
JATS XML



































