Перейти к:
Изучение серотипоспецифичности диагностических тест-систем для выявления антител к структурным белкам вируса ящура иммуноферментным анализом
https://doi.org/10.29326/2304-196X-2024-13-1-44-56
Аннотация
При изучении серотипоспецифичности 24 диагностических иммуноферментных тест-систем для определения антител к структурным белкам вируса ящура 6 производителей (ФГБУ «ВНИИЗЖ», Prionics, IZSLER, Innovative Diagnostics, BIONOTE и MEDIAN Diagnostics) было исследовано 138 образцов сыворотки крови свиней и крупного рогатого скота, вакцинированных против ящура одного или двух серотипов либо инфицированных вирусом ящура. Все использованные тест-системы наряду с ярко выраженной серотипоспецифической активностью (гомологичная реакция) выявляли также некоторое количество перекрестно-реагирующих вирусоспецифических антител, что было обусловлено рядом причин, связанных с консервативными эпитопами в аминокислотной последовательности капсидных полипептидов VP1–VP3 вириона возбудителя ящура, с доступностью внутренних консервативных эпитопов полипептида VP4 для иммунной системы животного при репликации вируса или деструкции вакцинного антигена (вируса) в организме животного в ходе иммунного процесса, а также с компонентным составом экспериментальной противоящурной вакцины и др. Тем не менее анализ большого массива данных (около 3500 исследований) показал, что гомологичная серотипоспецифическая реакция в целом была значительно выше и являлась доминирующей, доля вирусоспецифических незащитных антител, в том числе и перекрестно-реагирующих, была не столь значительной и не искажала результаты оценки иммуногенности противоящурной вакцины в иммуноферментном анализе. В сомнительных случаях требуется подтверждение результатов в других серологических реакциях. Оптимальным вариантом следует считать комплексные исследования на ящур с привлечением разных методов диагностики, таких как иммуноферментный анализ с использованием стандартных и референтных тест-систем и/или реакция вирусной нейтрализации в культуре клеток.
Для цитирования:
Луговская Н.Н., Силантьева Е.А., Оковытая Т.В., Харитонова А.А., Гочмурадов Ы.М., Разгуляева Е.А., Будина О.О., Яснева Е.А. Изучение серотипоспецифичности диагностических тест-систем для выявления антител к структурным белкам вируса ящура иммуноферментным анализом. Ветеринария сегодня. 2024;13(1):44-56. https://doi.org/10.29326/2304-196X-2024-13-1-44-56
For citation:
Lugovskaya N.N., Silanteva E.A., Okovytaya T.V., Kharitonova A.A., Gochmuradov Y.M., Razgulyaeva E.A., Budina O.O., Yasneva E.A. Testing of diagnostic test-systems for detection of antibodies to foot-and-mouth disease virus structural proteins with enzyme-linked immunosorbent assay for their serotype specificity. Veterinary Science Today. 2024;13(1):44-56. https://doi.org/10.29326/2304-196X-2024-13-1-44-56
ВВЕДЕНИЕ
Ящур – одна из самых известных с давних времен высококонтагиозных вирусных болезней домашних и диких парнокопытных животных, последствия которой могут наносить колоссальный экономический, социальный, экологический ущерб. Заболевание вызывается афтовирусом семейства Picornaviridae и сопровождается лихорадкой, развитием афтозных поражений слизистой и эпителиальной тканей животных и другими симптомами инфекции. Существуют 7 серотипов вируса ящура, отличающихся иммунологическими свойствами: О, А, С, SAT 1, SAT 2, SAT 3 и Asia 1 [1][2].
Одним из самых важных способов борьбы с ящуром, наряду с другими путями контроля над инфекцией, является специфическая вакцинация. Поскольку вирус разных серотипов практически не вызывает перекрестного иммунитета и при использовании вакцин на основе штаммов возбудителя, отличных от полевых, даже в рамках одного серотипа защита может быть слабой, при разработке вакцинных препаратов необходим тщательный подбор штаммов для обеспечения максимально возможной защиты поголовья от ящура в конкретном регионе [1][2].
При оценке эффективности вакцины, иммунного фона и напряженности противоящурного иммунитета у восприимчивых животных в лабораторной диагностике используют два основных метода исследования образцов сыворотки крови на наличие антител к структурным белкам вируса ящура: реакцию нейтрализации вируса (РН) и иммуноферментный анализ (ИФА) [1][2].
Реакция нейтрализации вируса ящура считается по праву золотым стандартом, поскольку позволяет выявлять непосредственно вируснейтрализующие антитела в сыворотке крови вакцинированных или переболевших животных, тем самым определяя уровень защиты против ящура определенного серотипа.
Иммуноферментный анализ, основанный на использовании в реакции инактивированного цельновирусного или рекомбинантного антигена, охватывает весь спектр вирусоспецифических антител, в первую очередь вируснейтрализующих, что обусловлено строением вириона. Это позволяет использовать ИФА для диагностики ящура в лабораторной практике наряду с РН как альтернативный или подтверждающий метод.
Однако в своих исследованиях мы не раз отмечали наличие перекрестно-реагирующих антител в сыворотке крови вакцинированных против ящура или переболевших ящуром животных, что обнаруживалось с помощью тест-систем для разных серотипов возбудителя. Данное явление в серологических реакциях также было описано другими исследователями [3-5]. Природа его не совсем ясна и требует изучения.
Вирион является безоболочечным и представляет собой капсид, окружающий РНК-геном. Капсид, имеющий структуру икосаэдра с коэффициентом седиментации 146S, сформирован из 60 копий протомерной субъединицы, состоящей из четырех структурных белков VP1–VP4. В процессе репликации вируса образуются также промежуточные формы: пустой, лишенный нуклеиновой кислоты капсид 75S, пентамеры 12S и протомеры 5S. При деградации капсид также, вероятно, может распадаться на отдельные субъединицы. Поверхностные белки VP1–VP3 несут эпитопы, отвечающие за серотипоспецифичность вируса ящура и выработку вируснейтрализующих антител, в то время как внутренний белок VP4 более консервативен у разных серотипов возбудителя и антитела против эпитопов VP4 не обеспечивают защиту от инфекции [3][6].
Одной из причин перекрестной реакции антител между серотипами может быть доступность для иммунной системы животного внутренних консервативных эпитопов при определенном количестве 12S и 5S субъединиц наряду с интактным антигеном (капсидным антигеном с неизмененной структурой) в вакцинном материале или присутствие промежуточных форм при репликации вируса ящура в момент инфекции. Другой вероятной причиной может служить наличие консервативных эпитопов в аминокислотной последовательности поверхностных белков капсида (VP1–VP3). В пользу последнего предположения говорит обнаружение вируснейтрализующих антител с перекрестной реактивностью в РН, что может также свидетельствовать и о некоторой степени защиты между разными серотипами [4][5].
В данной работе была сделана попытка объяснить природу перекрестной реакции в ИФА, а также оценить влияние данного явления на возможность серотипирования поствакцинальных и постинфекционных антител в сыворотке крови свиней и крупного рогатого скота (КРС). Для этой цели была сформирована моноспецифическая панель, включающая экспериментальные образцы сыворотки крови, отобранной от инфицированных или однократно иммунизированных противоящурной вакциной на основе одного штамма вируса ящура свиней и КРС. Параллельное тестирование проводилось с использованием коммерческих наборов для выявления антител к структурным белкам вируса ящура в ИФА разных производителей: ФГБУ «ВНИИЗЖ» (Россия), Prionics (Нидерланды/Швейцария), IZSLER & The Pirbright Institute (Италия/Великобритания), Innovative Diagnostics (Франция), BIONOTE (Республика Корея), MEDIAN Diagnostics (Республика Корея). Наборы производства ФГБУ «ВНИИЗЖ» представляют собой штаммоспецифические поликлональные тест-системы на основе жидкофазного блокирующего варианта ИФА, наборы иностранных производителей являются серотипоспецифическими моноклональными конкурентными тест-системами.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследований служили архивные образцы сыворотки крови свиней и КРС, инфицированных вирусом ящура серотипов SAT 2 или О либо привитых противоящурной моновалентной или бивалентной вакциной. До исследования образцы хранились при температуре минус 20 °С. Моноспецифическая панель включала 81 образец сыворотки крови: 8 – от переболевших и 73 – от вакцинированных животных (к серотипам А – 25, О – 31, Asia 1 – 17 образцов сыворотки крови), а также 57 образцов сыворотки крови, отобранной от свиней, иммунизированных экспериментальной бивалентной эмульсионной вакциной против ящура серотипов А и О, до и после контрольного заражения вирусом серотипа О. Сыворотку исследовали в ИФА и отдельные образцы – в РН.
Два образца экспериментальной эмульсионной вакцины с разной концентрацией антигена вируса ящура штаммов О 2212/Приморский/2014 и А 2155/Забайкальский/2013 тестировали на подсвинках. Контрольные испытания проводили согласно рекомендациям Всемирной организации здравоохранения животных (ВОЗЖ) [2]. Для проведения эксперимента было сформировано две группы свиней по 15 гол. в каждой. Животных иммунизировали подкожно в объеме 2,0 см3 (1 доза) вакциной, содержащей разное количество антигена: в цельном виде, в разведениях 1:5 и 1:25 (по 5 животных на разведение в каждой группе). Еще 2 невакцинированные особи служили контролем. На 21-е сут после иммунизации у всех животных отбирали кровь для серологических исследований и проводили контрольное заражение афтозным вирусом ящура штамма О 2212/Приморский/2014 в дозе 104 ИД50/0,2 см3. Учет результатов контрольного заражения и отбор крови производили на 8-е сут после инокуляции.
Все эксперименты на животных проводились в строгом соответствии с межгосударственным стандартом по содержанию и уходу за лабораторными животными ГОСТ 33215-2014, принятым Межгосударственным советом по стандартизации, метрологии и сертификации, а также согласно требованиям Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
В работе использовали тест-системы на основе жидкофазного блокирующего варианта ИФА для обнаружения антител к структурным белкам вируса ящура разных штаммов типов А, О, Asia 1 (табл. 1), разработанные в ФГБУ «ВНИИЗЖ», в соответствии с инструкцией по применению, а также коммерческие наборы для обнаружения антител к вирусу ящура типов А, О или Asia 1 ведущих европейских и азиатских производителей в соответствии с рекомендациями к набору:
– PrioCHECK® FMDV Type A (Prionics, Нидерланды/Швейцария);
– PrioCHECK® FMDV Type O (Prionics, Нидерланды/Швейцария);
– PrioCHECK® FMDV Type Asia 1 (Prionics, Нидерланды/Швейцария);
– SPCE for antibodies specific to FMDV Serotype A (IZSLER & The Pirbright Institute, Италия/Великобритания);
– SPCE for antibodies specific to FMDV Serotype O (IZSLER & The Pirbright Institute, Италия/Великобритания);
– ID Screen® FMD Type A Competition (Innovative Diagnostics, Франция);
– ID Screen® FMD Type O Competition (Innovative Diagnostics, Франция);
– ID Screen® FMD Type Asia1 Competition (Innovative Diagnostics, Франция);
– FMD Type O Ab ELISA (BIONOTE, Республика Корея);
– VDPro® FMDV Type O Ab b-ELISA (MEDIAN Diagnostics, Республика Корея).
Результаты реакции интерпретировали в соответствии со значением процента ингибиции (PI), определенным для каждого исследуемого образца по формуле и критериям оценки, установленными производителем. Для удобства восприятия большого массива данных результаты, полученные в ходе реакции с использованием наборов, предусматривающих выражение значений оптической плотности через отношение SN (Innovative Diagnostics – IDVet, MEDIAN), также пересчитывали в значение PI.
Антиген вируса ящура серотипировали в реакции непрямого «сэндвич»-варианта ИФА с использованием в качестве улавливающих и детекторных антител гипериммунной сыворотки крови кролика и морской свинки соответственно, полученной против интактного капсидного антигена одного из штаммов вируса ящура (146S-AГ), как описано ранее, с некоторыми модификациями [2][7]. Для постановки реакции 96-луночные планшеты для ИФА (NUNC, Дания) сенсибилизировали раствором штаммоспецифической сыворотки крови кролика (серотипы ящура А, О, Asia 1 или SAT 2) в 0,05М карбонатно-бикарбонатном буфере с рН 9,6. Затем осуществляли последовательные этапы внесения в лунки планшета образцов тестируемого или контрольного антигена, детекторных антител (штаммоспецифическая сыворотка крови морской свинки соответствующего серотипа) и антивидового иммунопероксидазного конъюгата, разведенных в 0,01М трис-буферном солевом растворе с 0,001% детергента Tween 20, содержащем 10% фетальной сыворотки КРС. Все этапы реакции выполняли в течение 1 ч при температуре 37 °С и заканчивали промыванием лунок планшета для удаления несвязавшихся компонентов. Реакцию визуализировали с помощью хромогенного субстрата ABTS (2,2’-азино-ди(3-этилбензотиазолин-6-сульфоновая кислота) за 20 мин при комнатной температуре, останавливали реакцию 1%-м додецилсульфатом натрия.
Также серотипирование образцов интактного антигена вируса ящура проводили в реакции прямого варианта ИФА, в ходе которого антиген, адсорбированный в лунках планшета, выявляли с помощью коммерческих пероксидазных конъюгатов с серотипоспецифическими моноклональными антителами производства фирм Prionics, IZSLER, Innovative Diagnostics, BIONOTE, MEDIAN Diagnostics. Условия проведения реакции были аналогичны реакции «сэндвич»-варианта ИФА.
Значения оптической плотности исследуемых образцов, в 2,5 раза превышавшие значения оптической плотности контроля конъюгата (контроля фона) в обеих реакциях, считали положительными.
Реакцию нейтрализации вируса ящура проводили в перевиваемой линии клеток почки свиньи IB-RS-2 в соответствии с рекомендациями ВОЗЖ [2]. Постановку РН осуществляли микрометодом с использованием 96-луночных плоскодонных культуральных планшетов. К двукратным разведениям исследуемых и контрольных образцов сыворотки крови на питательной среде Игла МЕМ добавляли примерно 102 ТЦД50/0,05 см3 (тканевая цитопатическая доза вируса, вызывающая гибель 50% клеток) вируса, допустимый диапазон 101,5–102,5 ТЦД50/0,05 см3. Затем после инкубирования в течение 1 ч при температуре 37 °С в присутствии 5% СО2 в каждую лунку планшета вносили по 0,05 см3 суспензии культуры клеток IB-RS-2 в концентрации 106 кл./см3, инкубировали в тех же условиях в течение 48–78 ч. Реакцию учитывали по мере развития цитопатического действия вируса (ЦПД) в контрольных лунках с зараженной культурой клеток без сыворотки крови от исследуемых животных. За титр вируснейтрализующих антител (ВНА) принимали последнее разведение сыворотки, тормозящее на 50% ЦПД вируса [2].
Выравнивание аминокислотных последовательностей белка VP1 вируса ящура разных серотипов выполняли согласно информации, полученной из NCBI и опубликованной в открытой печати [6][8-15]:
– A (A/TAN/26/2013); GenBank: AXI68858.1;
– A (A22/IRQ/24/64); GenBank: ARO74643.1;
– A (A/TUR/2/2014); GenBank: QWL55674.1;
– A (A/TUR/2006); GenBank: ACC63168.1;
– A (A/PAK/2013); GenBank: APZ88528.1;
– O (wild type of type O FMDV); PDB: 7ENP_1;
– O (O/TUR/33/2011); GenBank: QWL56951.1;
– O (O/PAK/2019); GenBank: UFI08025;
– Asia1 (Asia1/BAN/DH/Sa-319/2018); GenBank: QED10746.1;
– Asia1 (Asia1/284-3/4_ISB/Pak_2012); GenBank: APZ88631.1;
– Asia1 (Asia1/Shamir/89); GenBank: ASV50713.1;
– C1 (C1/Loupogne BEL/53); GenBank: AAA91488.1;
– SAT2 (SAT2/LIB/2012); GenBank: AFU55197.1;
– SAT2 (SAT2/EGY/Ismailia/2018); GenBank: QZE50286.1.
Электрофоретическое разделение белков в полиакриламидном геле проводили, как описано ранее [16, 17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Серотипоспецифичность 24 иммуноферментных тест-систем для обнаружения антител к структурным белкам вируса ящура разных производителей изучали, исследуя панель образцов моноспецифической сыворотки крови свиней и КРС. Наборы для диагностики ящура ведущих иностранных производителей, таких как Prionics, IZSLER, Innovative Diagnostics, BIONOTE и MEDIAN Diagnostics, основаны на реакции прямого конкурентного варианта ИФА. За специфическое связывание с вирусным или рекомбинантным антигеном борются иммуноглобулины в сыворотке крови и моноклональные антитела, конъюгированные с пероксидазой хрена. Наборы производства ФГБУ «ВНИИЗЖ» представляют собой специфические и неспецифические компоненты для проведения реакции непрямого жидкофазного блокирующего варианта ИФА. Данный вариант для определения антител к структурным белкам вируса ящура является разновидностью конкурентного варианта ИФА и отличается наличием предварительного этапа взаимодействия антигена вируса ящура с исследуемой сывороткой («жидкая фаза»), в процессе которого происходит блокирование иммунодоминантных эпитопов в аминокислотной последовательности антигена вируса ящура специфическими иммуноглобулинами. Остальные этапы реакции в целом аналогичны другим вариантам ИФА. Конкурирующими антителами выступают гомологичные штаммоспецифические поликлональные антитела в сыворотке крови морской свинки (детекторные антитела), связывающиеся со свободными антигенными детерминантами [2][18-20].
Как видно на рисунке 1, ни одна из представленных тест-систем не обладала 100%-й серотипоспецифичностью при исследовании образцов сыворотки крови животных, полученной на 21–28-й день после вакцинации противоящурной моновакциной из штаммов, указанных в таблице 1. Реакция с гомологичными сыворотками была преобладающей, однако количество перекрестно-реагирующих образцов оказалось значительным.
Степень перекрестной реакции антител также оценивали при тестировании 6 образцов сыворотки крови от переболевших ящуром серотипа SAT 2 свиней и КРС (табл. 2).
Анализ полученных результатов показал, что большинство использованных тест-систем зарегистрировали наличие перекрестно-реагирующих антител в сыворотке крови животных через 21–31 день после заражения штаммом SAT2/ERI/98 вируса ящура. При этом уровень перекрестной реакции был значительно ниже, чем в тест-системе SAT2/LIB/12-ВНИИЗЖ: все 6 образцов показали положительный результат с PIсред. = 97,6%. Четыре моноклональных тест-системы A-PrioCHECK, O-PrioCHECK, O-IZSLER и Asia1-IDVet не обнаружили противовирусных антител у переболевших животных. Однако при исследовании 2 образцов сыворотки крови от контрольных свиней, инфицированных суспензией афтозного вируса ящура серотипа О при испытании вакцины, одно животное из двух оказалось серопозитивным в гетерологичной тест-системе A-PrioCHECK (табл. 3).
В опыте по испытанию бивалентной эмульсионной вакцины против ящура из штаммов А 2155/Забайкальский/2013 и О 2212/Приморский/2014 также наблюдали перекрестную реакцию у свиней после заражения вирусом штамма О 2212/Приморский/2014 (табл. 3). Шесть гетерологичных тест-систем для серотипов Asia 1 и SAT 2 обнаруживали в слабой степени либо не обнаруживали перекрестного реагирования с серотипами А и О, тем не менее после заражения только два набора (Asia1-PrioCHECK и Asia1-IDVet) не выявили никаких противоящурных антител в сыворотке крови ни у вакцинированных, ни у контрольных животных. При исследовании сывороток крови в тест-системах для серотипа А наблюдали любопытную зависимость: увеличилось количество серопозитивных животных и значительно возрос уровень антител через 8 дней после заражения ящуром серотипа О по сравнению с уровнем до заражения, однако среднее значение PI по группе было ниже, чем у контрольных (невакцинированных) животных. Это может быть свидетельством частичной нейтрализации вируса серотипа О антителами против вирусного антигена серотипа А, то есть перекрестной защиты. Данный факт подтверждался результатами РН вируса ящура штамма А 2155/Забайкальский/2013. Как видно из таблиц 3 и 4, число положительно реагирующих в РН на серотип А животных до и после заражения осталось неизменным, однако выделить долю перекрестно-реагирующих вируснейтрализующих антител (ВНА) не представлялось возможным, поскольку животные были вакцинированы против серотипа А. Но образцы сыворотки крови от контрольных животных обнаруживали данную категорию вирусоспецифических антител и имели титр ВНА защитного уровня 1:45 или 1,65 lg, как и в реакции с вирусом штамма Азия-1 2356/14/Пакистан/2018.
После инокуляции афтозного вируса генерализованной формой ящура заболело по одному животному, иммунизированному вакциной в разведении 1:25, в обеих группах свиней. При этом данные особи до заражения при исследовании в ИФА не имели антител к антигену вируса ящура серотипа А, а в тест-системах для серотипа О, кроме тест-систем ФГБУ «ВНИИЗЖ» для штаммов О 2356/Пакистан/2018, О 2311/Забайкальский/2016, О 2047/Саудовская Аравия/2008, О/Ке- ния/2017, отмечали пороговый уровень антител. Титр ВНА в данных образцах сыворотки крови к вирусу ящура штаммов А 2155/Забайкальский/2013 и О 2212/Приморский/2014 был равен 1,08 и 0,78 lg соответственно, что ниже уровня защиты (данные не показаны). В то же время тестирование образцов сыворотки крови от зараженных контрольных свиней в 22 из 24 тест-систем ИФА и в 7 из 14 реакций нейтрализации, как гомологичных для серотипа О, так и гетерологичных, показало положительный результат (табл. 3 и 4).
В наших исследованиях был установлен и неоднократно подтвержден факт наличия перекрестно-реагирующих антител в ИФА и в меньшей степени – в РН. Причин, на наш взгляд, может быть несколько:
– наличие консервативных эпитопов в аминокислотной последовательности капсидных полипептидов VP1–VP3;
– доступность внутренних консервативных эпитопов полипептида VP4 для иммунной системы животного вследствие наличия субъединиц 12S и 5S в вакцинном материале, при репликации вируса или деградации вакцинного антигена (вируса) в организме животного в ходе иммунного процесса.
Диагностические наборы, использованные в работе, имели свои отличительные особенности. В первую очередь это касается происхождения конкурентных антител. Тест-системы иностранных производителей (Prionics, IZSLER, Innovative Diagnostics, BIONOTE и MEDIAN Diagnostics) используют для конкуренции моноклональные антитела, ФГБУ «ВНИИЗЖ» изготавливает наборы на основе поликлональных антител. В любом варианте основной целью разработчиков тест-систем является серотипоспецифичность, за которую отвечают поверхностные капсидные эпитопы. Для решения этой задачи иммунизацию лабораторных животных, доноров антител, производят интактным антигеном вируса ящура, в основной массе состоящего из 146S субъединиц. При получении гипериммунной поликлональной сыворотки крови кроликов и морских свинок для изготовления улавливающих и детекторных антител соответственно в ФГБУ «ВНИИЗЖ» используют высокоочищенный антиген вируса ящура, фракционированный в градиенте плотности сахарозы, представляющий собой цельные капсиды, не разделенные на более мелкие субъединицы. Таким образом, вероятность выработки антител к внутренним высококонсервативным эпитопам мала. Однако, как свидетельствуют публикации ряда исследователей, и поверхностные полипептиды обнаруживают консервативные антигенные детерминанты, индуцирующие образование вируснейтрализующих антител с перекрестной реактивностью [4][5].
He Y. et al. [4], используя метод выделения В-клеточных антител, изолировали от КРС и идентифицировали перекрестно-реагирующие нейтрализующие антитела (NAb) серотипа O/A (R50), а также определили структуру комплекса FMDV-NAb с помощью криоэлектронной микроскопии. Показано, что R50 захватывали капсиды как FMDV-O, так и FMDV-A и связывались с BC/EF/GH-loop полипептида VP1 и c GH-loop полипептида VP3, выявляя ранее неизвестный антигенный сайт. Перекрестный эпитоп, распознаваемый R50, высококонсервативен среди серотипов O/A.
Для иллюстрации данного утверждения были проанализированы 14 аминокислотных последовательностей, включающих до 214 а. о., одного из поверхностных белков вируса ящура VP1 разных серотипов с целью определить потенциальную вероятность наличия консервативных эпитопов [9-17]. Выравнивание последовательностей проводили относительно вируса ящура штамма A/TAN/26/2013 (GenBank: AXI68858.1). Как видно из рисунка 2, такая вероятность существует, так как обнаруживаются консервативные участки с минимальным количеством замен.
Иммуногенность предполагаемых эпитопов поверхностных полипептидов оценивали в антигенных вариантах ИФА при серотипировании интактного антигена разных штаммов вируса ящура: в «сэндвич»-варианте ИФА с поликлональными улавливающими и детекторными антителами, прямом варианте ИФА с моноклональными антителами, конъюгированными с пероксидазой хрена (табл. 5 и 6).
Как показывает анализ полученных данных, при использовании как поликлональных, так и моноклональных антител наблюдали четкое серотипирование интактного антигена вируса ящура в концентрации 0,025 мг/мл в большинстве реакций ИФА. В двух случаях обнаружили перекрестную реакцию в прямом варианте с конъюгатами А-IZSLER (антиген серотипа SAT2/LIB/12) и A-IDVet (антигены серотипа Asia 1), что с учетом перекреста в РН подтверждало, на наш взгляд, предположение о наличии консервативных эпитопов в составе поверхностных полипептидов. Вероятно, данные эпитопы обладают меньшей иммуногенностью по сравнению с loop-участками (рис. 2) ввиду их расположения на поверхности капсида. Выступающие loop-участки аминокислотной последовательности формируют первичный иммунный ответ. Уровень перекрестной реактивности антител у переболевших животных был значительно ниже как в ИФА, так и в РН по сравнению с гомологичным (серотипоспецифическим) ответом (табл. 2, 3 и 4), аналогичную картину наблюдали в ИФА и у вакцинированных животных (рис. 1).
Проведенные исследования позволяют сделать вывод, что для серотипирования противоящурных антител в сыворотке крови инфицированных животных необходимо проведение параллельных исследований в тест-системах для разных серотипов ящура. Серотип должен определяться по доминирующему результату. При изучении поствакцинального иммунитета уровень перекрестно-реагирующих антител не имеет значения, поскольку данная категория антител, независимо от причины их появления, является вирусоспецифической и свидетельствует о состоянии иммунной системы животного. Степень защиты животного от инфекции прямо пропорциональна общему количеству вирусоспецифических антител, среди которых преобладают вируснейтрализующие антитела в силу особенностей строения вириона ящура.
В таблице 7 отражены результаты оценки реагирования организма двух животных (КРС № 1 и 2) на введение экспериментальной моновакцины против ящура на основе штамма Азия-1 1946/Shamir/Израиль/3/89. Клинически здоровые одновозрастные бычки при одинаковом режиме содержания демонстрировали особенности в развитии иммунного ответа. Если на 14-й день после вакцинации оба животных при исследовании в ИФА имели реакцию практически только на серотип Asia 1, то на 23-й день после вакцинации в сыворотке крови КРС № 1 обнаруживали антитела также с помощью 7 из 8 тест-систем для серотипа А и 3 из 10 – для серотипа О, в то время как сыворотка крови животного № 2 сохранила серотипоспецифичность. При этом уровень специфических антител против ящура серотипа Asia 1 у обоих животных был одинаковым. Это можно объяснить разной скоростью иммунного процесса в организме бычков, способного спровоцировать деструкцию введенного вакцинного антигена. По нашим наблюдениям, как правило, на 21-й день после вакцинации уровень гуморального иммунитета достигает пика и выходит на плато, с течением времени (период наблюдения: 14–45 дней после вакцинации) количество серотипоспецифических антител практически не изменяется или изменения несущественны, а перекрестно-реагирующие антитела имеют устойчивую динамику (данные не показаны).
В случае если для иммунизации используется антиген с нарушенной по разным причинам структурой, можно получить масштабную перекрестную реакцию вирусоспецифических антител, затрудняющую серотипирование в ИФА.
Так, сыворотка крови КРС, отобранная на 21-й день после вакцинации против ящура препаратом на основе штамма O 2620/Оренбургский/2021, демонстрировала сильную перекрестную реакцию в 11 из 13 тест-систем для обнаружения антител к структурным белкам вируса ящура серотипа А, Asia 1 или SAT 2, сопоставимую с гомологичной реакцией, в двух других тест-системах (A-PrioCHECK, Asia1-PrioCHECK) ответ был слабый (табл. 7). В данном случае перекрестная реактивность была вызвана нарушением целостности капсидного антигена, что вызвало образование большого количества антител против внутренних консервативных эпитопов полипептида VP4.
При электрофоретическом анализе антигенного материала, использованного для приготовления экспериментального образца вакцины, был установлен факт расщепления молекул структурных полипептидов VP1–VP3. Для сравнения приведен образец полноценного 146S-АГ вируса ящура штамма Азия-1 2145/Таджикистан/2011 (интактный антиген) – дорожка 1 (рис. 3).
Однако количество ВНА 2,70 lg (титр ВНА – 1:512), определенное в РН вируса ящура штамма O 2620/Оренбургский/2021, было достаточным для защиты от инфекции (табл. 8). При исследовании данной сыворотки крови на перекрестную вируснейтрализующую активность в РН наблюдали нейтрализацию вируса ящура штамма А 2155/Забайкальский/2013 до конечного разведения сыворотки 1:128 (2,10 lg). В то же время тестирование в РН сыворотки крови КРС против штамма О 2356/Пакистан/2018 также показало межтиповую нейтрализацию вируса ящура штамма SAT2/LIB/39/2012 на значимом уровне (1,65 lg).
Таким образом, измененная структура вакцинного антигена не помешала формированию иммунного ответа, однако могла стать препятствием для оценки защитных свойств вакцины в ИФА.
Тем не менее при промышленном производстве вакцины такие случаи должны быть исключены, поскольку строго контролируется компонентный состав вакцины. Этот пример был использован для лучшего понимания возможных причин возникновения перекрестной реакции в ИФА.
Результаты проведенных нами исследований перекликаются с опубликованными данными Института Пирбрайта (Великобритания) [3]. При исследовании 294 моновалентных сывороток крови, в основном бычьих, собранных после заражения, вакцинации или прививки и инфицирования одним из пяти серотипов ящура, более половины из образцов, представляющих все три категории иммунизации, показали положительный результат по крайней мере на один гетерологичный серотип, а некоторые имели положительный результат на все протестированные серотипы. Предварительные исследования со стабилизированными рекомбинантными капсидными антигенами серотипов О и А, которые не выявляли внутренние эпитопы, обнаруживали сниженную перекрестную реактивность образцов сыворотки крови, что подтверждало гипотезу о влиянии целостности капсида на серотипоспецифичность SP-ELISA. Остаточная перекрестная реактивность, связанная с поверхностными эпитопами капсида, соответствовала нейтрализации вируса перекрестного серотипа.
Таблица 1
Штаммы вируса ящура, использованные в наборах производства ФГБУ «ВНИИЗЖ», в реакции вирусной нейтрализации и/или для получения моноспецифической сыворотки крови
Table 1
FMD virus strains used in the test-kits produced by the Federal Centre for Animal Health for virus neutralization tests and/or for monospecific serum preparation
Тип вируса ящура | Название производственного штамма вируса ящура | Краткое обозначение штамма | Топотип | Генетическая линия |
A | А 2155/Забайкальский/2013 | A/Zab/13 | ASIA | Sea-97 |
A 2029/Турция/2006 | A/TUR/06 | ASIA | Iran-05 | |
А 2269/ВНИИЗЖ/2015 | A/ARRIAH/15 | ASIA | G-VII | |
А22/Ирак/24/64 | A22/IRQ/64 | ASIA | Iraq-64 | |
А/Танзания/2013 | A/TAN/13 | AFRICA | G-1 | |
O | O 2047/Саудовская Аравия/2008 | O/SAU/08 | ME-SA | PanAsia2 |
О 2356/Пакистан/2018 | O/PAK/18 | ME-SA | PanAsia2 | |
О 2212/Приморский/2014 | O/Prim/14 | SEA | Mya-98 | |
O1/Маниса/Турция/1993 | O1/Manisa/93 | SEA | Mya-98 | |
O1/Campos/1994 | O1/Campos/94 | EURO-SA | – | |
О 2344/Монголия/2017 | O/MOG/17 | ME-SA | Ind 2001 | |
О 2311/Забайкальский/2016 | O/Zab/16 | ME-SA | Ind 2001 | |
O 2620/Оренбургский/2021 | O/Orenburg/21 | ME-SA | Ind 2001 | |
О/Кения/2017 | O/KEN/17 | EA-2 | – | |
Аsia 1 | Азия-1 1946/Шамир 3/89 | Asia1/Shamir/89 | ASIA | Shamir |
Азия-1 2145/Таджикистан/2011 | Asia1/TAJ/11 | ASIA | Singh-08 | |
Азия-1 2356/14/Пакистан/2018 | Asia1/PAK/18 | ASIA | Singh-08 | |
SAT 2 | SAT2/LIB/39/2012 | SAT2/LIB/12 | VII | Lib-12 |
SAT2/ERI/98 | SAT2/ERI/98 | VII | – | |
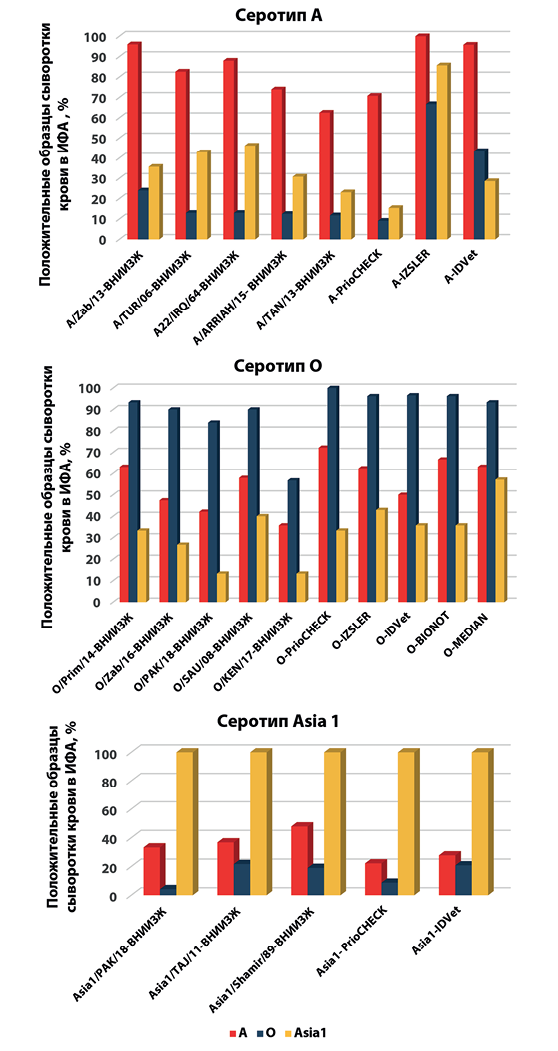
Рис. 1. Результаты исследования в ИФА образцов сыворотки крови от животных, иммунизированных моновакциной против ящура (n = 73)
Fig. 1. Results of ELISA tests of serum samples from animals immunized with monovalent anti-FMD vaccine (n = 73)
Таблица 2
Результаты исследования в ИФА образцов сыворотки крови от животных, инфицированных вирусом ящура серотипа SAT 2
Table 2
Results of ELISA tests of serum samples from animals infected with SAT 2 FMDV
Диагностическая тест-система | Образцы сыворотки крови КРС и свиней, 21–31 dpi SAT2/ERI/98 (n = 6) | |
PIсред., % | pos/n | |
A/Zab/13-ВНИИЗЖ | 64,9 | 5/6 |
A/TUR/06-ВНИИЗЖ | 66,7 | 5/6 |
A22/IRQ/64-ВНИИЗЖ | 62,8 | 4/6 |
A/ARRIAH/15-ВНИИЗЖ | 54,5 | 5/6 |
A/TAN/13-ВНИИЗЖ | 62,6 | 3/6 |
A-PrioCHECK | 36,3 | 0/6 |
A-IZSLER | 74,8 | 4/6 |
A-IDVet | 45,0 | 3/6 |
O/Prim/14-ВНИИЗЖ | 60,2 | 5/6 |
O/Zab/16-ВНИИЗЖ | 51,8 | 4/6 |
O/PAK/18-ВНИИЗЖ | 52,8 | 4/6 |
O/SAU/08-ВНИИЗЖ | 64,8 | 5/6 |
O/KEN/17-ВНИИЗЖ | 61,9 | 3/6 |
O-PrioCHECK | 34,8 | 0/6 |
O-IZSLER | 45,6 | 0/6 |
O-IDVet | 35,8 | 3/6 |
O-BIONOT | 15,5 | 1/6 |
O-MEDIAN | 37,0 | 3/6 |
Asia1/PAK/18-ВНИИЗЖ | 37,4 | 2/6 |
Asia1/TAJ/11-ВНИИЗЖ | 57,8 | 4/6 |
Asia1/Shamir/89-ВНИИЗЖ | 71,9 | 5/6 |
Asia1-PrioCHECK | 52,8 | 4/6 |
Asia1-IDVet | 31,4 | 0/6 |
SAT2/LIB/12-ВНИИЗЖ | 97,6 | 6/6 |
dpi – дни после заражения; pos/n – количество положительных результатов в ИФА к общему числу исследованных образцов сыворотки крови; курсивом выделены результаты исследования в гетерологичных тест-системах ИФА, жирным шрифтом – положительные значения PI. dpi – days post infection; pos/n – number of ELISA positive serum samples to total number of tested serum samples; results of tests with heterologous ELISA test-systems are given in italics, positive PI values are given in bold. | ||
Таблица 3
Результаты исследования в ИФА и РН образцов сыворотки крови от свиней, привитых бивалентной вакциной против ящура серотипов А и О, до и после контрольного заражения вирусом ящура серотипа О
Table 3
ELISA and NT results for serum samples from pigs vaccinated with bivalent vaccines against type A and O FMDV before and after challenge test using type O FMDV
Диагностическая тест-система | Образцы сыворотки крови свиней | |||||
21 dpv против ящура серотипов А и O | 29 dpv против ящура серотипов А и O, 8 dpi вирусом ящура серотипа О | 8 dpi вирусом ящура серотипа О (невакцинированный контроль) | ||||
PIсред., % | pos/n | PIсред., % | pos/n | PIсред., % | pos/n | |
А/Zab/13-РН | н/о*** | 12/29 | н/о | 12/28 | н/о | 2/2 |
A/Zab/13-ВНИИЗЖ | 39,6 | 13/28 | 59,2 | 18/28 | 76,0 | 2/2 |
A/TUR/06-ВНИИЗЖ | 36,9 | 10/28 | 57,9 | 18/28 | 75,1 | 2/2 |
A22/IRQ/64-ВНИИЗЖ | 48,0 | 15/28 | 67,6 | 22/28 | 80,7 | 2/2 |
A/ARRIAH/15-ВНИИЗЖ | 28,7 | 4/28 | 54,1 | 17/28 | 73,2 | 2/2 |
A/TAN/13-ВНИИЗЖ | 38,2 | 9/28 | 58,7 | 17/28 | 65,5 | 2/2 |
A- PrioCHECK | 36,0 | 3/28 | 41,8 | 9/28 | 52,4 | 1/2 |
A-IZSLER | 77,3 | 23/29 | 76,1 | 21/28 | 84,5 | 2/2 |
A-IDVet | 51,54 | 15/29 | 58,52 | 19/28 | 78,6 | 2/2 |
O/Prim/14-РН | н/о | 10/29 | н/о | 28/28 | н/о | 2/2 |
O/Prim/14-ВНИИЗЖ | 74,3 | 26/28 | 87,8 | 28/28 | 91,3 | 2/2 |
O/Zab/16-ВНИИЗЖ | 53,1 | 18/28 | 76,8 | 24/28 | 90,0 | 2/2 |
O/PAK/18-ВНИИЗЖ | 50,9 | 16/28 | 75,6 | 23/28 | 94,2 | 2/2 |
O/SAU/08-ВНИИЗЖ | 51,9 | 16/28 | 73,4 | 23/28 | 89,8 | 2/2 |
O/KEN/17-ВНИИЗЖ | 45,3 | 12/28 | 73,1 | 21/28 | 93,9 | 2/2 |
O-PrioCHECK | 73,5 | 25/28 | 82,0 | 27/28 | 89,9 | 2/2 |
O-IZSLER | 58,6 | 5/29 | 71,2 | 16/28 | 71,4 | 2/2 |
O-IDVet | 63,4 | 13/29 | 77,9 | 21/28 | 77,7 | 2/2 |
O-BIONOT | 49,4 | 18/29 | 73,1 | 25/28 | 80,1 | 2/2 |
O-MEDIAN | 52,0 | 23/29 | 68,0 | 27/28 | 60,0 | 2/2 |
Asia1/PAK/18-ВНИИЗЖ | 23,0 | 0/29 | 39,9 | 6/28 | 78,5 | 2/2 |
Asia1/TAJ/11-ВНИИЗЖ | 28,7 | 3/29 | 50,3 | 13/28 | 80,3 | 2/2 |
Asia1/Shamir/89-ВНИИЗЖ | 29,4 | 1/29 | 47,9 | 13/28 | 76,2 | 2/2 |
Asia1-PrioCHECK | 21,5 | 0/29 | 24,8 | 0/28 | 35,9 | 0/2 |
Asia1-IDVet | 6,6 | 0/29 | 5,8 | 0/28 | 2,0 | 0/2 |
SAT2/LIB/12-ВНИИЗЖ | 6,8 | 0/29 | 19,0 | 4/28 | 61,6 | 2/2 |
dpv – дни после вакцинации; dpi – дни после заражения; pos/n – количество положительных результатов в ИФА к общему числу исследованных образцов сыворотки крови; н/о – не определяется; курсивом выделены результаты исследования в гетерологичных тест-системах ИФА, жирным шрифтом – положительные значения PI. dpv – days post vaccination; dpi – days post infection; pos/n – number of ELISA positive serum samples to total number of tested serum samples; n/d – not detected; results of tests with heterologous ELISA test-systems are given in italics, positive PI values are given in bold. | ||||||
Таблица 4
Результаты исследования в РН сыворотки крови контрольных животных (n = 2), зараженных вирусом ящура штамма О 2212/Приморский/2014 (8 dpi)
Table 4
Results of testing of serum samples from control animals (n = 2) infected with FMDV O2122/Primorsky/2014 strain with NT (8 dpi)
Штамм вируса ящура | Доза вируса, ТЦД50/0,05 см3 | Тсред. ВНА, lg |
А 2029/Турция/2006 | 101,58 | 1,08 |
А 2155/Забайкальский/2013 | 101,46 | 1,65 |
А 2269/ВНИИЗЖ/2015 | 101,76 | 0,98 |
А22/Ирак/24/64 | 101,69 | 1,34 |
А/Танзания/2013 | 101,5 | 1,34 |
О 2356/Пакистан/2018 | 101,69 | 2,56 |
О 2311/Забайкальский/2016 | 101,58 | 2,03 |
О 2212/Приморский/2014 | 101,76 | 2,26 |
О 2047/Саудовская Аравия/2008 | 102,06 | 2,10 |
О/Кения/2017 | 101,8 | 2,40 |
Азия-1 1946/Shamir/Израиль/3/89 | 101,5 | 1,20 |
Азия-1 2145/Таджикистан/2011 | 101,69 | 1,08 |
Азия-1 2356/14/Пакистан/2018 | 101,69 | 1,65 |
SAT2/LIB/39/2012 | 101,76 | 1,08 |
Тсред. ВНА – средний титр вируснейтрализующих антител; курсивом выделены результаты исследования в гетерологичной РН, жирным шрифтом – защитный уровень ВНА. Тmean VNA – mean titre of virus neutralizing antibodies; results of tests with heterologous NT are given in italics, protective level of virus neutralizing antibodies is given in bold. | ||

Рис. 2. Аминокислотная последовательность поверхностного полипептида VP1 вируса ящура разных серотипов, 214 а. о. (по данным GenBank NCBI; красным цветом выделена зона GH-loop)
Fig. 2. Amino acid sequence of surface VP1polypeptide of FMDV of different serotypes, 214 а. a. (according to the GenBank NCBI data; GH-loop region is indicated in red)
Таблица 5
Результаты серотипирования интактного антигена вируса ящура в «сэндвич»-варианте ИФА
Table 5
Results of serotyping of FMDV intact antigen with sandwich ELISA
Образцы 146S-AГ ВЯ (C ≈ 0,025 мг/мл) | «Сэндвич»-вариант ИФА (ФГБУ «ВНИИЗЖ») для АГ ВЯ серотипа | |||||||
А | О | Asia 1 | SAT 2 | |||||
A/Zab/13 | A/TUR/06 | O/Zab/16 | O/PAK/18 | O/SAU/08 | O/Prim/14 | Asia1/Shamir/89 | SAT2/LIB/12 | |
A/Zab/13 | пол. | пол. | отр. | отр. | отр. | отр. | отр. | отр. |
A/TUR/06 | пол. | пол. | отр. | отр. | отр. | отр. | отр. | отр. |
A/ARRIAH/15 | пол. | пол. | отр. | отр. | отр. | отр. | отр. | отр. |
A22/IRQ/64 | пол. | пол. | отр. | отр. | отр. | отр. | отр. | отр. |
O/Zab/16 | отр. | отр. | пол. | пол. | пол. | пол. | отр. | отр. |
O/PAK/18 | отр. | отр. | пол. | пол. | пол. | пол. | отр. | отр. |
O/SAU/08 | отр. | отр. | пол. | пол. | пол. | пол. | отр. | отр. |
O/Prim/14 | отр. | отр. | пол. | пол. | пол. | пол. | отр. | отр. |
O/KEN/17 | отр. | отр. | пол. | пол. | пол. | пол. | отр. | отр. |
Asia1/Shamir/89 | отр. | отр. | отр. | отр. | отр. | отр. | пол. | отр. |
Asia1/TAJ/11 | отр. | отр. | отр. | отр. | отр. | отр. | пол. | отр. |
Asia1/PAK/18 | отр. | отр. | отр. | отр. | отр. | отр. | пол. | отр. |
SAT2/LIB/12 | отр. | отр. | отр. | отр. | отр. | отр. | отр. | пол. |
AГ ВЯ – антиген вируса ящура. FMDV Ag – antigen of FMDV. | ||||||||
Таблица 6
Результаты серотипирования интактного антигена вируса ящура в прямом варианте ИФА с использованием коммерческих конъюгатов моноклональных антител с пероксидазой хрена
Table 6
Results of FMDV intact antigen serotyping with direct ELISA using commercial monoclonal antibody-horse radish peroxidase conjugates
Образцы 146S-АГ ВЯ (C ≈ 0,025 мг/мл) | Прямой вариант ИФА для АГ ВЯ c коммерческим конъюгатом | ||||||||||
PrioCHECK | IZSLER | IDVet | BIONOTE | MEDIAN | |||||||
A | O | A | O | Asia 1 | SAT 2 | A | O | Asia 1 | O | O | |
A/Zab/13 | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | отр. | отр. | отр. |
A/TUR/06 | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | отр. | отр. | отр. |
A/ARRIAH/15 | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | отр. | отр. | отр. |
A22/IRQ/64 | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | отр. | отр. | отр. |
O/Zab/16 | отр. | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | пол. | пол. |
O/PAK/18 | отр. | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | пол. | отр. |
O/SAU/08 | отр. | пол. | отр. | пол. | отр. | отр. | отр. | отр. | отр. | пол. | пол. |
O/Prim/14 | отр. | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | пол. | отр. |
O/KEN/17 | отр. | пол. | отр. | пол. | отр. | отр. | отр. | пол. | отр. | пол. | пол. |
Asia1/Shamir/89 | отр. | отр. | отр. | отр. | пол. | отр. | пол. | отр. | пол. | отр. | отр. |
Asia1/TAJ/11 | отр. | отр. | отр. | отр. | пол. | отр. | пол. | отр. | пол. | отр. | отр. |
Asia1/PAK/18 | отр. | отр. | отр. | отр. | пол. | отр. | пол. | отр. | пол. | отр. | отр. |
SAT2/LIB/12 | отр. | отр. | пол. | отр. | отр. | пол. | отр. | отр. | отр. | отр. | отр. |
AГ ВЯ – антиген вируса ящура. FMDV Ag – antigen of FMDV. | |||||||||||
Таблица 7
Результаты исследования в ИФА образцов сыворотки крови КРС, иммунизированного моновакциной против ящура серотипов О и Asia 1
Table 7
Results of ELISA tests of serum samples from cattle immunized with monovalent vaccine against type O and Asia 1 FMDV
Диагностическая тест-система | Сыворотка крови КРС, PIсред. (%) | ||||
21 dpv O/Orenburg/21 | № 1 Asia1/Shamir/89 | № 2 Asia1/Shamir/89 | |||
14 dpv | 23 dpv | 14 dpv | 23 dpv | ||
A/Zab/13-ВНИИЗЖ | 97,1 | 35,4 | 82,2 | 21,7 | 17,3 |
A/TUR/06-ВНИИЗЖ | 93,8 | 6,5 | 63,0 | 1,1 | 22,3 |
A22/IRQ/64-ВНИИЗЖ | 89,2 | 36,4 | 68,8 | 3,8 | 6,56 |
A/ARRIAH/15-ВНИИЗЖ | 90,1 | 4,4 | 40,5 | 23,3 | 25,9 |
A/TAN/13-ВНИИЗЖ | н/и | 3,1 | 81,5 | 8,7 | 37,3 |
A-PrioCHECK | 58,3 | 23,3 | 63,8 | 17,9 | 35,1 |
A-IZSLER | 95,8 | 71,0 | 81,6 | 67,4 | 70,3 |
A-IDVet | 97,7 | 35,6 | 81,4 | 36,6 | 34,3 |
O/Prim/14-ВНИИЗЖ | 96,6 | 48,3 | 58,4 | 31,2 | 39,5 |
O/Zab/16-ВНИИЗЖ | 95,9 | 16,7 | 38,3 | 6,4 | 14,7 |
O/PAK/18-ВНИИЗЖ | 96,1 | 35,2 | 33,7 | 12,4 | 18,6 |
O/SAU/08-ВНИИЗЖ | 96,0 | 34,5 | 68,2 | 22,8 | 25,2 |
O/KEN/17-ВНИИЗЖ | н/и | 2,1 | 3,3 | 5,3 | 7,1 |
O-PrioCHECK | 97,3 | 40,5 | 48,4 | 23,9 | 25,5 |
O-IZSLER | 95,8 | 56,1 | 41,5 | 38,6 | 55,6 |
O-IDVet | 85,9 | 4,2 | 1,0 | –26,6 | –43,6 |
O-BIONOT | 98,9 | 32,0 | 39,7 | 21,0 | 22,9 |
O-MEDIAN | 90,0 | 40,0 | 54,0 | 30,0 | 20,0 |
Asia1/PAK/18-ВНИИЗЖ | 92,2 | 67,3 | 84,6 | 63,7 | 84,5 |
Asia1/TAJ/11-ВНИИЗЖ | 88,7 | 62,3 | 72,1 | 61,6 | 71,5 |
Asia1/Shamir/89-ВНИИЗЖ | 90,6 | 72,8 | 90,8 | 71,9 | 89,9 |
Asia1-PrioCHECK | 47,1 | 74,8 | 80,4 | 74,2 | 81,7 |
Asia1-IDVet | 81,9 | 85,2 | 88,9 | 78,9 | 75,9 |
SAT2/LIB/12-ВНИИЗЖ | 81,5 | н/и | н/и | н/и | н/и |
dpv – дни после вакцинации; н/и – не исследовали; курсивом выделены результаты исследования в гетерологичных тест-системах ИФА, жирным шрифтом – положительные значения PI. dpv – days post vaccination; n/t – not tested; results of tests with heterologous ELISA test-systems are given in italics, positive PI values are given in bold. | |||||
Таблица 8
Результаты исследования образцов сыворотки крови КРС, привитого противоящурной вакциной на основе штаммов О 2620/Оренбургский/2021 или О 2356/Пакистан/2018, в РН вируса ящура гомологичных и гетерологичных серотипов
Table 8
Results of tests of serum samples from cattle vaccinated with anti-FMD vaccine based on О 2620/Orenburgsky/2021 or О 2356/Pakistan/2018 strain with neutralization test using homologous and heterologous FMDV serotypes
Штамм вируса ящура | Доза вируса, ТЦД50/0,05 см3 | Тсред. ВНА, lg | |
O/Orenburg/21 | O/PAK/18 | ||
А 2155/Забайкальский/2013 | 101,46 | 2,10 | 1,38 |
О 2356/Пакистан/2018 | 101,35 | ≥ 2,86 | 3,00 |
О 2620/Оренбургский/2021 | 101,88 | 2,70 | 1,70 |
Азия-1 1946/Shamir/Израиль/3/89 | 102,29 | ≤ 0,78 | 1,08 |
SAT2/LIB/39/2012 | 101,16 | 0,90 | 1,65 |
Тсред. ВНА – средний титр вируснейтрализующих антител; курсивом выделены результаты исследования в гетерологичной РН, жирным шрифтом – защитный уровень ВНА. Тmean VNA – mean titre of virus neutralizing antibodies; results of tests with heterologous NT are given in italics, protective level of virus-neutralizing antibodies is given in bold. | |||
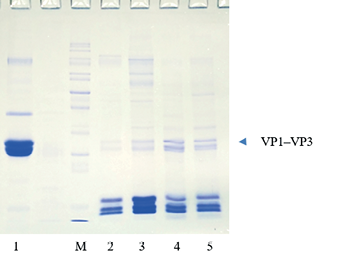
Рис. 3. Электрофорез в 12%-м полиакриамидном геле образцов антигена вируса ящура:
М – белковый маркер 10–200 kDa; 1 – 146S-AГ Asia1/TAJ/11 (интактный антиген); 2 – AГУЦФ35 O/Orenburg/21; 3 – AГПЦ O/Orenburg/21; 4 – AГУЦФ35 Asia1/PAK/18; 5 – AГПЦ Asia1/PAK/18. AГУЦФ35 – антиген, сконцентрированный при ультрацентрифугировании через 35%-й слой сахарозы; AГПЦ – антиген, преципитированный 8% полиэтиленгликоля 6000
Fig. 3. Polyacrylamide gel (12%) electrophoresis of FMDV antigen specimens: М – protein marker, 10–200 kDa; 1 – 146S-Ag Asia1/TAJ/11 (intact antigen); 2 – AgUCF35 O/Orenburg/21; 3 – AgPRECIP O/Orenburg/21; 4 – AgUCF35 Asia1/PAK/18; 5 – AgPRECIP Asia1/PAK/18.
AgUCF35 – antigen concentrated with 35% sucrose gradient ultracentrifugation (UCF); AgPRECIP – antigen precipitated with 8% polyethylene glycol 6,000
ЗАКЛЮЧЕНИЕ
Таким образом, было показано, что все использованные в работе иммуноферментные диагностические тест-системы для определения антител к структурным белкам вируса ящура разных производителей: ФГБУ «ВНИИЗЖ» (Россия), Prionics (Нидерланды/Швейцария), IZSLER & The Pirbright Institute (Италия/Великобритания), Innovative Diagnostics (Франция) BIONOTE (Республика Корея), MEDIAN Diagnostics (Республика Корея) – обнаруживали некоторое количество перекрестно-реагирующих антител между серотипами вируса ящура. Индукция данной категории антител могла быть вызвана рядом факторов: наличием консервативных эпитопов в аминокислотной последовательности поверхностных полипептидов вируса ящура, нарушением целостности капсида, что провоцировало выработку антител против внутреннего высококонсервативного полипептида. Тем не менее анализ большого массива данных (около 3500 исследований) показал, что гомологичная серотипоспецифическая реакция в целом была значительно выше и являлась доминирующей, доля вирусоспецифических незащитных антител, в том числе и перекрестно-реагирующих, была не столь значительной и не искажала результаты оценки иммуногенности противоящурной вакцины в ИФА. В исключительных случаях требуется подтверждение результатов в других серологических реакциях. Оптимальным вариантом следует считать комплексные исследования на ящур с привлечением разных методов диагностики, таких как иммуноферментный анализ с использованием стандартных и референтных тест-систем и/или реакция вирусной нейтрализации в культуре клеток.
Список литературы
1. Феррари Д., Пейтон Д., Дуффи С., Бартелс К., Найт-Джонс Т. Вакцинация против ящура и поствакцинальный мониторинг: руководство. Под ред. С. Метвалли, С. Мюнстерманн. Рим: ФАО, ВОЗЖ; 2020. 88 с. https://www.fao.org/documents/card/en/c/I5975RU
2. Foot and mouth disease (infection with foot and mouth disease virus). In: WOAH. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 2022; Chapter 3.1.8. https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/3.01.08_FMD.pdf
3. Ludi A. B., Morris A., Gubbins S., Asfor A., Afzal M., Browning C. F., et al. Cross-serotype reactivity of ELISAs used to detect antibodies to the structural proteins of foot-and-mouth disease virus. Viruses. 2022; 14 (7):1495. https://doi.org/10.3390/v14071495
4. He Y., Li K., Cao Y., Sun Z., Li P., Bao H., et al. Structures of foot-and-mouth disease virus with neutralizing antibodies derived from recovered natural host reveal a mechanism for cross-serotype neutralization. PLoS Pathogens. 2021; 17 (4):e1009507. https://doi.org/10.1371/journal.ppat.1009507
5. Meloen R. H., Briaire J. A study of the cross-reacting antigens on the intact foot-and-mouth disease virus and its 12S Subunits with antisera against the structural proteins. Journal of General Virology. 1980; 51 (1): 107–116. https://doi.org/10.1099/0022-1317-51-1-107
6. Dong H., Lu Y., Zhang Y., Mu S., Wang N., Du P., et al. A heat-induced mutation on VP1 of foot-and-mouth disease virus serotype O enhanced capsid stability and immunogenicity. Journal of Virology. 2021; 95 (16):e00177-21. https://doi.org/10.1128/JVI.00177-21
7. Roeder P. L., Le Blanc Smith P. M. Detection and typing of foot-and-mouth disease virus by enzyme-linked immunosorbent assay: A sensitive, rapid and reliable technique for primary diagnosis. Research in Veterinary Science. 1987; 43 (2): 225–232. https://doi.org/10.1016/S0034-5288(18)30778-1
8. Casey-Bryars M., Reeve R., Bastola U., Knowles N. J., Auty H., Bachanek-Bankowska K., et al. Waves of endemic foot-and-mouth disease in eastern Africa suggest feasibility of proactive vaccination approaches. Nature Ecology and Evolution. 2018; 2 (9): 1449–1457. https://doi.org/10.1038/s41559-018-0636-x
9. Dill V., Beer M., Hoffmann B. Simple, quick and cost-efficient: A universal RT-PCR and sequencing strategy for genomic characterization of foot-and-mouth disease viruses. Journal of Virological Methods. 2017; 246: 58–64. https://doi.org/10.1016/j.jviromet.2017.04.007
10. Di Nardo A., Ferretti L., Wadsworth J., Mioulet V., Gelman B., Karniely S., et al. Evolutionary and ecological drivers shape the emergence and extinction of foot-and-mouth disease virus lineages. Molecular Biology and Evolution. 2021; 38 (10): 4346–4361. https://doi.org/10.1093/molbev/msab172
11. Ali M. R., Alam A. S. M. R. U., Amin M. A., Siddique M. A., Sultana M., Hossain M. A. Emergence of novel lineage of foot-and-mouth disease virus serotype Asia1 BD-18 (G-IX) in Bangladesh. Transboundary and Emerging Diseases. 2020; 67 (2): 486–493. https://doi.org/10.1111/tbed.13381
12. Dill V., Hoffmann B., Zimmer A., Beer M., Eschbaumer M. Adaption of FMDV Asia-1 to suspension culture: Cell resistance is overcome by virus capsid alterations. Viruses. 2017; 9 (8):231. https://doi.org/10.3390/v9080231
13. Martínez M. A., Dopazo J., Hernández J., Mateu M. G., Sobrino F., Domingo E., Knowles N. J. Evolution of the capsid protein genes of foot-and-mouth disease virus: Antigenic variation without accumulation of amino acid substitutions over six decades. Journal of Virology. 1992; 66 (6): 3557–3565. https://doi.org/10.1128/JVI.66.6.3557-3565.1992
14. Hassan A. M., El-Mayet F. S., El-Habbaa A. S., Shahein M. A., El Zowalaty M. E., Hagag N. M., Sharawi S. S. A. Molecular characterization of newly emerging foot-and-mouth disease virus serotype SAT 2 of Lib-12 lineage isolated from Egypt. Virus Research. 2022; 311:198651. https://doi.org/10.1016/j.virusres.2021.198651
15. Ahmed H. A., Salem S. A. H., Habashi A. R., Arafa A. A., Aggour M. G. A., Salem G. H., et al. Emergence of foot-and-mouth disease virus SAT 2 in Egypt during 2012. Transboundary and Emerging Diseases. 2012; 59 (6): 476–481. https://doi.org/10.1111/tbed.12015
16. Laemmli U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227 (5259): 680–685. https://doi.org/10.1038/227680a0
17. Lugovskaya N. N., Scherbakov A. V., Yakovleva A. S., Tsyvanyuk M. A., Mudrak N. S., Drygin V. V., Borisov A. V. Detection of antibodies to avian infectious bronchitis virus by a recombinant nucleocapsid protein-based enzyme-linked immunosorbent assay. Journal of Virological Methods. 2006; 135 (2): 292–296. https://doi.org/10.1016/j.jviromet.2006.03.019
18. Hamblin C., Barnett I. T. R., Hedger R. S. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus I. Development and method of ELISA. Journal of Immunological Methods. 1986; 93 (1): 115–121. https://doi.org/10.1016/0022-1759(86)90441-2
19. Hamblin C., Barnett I. T. R., Crowther J. R. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus: II. Application. Journal of Immunological Methods. 1986; 93 (1): 123–129. https://doi.org/10.1016/0022-1759(86)90442-4
20. Hamblin C., Kitching R. P., Donaldson A. I., Crowther J. R., Barnett I. T. R. Enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus: III. Evaluation of antibodies after infection and vaccination. Epidemiology and Infection. 1987; 99 (3): 733–744. https://doi.org/10.1017/s0950268800066590
Об авторах
Н. Н. ЛуговскаяРоссия
Луговская Наталия Николаевна, канд. биол. наук, заведующий сектором лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Е. А. Силантьева
Россия
Силантьева Екатерина Андреевна, аспирант, ветеринарный врач лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Т. В. Оковытая
Россия
Оковытая Татьяна Владимировна, канд. биол. наук, старший научный сотрудник лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
А. А. Харитонова
Россия
Харитонова Анастасия Александровна, ветеринарный врач лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Ы. М. Гочмурадов
Россия
Гочмурадов Ыхлас Мурадович, аспирант, ветеринарный врач лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Е. А. Разгуляева
Россия
Разгуляева Евгения Александровна, главный специалист лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
О. О. Будина
Россия
Будина Олеся Олеговна, главный специалист лаборатории профилактики ящура
мкр. Юрьевец, г. Владимир, 600901
Е. А. Яснева
Россия
Яснева Елена Анатольевна, канд. вет. наук, руководитель испытательной лаборатории ветеринарных препаратов
мкр. Юрьевец, г. Владимир, 600901
Рецензия
Для цитирования:
Луговская Н.Н., Силантьева Е.А., Оковытая Т.В., Харитонова А.А., Гочмурадов Ы.М., Разгуляева Е.А., Будина О.О., Яснева Е.А. Изучение серотипоспецифичности диагностических тест-систем для выявления антител к структурным белкам вируса ящура иммуноферментным анализом. Ветеринария сегодня. 2024;13(1):44-56. https://doi.org/10.29326/2304-196X-2024-13-1-44-56
For citation:
Lugovskaya N.N., Silanteva E.A., Okovytaya T.V., Kharitonova A.A., Gochmuradov Y.M., Razgulyaeva E.A., Budina O.O., Yasneva E.A. Testing of diagnostic test-systems for detection of antibodies to foot-and-mouth disease virus structural proteins with enzyme-linked immunosorbent assay for their serotype specificity. Veterinary Science Today. 2024;13(1):44-56. https://doi.org/10.29326/2304-196X-2024-13-1-44-56



































