Перейти к:
Разработка и применение иммуноферментной тест-системы для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV
https://doi.org/10.29326/2304-196X-2025-14-3-283-293
Аннотация
Введение. Ящур – высококонтагиозная, экономически значимая болезнь парнокопытных животных, характеризующаяся везикулярными симптомами. Известны 7 серотипов вируса ящура (A, O, C, SAT 1, SAT 2, SAT 3 и Asia 1), иммунологически отличающихся между собой. В последнее время особое внимание уделяется топотипу вируса ящура SAT2/XIV (South African Territories 2) ввиду его быстрого распространения. Одними из основных методов борьбы с ящуром являются вакцинопрофилактика и оценка иммунного статуса поголовья восприимчивых животных.
Цель исследования. Разработка и испытание иммуноферментной тест-системы на основе непрямого жидкофазного блокирующего варианта иммуноферментного анализа для определения антител к структурным белкам вируса ящура топотипа SAT2/XIV для оценки эффективности противоящурной вакцины на основе антигена вируса ящура штамма SAT-2/XIV/2023 при ее производстве и последующем применении.
Материалы и методы. Исследуемым материалом служили экспериментальные образцы сыворотки крови крупного рогатого скота, свиней и белых мышей. Испытание разработанной иммуноферментной тест-системы для оценки уровня поствакцинальных антител к вирусу ящура топотипа SAT2/XIV проводили в сравнении с коммерческими наборами: для определения антител к вирусу ящура SAT 2 (ФГБУ «ВНИИЗЖ», Россия) и Solid-phase competitive ELISA for antibodies specific to FMDV serotype SAT 2 (IZSLER & The Pirbright Institute, Италия/Великобритания).
Результаты. Эффективность предложенной тест-системы в регистрации выработки антител к вирусу ящура топотипа SAT2/XIV была выше, чем у других иммуноферментных тест-систем, обладающих выраженной топотипоспецифичностью к возбудителю ящура топотипа SAT2/VII. У отдельных особей крупного рогатого скота специфические антитела выявляли на 7-е сут после вакцинации. Высокие значения диагностической чувствительности (90%), диагностической специфичности (98%) и диагностической точности (95%) определили высокую степень согласованности результатов реакции иммуноферментного анализа с известным диагностическим статусом обследуемых животных (κ-критерий – 0,896).
Заключение. Таким образом, иммуноферментная тест-система для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV, имеющая 100%-ю степень гомологии с вакцинным штаммом, обладающая высокими диагностическими показателями, является надежным инструментом оценки качества вакцины против ящура SAT2/XIV.
Для цитирования:
Луговская Н.Н., Елькина Ю.С., Шевченко М.А., Гочмурадов Ы.М., Клюкина Н.Д., Михалишин Д.В., Борисов А.В. Разработка и применение иммуноферментной тест-системы для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV. Ветеринария сегодня. 2025;14(3):283-293. https://doi.org/10.29326/2304-196X-2025-14-3-283-293
For citation:
Lugovskaya N.N., El’kina Yu.S., Shevchenko M.A., Gochmuradov Y.M., Klyukina N.D., Mikhalishin D.V., Borisov A.V. Development and application of ELISA test system for assessing humoral immunity against SAT2 topotype XIV foot-and-mouth disease virus. Veterinary Science Today. 2025;14(3):283-293. https://doi.org/10.29326/2304-196X-2025-14-3-283-293
ВВЕДЕНИЕ
Ящур – высококонтагиозная, экономически значимая болезнь парнокопытных животных, характеризующаяся везикулярными симптомами. Известны 7 серотипов вируса ящура (A, O, C, SAT 1, SAT 2, SAT 3 и Asia 1), иммунологически различающихся между собой.
Возбудителем заболевания у восприимчивых животных является вирус рода Aphthovirus семейства Picornaviridae, представляющий собой капсид с заключенной в нем положительно заряженной цепью РНК. Капсид, имеющий структуру икосаэдра с коэффициентом седиментации 146S, сформирован из 60 копий протомерной субъединицы, состоящей из четырех структурных белков VP1–VP4. Поверхностные полипептиды VP1–VP3 несут эпитопы, отвечающие за серотипоспецифичность вируса ящура и продуцирующие выработку вируснейтрализующих антител. Приоритетным полипептидом является VP1, характеризующийся наличием основного антигенного сайта на участке G-H loop. Внутренний белок VP4 более консервативный у разных серотипов возбудителя, и антитела против эпитопов VP4 не обеспечивают защиту от инфекции [1][2].
К ящуру восприимчивы одомашненные животные, в основном крупный рогатый скот (КРС), свиньи, овцы, козы, буйволы (Bubalus bubalis), а также верблюды и верблюдовые Нового Света. Однако иногда вирус ящура выделяют у диких парнокопытных, таких как дикие свиньи, антилопы и олени. Поэтому возможно перекрестное инфицирование между дикими и домашними парнокопытными животными при прямом или непрямом контакте. У симпатрических видов это один из наиболее вероятных путей передачи вируса ящура. Основным резервуаром возбудителя ящура является КРС, поскольку именно для данного вида животных характерно явление вирусоносительства. Вирусоносителями называют особей, у которых вирус персистирует в ротоглотке более 4 нед. после заражения. У КРС обычно это состояние сохраняется до 6 мес., но у некоторых особей – до 3 лет. У диких животных факт вирусоносительства доказан только для африканских буйволов (Syncerus caffer), отдельные особи которых сохраняли в себе вирус в течение 5 лет, а в стаде возбудитель способен циркулировать на протяжении 24 лет и более. Эта особенность КРС значительно затрудняет борьбу с ящуром, особенно в регионах, эндемичных по данной болезни. К ним относится ряд стран в Африке, на Ближнем Востоке и в Азии, а также на ограниченной территории Южной Америки [1], что, в свою очередь, создает серьезную опасность распространения ящура за пределы эндемичных территорий.
Борьба с ящуром заключается в проведении своевременных профилактических мероприятий, таких как эффективный эпидемиологический контроль за болезнью; вакцинирование против ящура домашних и сельскохозяйственных животных; надзор за передвижением диких парнокопытных животных в приграничных районах, подверженных риску проникновения возбудителя из стран, неблагополучных по ящуру; мониторинговые исследования по оценке иммунного статуса сельскохозяйственного и домашнего скота, включая ретроспективную диагностику ящура. Поскольку вирус разных серотипов практически не вызывает перекрестного иммунитета и при использовании вакцин на основе штаммов возбудителя, отличных от полевых, даже в рамках одного серотипа защита может быть слабой, при разработке вакцинных препаратов необходим тщательный подбор штаммов для обеспечения максимально возможной защиты поголовья от ящура в конкретном регионе [1][2].
В последнее время особое внимание уделяется экзотическому для многих регионов мира, в том числе и для России, серотипу вируса ящура SAT 2. Само название, представляющее собой английскую аббревиатуру South African Territories (южноафриканские территории), говорит о происхождении данного серотипа. На территории Африканского континента периодически регистрируются вспышки ящура, вызванные вирусом серотипа SAT 2, представители которого характеризуются высокой генетической изменчивостью и разделяются на 14 топотипов (I–XIV) [3]. До недавнего времени эпизоотическая ситуация по ящуру в Африке преимущественно была связана с представителями серотипа SAT 2 топотипа VII (SAT2/VII), однако в 2022 г. началось быстрое распространение вируса серотипа SAT 2 топотипа XIV (SAT2/XIV), в результате чего он вышел за пределы эндемичных территорий. Вспышки ящура, вызванные вирусом топотипа SAT2/XIV, зарегистрированы в 2023 г. в некоторых странах Евразийского континента, в том числе в Ираке, Иордании, Турции.
Возбудитель ящура серотипа SAT 2, циркулировавший в Ираке в 2023 г., тесно связан с изолятами вируса, выделенными в Эфиопии в 2022 г. (SAT2/ETH/3/22 и SAT2/ETH/2/22). Оба вируса были получены от инфицированного КРС в марте 2022 г. Согласно сообщениям, вирус, выделяемый в настоящее время в Иордании, также имеет отношение к указанному иракскому вирусу. Распространение экзотического вируса ящура на крупные восприимчивые популяции КРС и буйволов в Ираке угрожает многочисленным популяциям животных в Иране, Турции и ряде других стран Ближнего Востока и вызывает серьезную обеспокоенность [4].
Тесное сотрудничество со странами СНГ и Ближнего Востока, торгово-экономические связи Российской Федерации со странами Африканского континента, где не проводится профилактическая вакцинация поголовья скота против ящура, вызванного возбудителем серотипа SAT 2, повышают риск заноса инфекционного агента на территорию нашей страны. В связи с этим большую актуальность приобретают производство вакцин против ящура, вызванного вирусом данного серотипа, в том числе топотипа SAT2/XIV, разработка и внедрение диагностических тест-систем для оценки эффективности вакцинации и напряженности поствакцинального иммунитета у сельскохозяйственных и домашних парнокопытных животных, а также для обнаружения постинфекционных антител к возбудителю ящура в сыворотке крови невакцинированных животных.
В ФГБУ «ВНИИЗЖ» разработана и успешно прошла испытания противоящурная моно- и поливалентная вакцина на основе антигена вируса ящура штамма SAT-2/XIV/2023 [4]. Данный штамм получен путем адаптации к репродукции в первично трипсинизированной монослойной клеточной линии почки свиньи, в перевиваемых культурах клеток BНK-21/SUSP/ARRIAH,
IB-RS-2, ПСГК-30, а также в организме КРС и свиней изолята вируса ящура, выделенного в ФГБУ «ВНИИЗЖ» из патологического материала, отобранного от КРС на территории Иорданского Хашимитского Королевства в августе 2023 г. Штамм SAT-2/XIV/2023 депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных ФГБУ «ВНИИЗЖ» в 2023 г. и был предложен для изготовления вакцинных препаратов и средств диагностики [5, 6]. В связи с этим возникла необходимость разработки иммуноферментной тест-системы, позволяющей максимально объективно и достоверно оценивать антигенные и иммуногенные свойства противоящурной вакцины на основе антигена вируса ящура штамма SAT-2/XIV/2023, а также иммунный фон и напряженность поствакцинального иммунитета у восприимчивых животных.
В данной статье описаны этапы разработки и испытания иммуноферментной тест-системы на основе непрямого жидкофазного блокирующего варианта иммуноферментного анализа (ИФА) для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы сыворотки. Исследуемым материалом в ИФА служили экспериментальные образцы сыворотки крови КРС, свиней и белых мышей.
Получение иммуноспецифических реагентов. Антиген вируса ящура штамма SAT-2/XIV/2023 для получения иммуноспецифических компонентов реакции ИФА (антигена, улавливающих (сенсибилизирующих) и детекторных антител) выделяли из инактивированной вируссодержащей суспензии культуры клеток ВНК-21 по следующей схеме. На первом этапе антигенное сырье при низкоскоростном центрифугировании (Avanti J-26 XP; Beckman Coulter, США) в течение 30 мин освобождали от клеточного детрита. Надосадочную жидкость сливали и использовали для преципитации вирусного антигена в присутствии 8%-го полиэтиленгиколя с молекулярной массой 6000 г/моль (ПЭГ 6000) и 0,85%-го NaCl в течение 18–20 ч при температуре (6 ± 2) °С. Преципитированный антиген осаждали на центрифуге Avanti J-26 XP (Beckman Coulter, США) при 6000 об/мин и температуре 4 °С в течение 60 мин. Надосадок удаляли, осадок ресуспендировали 1/500 от первоначального объема исходного сырья в фосфатно-буферном солевом растворе (ФБР) с рН 7,4. Затем полученную суспензию тщательно гомогенизировали с 50% хлороформа и фракционировали при 3000 об/мин, температуре 4 °С в течение 15 мин на центрифуге Allegra X-22R Centrifuge (Beckman Coulter, США). Верхняя водная фракция являлась промежуточной субстанцией в виде концентрированного, частично очищенного антигена, обозначенной далее как преципитат антигена вируса ящура штамма SAT-2/XIV/2023 (AgПЦ SAT2/XIV). Затем AgПЦ SAT2/XIV фракционировали в ступенчатом градиенте плотности сахарозы, состоящем из последовательных слоев 20, 30, 40, 50% сахарозы в ФБР, на центрифуге Optima L-80 XP Ultracentrifuge (Beckman Coulter, США) при 24 000 об/мин, температуре 4 °С в течение 3 ч.
Антигенные фракции анализировали спектрофотометрически при длине волны 260 нм и электрофоретическим разделением белковых молекул в полиакриламидном геле. Фракции 30–50%-й сахарозы, содержащие структурные белки VP1–VP3 (интактный антиген вируса ящура штамма SAT-2/XIV/2023, представляющий собой 146S-частицы), свободные от примесей либо включающие их в минимальном количестве, объединяли, обозначали как 146S-Ag SAT2/XIV и затем использовали для изготовления иммуноспецифических компонентов реакции жидкофазного блокирующего варианта ИФА (жбИФА): улавливающих и детекторных антител, антигена вируса ящура.
Кроликов и морских свинок иммунизировали двукратно 146S-Ag SAT2/XIV в дозе приблизительно 0,3 и 0,15 мг на голову соответственно. Антиген для введения смешивали с адъювантом ISA-206 в равных пропорциях. Обескровливание производили на 35 сут после первой вакцинации.
Все эксперименты на животных проводились в строгом соответствии с межгосударственным стандартом по содержанию и уходу за лабораторными животными ГОСТ 33215-2014, принятым Межгосударственным советом по стандартизации, метрологии и сертификации, а также согласно требованиям Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
Для подбора рабочих разведений компонентов реакции жбИФА, в том числе улавливающих и детекторных антител, антигена, иммунопероксидазного конъюгата вторичных антител кролика к IgG морской свинки, использовали стандартную панель образцов штаммоспецифической сыворотки крови свиней и КРС, включавшую как гомологичные, так и гетерологичные образцы, полученные на другие серотипы вируса ящура, а также нормальную сыворотку крови, отобранную от не вакцинированных против ящура животных.
Иммуноферментный анализ. Реакцию проводили согласно рекомендациям Всемирной организации здравоохранения животных (ВОЗЖ) для жбИФА [1] и инструкции по применению набора для определения антител к структурным белкам вируса ящура в ИФА в соответствии с подобранной при разработке тест-системы оптимальной концентрацией иммуноспецифических реагентов. В работе также использовали диагностический набор на основе жбИФА для обнаружения антител к структурным белкам вируса ящура серотипа SAT 2 (топотип SAT2/VII), выпускаемый в ФГБУ «ВНИИЗЖ», согласно инструкции по применению, а также коммерческий набор для обнаружения антител к вирусу ящура серотипа SAT 2 Solid-phase competitive ELISA for antibodies specific to FMDV serotype SAT 2, далее SAT2-IZSLER (IZSLER & The Pirbright Institute, Италия/Великобритания), в соответствии с рекомендациями производителя.
Реакцию нейтрализации (РН) вируса ящура выполняли в перевиваемой линии клеток почки свиньи IB-RS-2 в соответствии с рекомендациями ВОЗЖ. Постановку РН осуществляли микрометодом с использованием 96-луночных плоскодонных культуральных планшетов. К двукратным разведениям исследуемых и контрольных образцов сыворотки крови на питательной среде Игла МЕМ добавляли примерно 102 ТЦД50/0,05 см3 (тканевая цитопатическая доза вируса, вызывающая гибель 50% клеток) вируса, допустимый диапазон 101,5–102,5 ТЦД50/0,05 см3. Инкубировали в течение 1 ч при температуре 37 °С в присутствии 5% СО2, затем в каждую лунку планшета вносили по 0,05 см3 суспензии культуры клеток IB-RS-2 в концентрации 106 кл/см3, инкубировали в тех же условиях в течение 48–78 ч. Реакцию учитывали по мере развития цитопатического действия (ЦПД) вируса в контрольных лунках с зараженной культурой клеток без сыворотки крови от исследуемых животных. За титр вируснейтрализующих антител (ВНА) принимали последнее разведение сыворотки, тормозящее на 50% ЦПД вируса [1].
Выравнивание аминокислотных последовательностей. Выравнивание аминокислотных последовательностей белка VP1 вируса ящура разных топотипов SAT 2 выполняли согласно информации, полученной из GenBank NCBI и базы данных ФГБУ «ВНИИЗЖ»: SAT2/ETH/2/2022 (GenBank: WKE35517.1); SAT2/JOR/11/2023 (GenBank: WUR05443.1); SAT-2/XIV/2023 (база данных ФГБУ «ВНИИЗЖ»); SAT2/ETH/2/91 (GenBank: WKE35516.1); SAT2/ERI/4/98 (GenBank: AAR09103.1); SAT2/LIB/39/2012 (GenBank: AFU55195.1); SAT2/EGY/Ismailia/2018 (GenBank: QZE50286.1); SAT2/EGY/Beni-Suef-2/2018 (GenBank: QEI49588.1); SAT2/EGY/Dakahlia/2017 (GenBank: AXR97922.1) [7-14].
Электрофорез в полиакриламидном геле. Электрофоретическое разделение белков в полиакриламидном геле проводили, как описано ранее [15][16].
Статистический анализ производили с помощью интернет-ресурсов, в том числе MedCalc’s Diagnostic test evaluation calculator (https://www.medcalc.org/calc/diagnostic_test.php), Kappa Calculator (https://www.easycalculation.com/statistics/cohens-kappa-index.php).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разработка тест-системы SAT2/XIV-ВНИИЗЖ. Эффективность вакцины, иммунный фон и напряженность противоящурного иммунитета у восприимчивых животных оценивается по уровню специфических вируснейтрализующих (защитных) антител в сыворотке крови животных после вакцинации или инфицирования. В лабораторной диагностике используют два основных метода исследования образцов сыворотки крови на наличие антител к структурным белкам вируса ящура: РН и ИФА [1][2][17-19].
Разработанная иммуноферментная тест-система, предназначенная в первую очередь для оценки антигенной и иммуногенной активности противоящурной вакцины, включающей антиген вируса ящура генотипа SAT2/XIV, основана на реакции жбИФА. Данный вариант ИФА, рекомендованный ВОЗЖ как один из основных методов ретроспективной диагностики ящура для контроля иммуногенности противоящурных вакцин, оценки напряженности иммунитета, мониторинговых исследований на ящур, был адаптирован под условия ФГБУ «ВНИИЗЖ», оптимизирован и модифицирован. Неоспоримым достоинством жбИФА является тот факт, что образование комплекса «антиген – антитело» происходит в жидкой фазе, то есть в условиях, максимально приближенных к естественным. При этом не возникает деформации вириона и не изменяются антигенные сайты, что роднит его с реакцией вирусной нейтрализации в культуре клеток или куриных эмбрионах [1][17-19].
При создании тест-систем для диагностики ящура разработчики стремятся к серотипоспецифичности ИФА. Действительно, в пределах серотипа вирус ящура разных генетических линий, как правило, обнаруживает серологическое родство. Однако при обследовании первично вакцинированного молодняка тест-системы для обнаружения антител к вирусу ящура определенного серотипа разных производителей могут демонстрировать штаммовую/генотипическую специфичность. Это имеет огромное значение при оценке антигенной и иммуногенной активности противоящурной вакцины. Следует тщательно подбирать инструмент для получения наиболее объективной и достоверной информации.
Ранее в ФГБУ «ВНИИЗЖ» были созданы две тест-системы для оценки гуморального иммунитета к вирусу ящура серотипа SAT 2 топотипа VII на основе штаммов SAT2/LIB/39/2012 и SAT2/ERI/98, показавшие высокую степень родства и, как следствие, взаимозаменяемость [3]. Предполагалось, что данные тест-системы смогут обеспечить полноценный контроль в ИФА эффективности вакцины, включающей антиген нового штамма вируса ящура. Были проанализированы данные по генетическому и серологическому соответствию штаммов и изолятов вируса ящура VII и XIV топотипов серотипа SAT 2, рассмотрена целесообразность разработки новой тест-системы для ящура, индуцированного возбудителем серотипа SAT 2 топотипа XIV.
Для выявления генетического родства (гомологии) между топотипами VII и XIV проводили сравнение аминокислотных последовательностей белка VP1 вируса ящура серотипа SAT 2. Как видно на рисунке 1, вакцинный штамм вируса ящура SAT-2/XIV/2023 имел 100%-ю степень гомологии с изолятом вируса ящура, выделенным на территории Иорданского Хашимитского Королевства в 2023 г. (SAT2/JOR/11/2023), в аминокислотной последовательности полипептида VP1. Оба вируса отличались от изолята SAT2/ETH/2/2022, выделенного в Эфиопии в 2022 г., одной аминокислотной заменой в области G-H loop и 20 заменами от другого эфиопского изолята SAT2/ETH/2/91.
Данные вирусы относятся к топотипу XIV серотипа SAT 2 и имеют значительные различия с изолятами вируса ящура серотипа SAT 2 топотипа VII, что непосредственно отражается на антигенном соответствии штаммов вируса ящура серотипа SAT 2, относящихся к разным топотипам. Филогенетическое дерево вируса ящура серотипа SAT 2 на рисунке 2, основанное на сравнении нуклеотидных последовательностей гена VP1, наглядно демонстрирует топотипические (генотипические) различия между штаммами вируса.
При изучении антигенного соответствия вакцинного штамма SAT-2/XIV/2023 (топотип XIV) штаммам вируса ящура SAT2/LIB/39/2012 (топотип VII) и SAT2/ERI/98 (топотип VII) при постановке РН в культуре клеток IB-RS-2 была установлена низкая степень родства между штаммами разных топотипов – 0,06–0,16. При этом штаммы SAT2/LIB/39/2012 и SAT2/ERI/98 демонстрировали близкое родство между собой – 0,36 и 0,69 соответственно (табл. 1), – что свидетельствовало о хорошей перекрестной защите между данными вирусами ящура.
Таким образом, при разработке иммуноферментной тест-системы для оценки антигенности и иммуногенности вакцины против ящура, индуцированного вирусом топотипа SAT2/XIV, был выбран производственный штамм SAT-2/XIV/2023.
Особое внимание при получении специфических реагентов жбИФА для обнаружения антител к структурным белкам вируса ящура топотипа SAT2/XIV было уделено выделению 146S-компонента из инактивированной вируссодержащей суспензии культуры клеток ВНК-21 (146S-Ag SAT2/XIV). Это интактный антиген с коэффициентом седиментации 146S, то есть антиген с неизмененной структурой, представляющий собой вирионы, потерявшие в процессе инактивации свою инфекционность. Данный антиген является капсидом с заключенной в нем инактивированной РНК. Целостность капсида обеспечивает иммуногенность противоящурной вакцины, так как поверхностные полипептиды VP1–VP3 продуцируют выработку вируснейтрализующих штаммо/серотипоспецифических антител. Применение высокоочищенного 146S-антигена в реакции ИФА при проведении стадии «жидкая фаза», в ходе которой формируется иммунный комплекс со специфическими антителами в исследуемом образце, а также для иммунизации кроликов и морских свинок при производстве улавливающих (сенсибилизирующих) и детекторных антител соответственно позволяет определять уровень гуморального иммунитета против ящура с максимально возможной достоверностью.
Использование в реакции ИФА антигенов с более низкой степенью очистки – частично очищенного антигена (антигенного преципитата) или антигеносодержащей клеточной суспензии, характеризующихся наличием балластных белков в виде остатков клеточного детрита и сывороточного альбумина, – может привести к искажению результатов реакции.
При фракционировании антигена ультрацентрифугированием в градиенте плотности сахарозы 20–50% основная масса 146S-частиц скапливалась на границе раздела 30 и 40% слоев сахарозы в виде опалесцирующей полосы. Отобранные по 1 мл фракции градиента анализировали спектрофотометрически при длине волны 260 нм для построения седиментационного профиля AgПЦ SAT2/XIV (рис. 3А) и при электрофоретическом разделении белковых молекул в 12%-м полиакриламидном геле (рис. 3В).
Для 146S-антигена отбирали фракции с наибольшим накоплением структурных полипептидов VP1–VP3 и наименьшим содержанием/отсутствием примесей. В результате после объединения фракций получили 146S-Ag SAT2/XIV с концентрацией белка примерно 0,55 мг/мл. На рисунке 4 изображена электрофореграмма антигена вируса ящура штамма SAT-2/XIV/2023 в 12%-м полиакриламидном геле до и после фракционирования ультрацентрифугированием в градиенте плотности сахарозы.
Полученный 146S-Ag SAT2/XIV использовали для изготовления иммуноспецифических компонентов реакции жбИФА: улавливающих и детекторных антител, антигена вируса ящура.
Тест-система для определения антител к структурным белкам вируса ящура топотипа SAT2/XIV при использовании иммуноспецифических реагентов в следующих рабочих разведениях: улавливающие антитела – 1:1000, детекторные антитела – 1:5000, антиген вируса ящура – 1:1000, или 0,55 мкг/мл, коммерческий антивидовой конъюгат – 1:1500, или 0,75 мкг/мл, – демонстрировала специфичность и чувствительность при определении статуса обследуемых животных.
При интерпретации результатов реакции ИФА необходимо установить критерии качественной оценки, для чего определяется cut-off – точка отсечения, позитивно-негативный порог (ПНП), позволяющий квалифицировать исследуемые образцы биоматериала как положительные или отрицательные в отношении конкретного инфекционного агента.
В разработанной тест-системе SAT2/XIV-ВНИИЗЖ в основу качественного анализа результатов реакции ИФА заложен ПНП в 50% PI (процент ингибиции) [1]. Расчет производили по данным, полученным в ходе тестирования 176 образцов сыворотки крови от клинически здоровых КРС и свиней, не вакцинированных против ящура. Были получены среднее значение PI и стандартное отклонение от среднего (SD). Среднее значение PI по данной выборке образцов сыворотки крови (n = 176) составило 21,09%, SD – 14,67%. Позитивно-негативный порог, рассчитанный по формуле ПНП = PIсред. + 2SD, равнялся 50,43%.
Таким образом, значение ПНП для качественной характеристики образцов сыворотки крови, исследуемых в предлагаемой тест-системе на наличие антител к вирусу ящура топотипа SAT2/XIV, соответствовало прогнозируемому в 50% PI, что свидетельствовало об оптимальном выборе рабочих разведений иммуноспецифических компонентов, определяющих точность и объективность анализа.
Испытания тест-системы SAT2/XIV-ВНИИЗЖ. Испытания иммуноферментной тест-системы SAT2/XIV-ВНИИЗЖ проводили в ходе проверки антигенности и иммуногенности моновалентной сорбированной вакцины против ящура SAT2/XIV в сравнении с другими тест-системами для диагностики ящура, вызванного вирусом серотипа SAT 2 (табл. 2). Для этого 15 бычков черно-пестрой породы однократно иммунизировали вакциной в разных дозах (цельная, 1/4 и 1/16 от цельной дозы) по 5 особей на каждую дозу вакцины. Одно контрольное животное не вакцинировали. Кровь для исследования в ИФА и РН отбирали у всех животных на 0, 3, 7, 14, 21-й день после введения вакцины против ящура, вызванного возбудителем топотипа SAT2/XIV.
Образцы сыворотки крови проверяли на наличие антител к вирусу ящура серотипа SAT 2 с помощью иммуноферментных тест-систем: SAT2/XIV-ВНИИЗЖ на основе штамма SAT-2/XIV/2023; SAT2/VII-ВНИИЗЖ на основе штамма SAT2/LIB/39/2012; SAT2-IZSLER – и в реакции нейтрализации вируса ящура штамма SAT-2/XIV/2023.
Как видно из таблицы 2, эффективность тест-системы SAT2/XIV-ВНИИЗЖ в регистрации выработки специфических антител была выше, чем у других рассматриваемых тест-систем. Уже на 7-е сут было выявлено по одной серопозитивной особи в трех группах вакцинированного КРС, а в тест-системе SAT2/VII-ВНИИЗЖ – одно положительно реагирующее животное. В двух других реакциях специфические антитела обнаруживали только на 14-е сут. В результате количество положительно реагирующих животных, установленное в ИФА и РН на 14–21-й день после введения разных доз вакцины, составило: в SAT2/XIV-ВНИИЗЖ – 22/30 (73,3%), SAT2/VII-ВНИИЗЖ – 13/30 (43,3%), SAT2-IZSLER – 8/30 (26,7%), SAT2/XIV-РН – 14/30 (46,7%), – что свидетельствовало о неоспоримом преимуществе в диагностической чувствительности тест-системы SAT2/XIV-ВНИИЗЖ.
Экспериментальная вакцина с сапонином, содержащая инактивированный вирус ящура штамма SAT-2/XIV/2023, также вызывала гуморальный ответ при введении белым лабораторным мышам. Животные массой 24–26 г однократно иммунизировали вакциной в разных дозах (цельная, 1/4 и 1/16 от цельной дозы) по 0,4 см3 на голову (по 13 особей на каждую дозу вакцины). Одиннадцать контрольных мышей не вакцинировали. Кровь отбирали пулами на 14 и 21-е сут после вакцинации. Результаты представлены в таблице 3. Как и в опыте с КРС, тест-система SAT2/XIV-ВНИИЗЖ демонстрировала бóльшую чувствительность по сравнению с другими тест-системами для топотипа SAT2/VII.
Вакцина, содержащая антиген вируса ящура штамма SAT-2/XIV/2023, а также диагностический набор SAT2/XIV-ВНИИЗЖ для сопровождения вакцины были испытаны в полевых условиях, а именно в Иордании. По информации, предоставленной иорданской стороной, и моновалентная сорбированная вакцина против ящура, индуцированного вирусом топотипа SAT2/XIV, и гомологичная тест-система для оценки эффективности вакцинации производства ФГБУ «ВНИИЗЖ» демонстрировали убедительные результаты антигенной активности вакцины после двукратной прививки КРС. У всех вакцинированных животных (10 гол.) обнаруживали защитный уровень антител с PIсред. = 84,58 ± 12,56, в то время как у невакцинированного контроля (2 гол.) установлено отсутствие антител к вирусу ящура топотипа SAT2/XIV (PIсред. = 35,34 ± 2,21).
Для подтверждения объективности данных ИФА тестировали 163 образца сыворотки крови свиней и КРС c использованием следующих тест-систем: SAT2/XIV-ВНИИЗЖ, SAT2/VII-ВНИИЗЖ, SAT2-IZSLER. Результаты параллельных исследований сывороток крови до и после вакцинации цельной дозой против ящура, вызванного возбудителями топотипов SAT2/XIV (вакцина на основе штамма SAT-2/XIV/2023) и SAT2/VII (вакцины на основе штаммов SAT2/LIB/39/2012 и SAT2/ERI/98), а также после заражения вирусом ящура штамма SAT2/ERI/98 представлены в таблице 4.
Как показывает анализ полученных данных, тест-системы демонстрировали выраженную топотипоспецифичность при тестировании данной выборки образцов. Сыворотки крови КРС против антигена вируса ящура штамма SAT-2/XIV/2023 при использовании тест-системы SAT2/XIV-ВНИИЗЖ имели положительный статус в 100% случаев, в реакции ИФА SAT2/VII-ВНИИЗЖ и SAT2-IZSLER – в 80 и 60% случаев соответственно. В то время как серопозитивность животных в отношении вируса ящура серотипа SAT2 топотипа VII в тест-системах SAT2/VII-ВНИИЗЖ и SAT2-IZSLER была установлена на уровне 91,27 и 93,2% соответственно, в тест-системе SAT2/XIV-ВНИИЗЖ – на уровне 84,1%.
Определение диагностических характеристик тест-системы SAT2/XIV-ВНИИЗЖ. При валидации SAT2/XIV-ВНИИЗЖ такие основные диагностические характеристики, как чувствительность, специфичность, точность и κ-критерий, определяли, как описано ранее [20]. В таблице 5 приведены данные статистической обработки результатов тестирования в ИФА 301 образца сыворотки крови, полученного от невакцинированного и вакцинированного против ящура, вызванного вирусом топотипа SAT2/XIV КРС.
Как видно из полученных результатов, значения диагностической чувствительности в 90%, диагностической специфичности в 98%, диагностической точности в 95% иммуноферментной тест-системы SAT2/XIV-ВНИИЗЖ определили высокую степень согласованности результатов реакции ИФА с известным диагностическим статусом обследуемых животных (κ-критерий – 0,896).
В настоящее время достоверно известно лишь об одной представленной на мировом рынке наборов для ретроспективной диагностики ящура тест-системе, позволяющей обнаруживать антитела к структурным белкам вируса ящура серотипа SAT 2 в ИФА. Это набор Solid-phase competitive ELISA for antibodies specific to FMDV serotype SAT 2 производства IZSLER & The Pirbright Institute (Италия/Великобритания) [21].
Использование моноклональных антител в диагностических иммуноферментных тест-системах для серотипирования возбудителя ящура обусловливает универсальность анализа внутри конкретного серотипа вируса ящура (возможность с одинаковой чувствительностью обнаружения в исследуемых образцах антител к разным штаммам вируса ящура одного серотипа), то есть тест-система должна обладать широкой серотипоспецифичностью.
Однако в случае с тест-системой SAT2-IZSLER наблюдалась выраженная топотипоспецифичность. При исследовании с помощью SAT2-IZSLER образцов моноспецифической сыворотки крови КРС или свиней к вирусу ящура топотипов SAT2/VII и SAT2/XIV наибольшее количество положительных результатов было получено для образцов сыворотки к топотипу SAT2/VII, в то время как антитела к топотипу SAT2/XIV выявлялись с меньшей эффективностью, чем в тест-системе SAT2/XIV-ВНИИЗЖ. Это свидетельствует о том, что использование набора SAT2-IZSLER для изучения антигенной и иммуногенной активности противоящурной вакцины, включающей антиген вируса ящура штамма SAT-2/XIV/2023,
не позволяет дать объективную и достоверную оценку эффективности вакцины методом ИФА. Таким образом, иммуноферментная тест-система для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV, имеющая 100%-ю степень гомологии с вакцинным штаммом, обладающая высокими диагностическими показателями, является незаменимым, безальтернативным на данный момент инструментом оценки качества вакцины в ИФА.
Рис. 1. Аминокислотные последовательности полипептида VP1 вируса ящура серотипа SAT 2 топотипов XIV и VII из баз данных NCBI и ФГБУ «ВНИИЗЖ» (до 216 а. о.), красным цветом выделена зона G-H loop
Fig. 1. Amino acid sequences of VP1 polypeptide of serotype SAT 2 topotype XIV and VII FMDV obtained from NCBI and Federal Centre for Animal Health databases (up to 216 a.r.), G-H loop area is highlighted in red

Рис. 2. Расположение штамма SAT-2/XIV/2023 на филогенетическом дереве вируса ящура серотипа SAT 2. Дендрограмма основана на сравнении нуклеотидных последовательностей гена VP1. Топотипы I–XIV выделены квадратными скобками
Fig. 2. Location of SAT-2/XIV/2023 strain on serotype SAT 2 FMDV phylogenetic tree. The dendrogram is based on the comparison of VP1 gene nucleotide sequences. Topotypes I–XIV are in square brackets
Таблица 1
Антигенное родство между штаммами вируса ящура серотипа SAT 2 в реакции нейтрализации, r1
Table 1
Antigenic relatedness of subtype SAT 2 FMDV strains determined in the virus neutralization test, r1
|
Образцы сыворотки крови |
r1сред. в реакции нейтрализации вируса ящура* |
||
|
SAT2/LIB/39/2012 |
SAT2/ERI/98 |
SAT-2/XIV/2023 |
|
|
SAT2/LIB/39/2012 |
1,0 |
0,36 |
0,06 |
|
SAT2/ERI/98 |
0,69 |
1,0 |
0,16 |
|
SAT-2/XIV/2023 |
0,14 |
0,16 |
1,0 |
|
* r1 ≥ 0,3 – близкое родство (close relatedness); r1 < 0,3 – низкое родство (low relatedness). |
|||
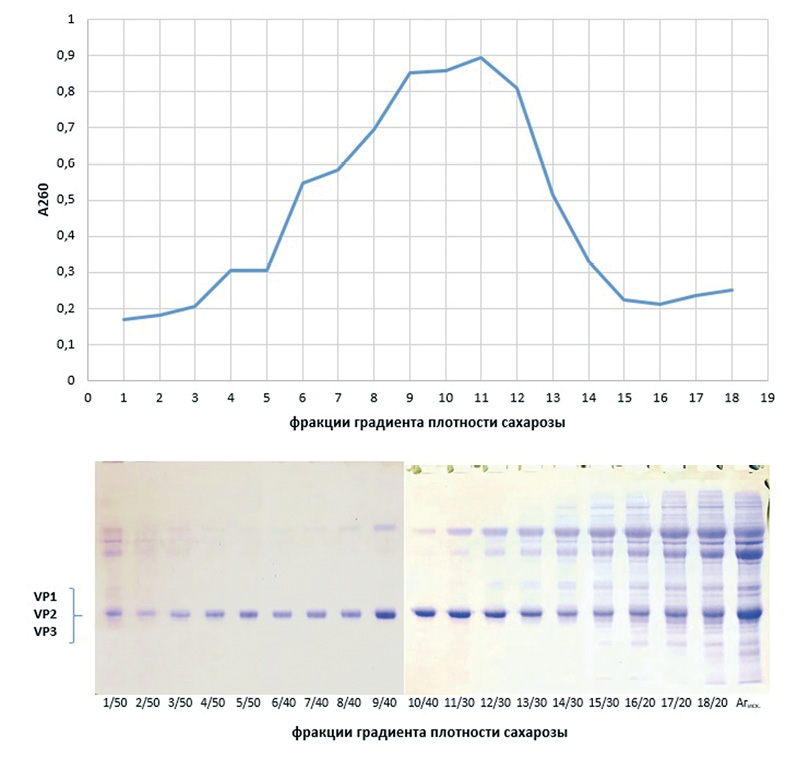
Рис. 3. Выделение 146S-Ag SAT2/XIV в ходе фракционирования AgПЦ SAT2/XIV при ультрацентрифугировании в градиенте плотности сахарозы: А – седиментационный профиль AgПЦ SAT2/XIV при длине волны 260 нм в разведении 1:10; В – электрофореграмма фракций градиента плотности сахарозы, включающих структурные белки VP1, VP2, VP3 вируса ящура штамма SAT-2/XIV/2023
Fig. 3. Isolation of 146S-Ag SAT2/XIV during fractionation of SAT2/XIV Agprecipitate using sucrose gradient ultracentrifugation: A – sedimentation profile of SAT2/XIV Agprecipitate with wavelength 260 nm at 1:10 dilution; B – electrophoregram of sucrose gradient fractions, including structural proteins VP1, VP2, VP3 of SAT-2/XIV/2023 FMDV strain
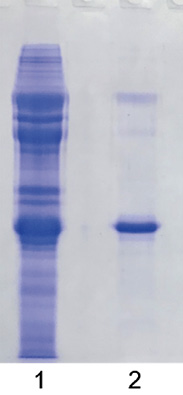
Рис. 4. Электрофорез в 12%-м полиакриламидном геле антигена вируса ящура штамма
SAT-2/XIV/2023: 1 – АgПЦ SAT2/XIV до фракционирования ультрацентрифугированием в градиенте плотности сахарозы; 2 – 146S-Аg SAT2/XIV
Fig. 4. 12% polyacrylamide gel electrophoresis
of SAT-2/XIV/2023 FMDV antigen:
1 – SAT2/XIV Agprecipitate before fractionation by sucrose gradient ultracentrifugation; 2 – 146S-Ag SAT2/XIV
Таблица 2
Результаты исследования в ИФА и РН образцов сыворотки крови КРС, вакцинированного против ящура, индуцированного возбудителем топотипа SAT2/XIV (сорбированная моновалентная вакцина)
Table 2
ELISA and virus neutralizing test results of serum samples collected from cattle vaccinated against SAT2/XIV FMD (adsorbed monovalent vaccine)
|
Образцы сыворотки крови |
Доза вакцины |
Тест-система |
|||
|
SAT2/XIV-ВНИИЗЖ PIpos ≥ 50%, pos/n |
SAT2/VII-ВНИИЗЖ PIpos ≥ 50%, pos/n |
SAT2-IZSLER PIpos ≥ 70%, pos/n |
SAT2/XIV-РН Тpos ВНА ≥ ٥ log2, pos/n |
||
|
SКРС 0 dpv |
до вакцинации |
0/16 |
0/16 |
0/16 |
0/16 |
|
SКРС 3 dpv |
цельная |
0/5 |
0/5 |
0/5 |
0/5 |
|
1/4 |
0/5 |
0/5 |
0/5 |
0/5 |
|
|
1/16 |
0/5 |
0/5 |
0/5 |
0/5 |
|
|
контроль |
0/1 |
0/1 |
0/1 |
0/1 |
|
|
SКРС 7 dpv |
цельная |
1/5 |
0/5 |
0/5 |
0/5 |
|
1/4 |
1/5 |
0/5 |
0/5 |
0/5 |
|
|
1/16 |
1/5 |
1/5 |
0/5 |
0/5 |
|
|
контроль |
0/1 |
0/1 |
0/1 |
0/1 |
|
|
SКРС 14 dpv |
цельная |
5/5 |
4/5 |
3/5 |
3/5 |
|
1/4 |
4/5 |
2/5 |
1/5 |
3/5 |
|
|
1/16 |
2/5 |
1/5 |
0/5 |
1/5 |
|
|
контроль |
0/1 |
0/1 |
0/1 |
0/1 |
|
|
SКРС 21 dpv |
цельная |
5/5 |
4/5 |
3/5 |
4/5 |
|
1/4 |
4/5 |
1/5 |
1/5 |
2/5 |
|
|
1/16 |
2/5 |
1/5 |
0/5 |
1/5 |
|
|
контроль |
0/1 |
0/1 |
0/1 |
0/1 |
|
|
SКРС – сыворотки крови КРС (bovine sera); PI – процент ингибиции (inhibition percent); Тpos ВНА – положительный (защитный) титр вируснейтрализующих антител (positive (protective) titre of virus neutralizing antibodies); pos/n – количество положительно реагирующих особей к общему количеству животных в группе (number of positive reactors against total number of the animals in the group); dpv – дни после вакцинации (day post vaccination). |
|||||
Таблица 3
Результаты исследования в ИФА образцов сыворотки крови белых мышей, иммунизированных сорбированной моновалентной вакциной против ящура, вызванного вирусом топотипа SAT2/XIV
Table 3
ELISA results of serum samples collected from white mice immunized with an adsorbed monovalent vaccine against SAT2/XIV FMDV
|
Образцы сыворотки крови |
Доза вакцины |
Тест-система |
||
|
SAT2/XIV-ВНИИЗЖ PIpos ≥ 50% |
SAT2/VII- ВНИИЗЖ PIpos ≥ 50% |
SAT2-IZSLER PIpos ≥ 70% |
||
|
Sмыши 14 dpv |
цельная |
67,5% |
64,4% |
30,6% |
|
1/4 |
64,9% |
50,1% |
14,9% |
|
|
1/16 |
21,1% |
5,9% |
22,3% |
|
|
Sмыши 21 dpv |
цельная |
71,6% |
65,3% |
32,5% |
|
1/4 |
63,5% |
48,0% |
43,7% |
|
|
1/16 |
12,5% |
1,7% |
1,8% |
|
|
контроль |
6,1% |
0,35% |
2,4% |
|
|
Sмыши – сыворотки крови белых мышей (white mouse sera); PI – процент ингибиции (inhibition percent); dpv – дни после вакцинации (day post vaccination); |
||||
Таблица 4
Результаты исследования в ИФА образцов сыворотки крови КРС и свиней до и после вакцинации против ящура,
индуцированного возбудителем серотипа SAT 2, и заражения
Table 4
ELISA results of serum samples collected from cattle and pigs before and after vaccination against serotype SAT 2 FMD and challenge
|
Образцы сыворотки крови |
Тест-система |
||||||||
|
SAT2/XIV-ВНИИЗЖ PIpos ≥ 50% |
SAT2/VII-ВНИИЗЖ PIpos ≥ 50% |
SAT2-IZSLER PIpos ≥ 70% |
|||||||
|
PIсред. |
pos/n |
SP, % |
PIсред. |
pos/n |
SP, % |
PIсред. |
pos/n |
SP, % |
|
|
Sсвин. 0 dpv |
23,2 |
0/16 |
– |
13,9 |
0/16 |
– |
22,3 |
0/16 |
– |
|
SКРС 0 dpv |
25,1 |
0/37 |
– |
30,3 |
0/37 |
– |
20,2 |
0/37 |
– |
|
Sсвин. 16–28 dpv SAT2/LIB/39/2012 |
68,2 |
28/30 |
93,3 |
83,7 |
29/30 |
96,7 |
90,2 |
29/30 |
96,7 |
|
SКРС 14–35 dpv SAT2/LIB/39/2012 |
70,1 |
14/15 |
93,3 |
89,5 |
15/15 |
100,0 |
87,6 |
15/15 |
100,0 |
|
SКРС 21–45 dpv/dpi SAT2/ERI/98 |
59,5 |
23/35 |
65,7 |
80,3 |
27/35 |
77,1 |
89,1 |
29/35 |
82,9 |
|
SКРС 14–21 dpv SAT-2/XIV/2023 |
76,8 |
30/30 |
100,0 |
63,8 |
24/30 |
80,0 |
72,6 |
18/30 |
60,0 |
|
SКРС – сыворотки крови КРС (bovine sera); Sсвин. – сыворотки крови свиней (porcine sera); PI – процент ингибиции (inhibition percent); |
|||||||||
Таблица 5
Диагностические характеристики тест-систем для обнаружения антител к структурным белкам вируса ящура серотипа SAT 2, определенные для топотипа SAT2/XIV
Table 5
Diagnostic parameters of the test systems for detecting antibodies to SAT 2 FMDV structural proteins, defined for the SAT2/XIV topotype
|
Используемые тест-системы |
Диагностические характеристики (n = ٣01), значение (9٥٪-й доверительный интервал) |
|||
|
чувствительность |
специфичность |
точность |
κ-критерий* |
|
|
SAT2/XIV-ВНИИЗЖ |
90,24% (83,58–94,86%) |
98,31% (95,15–99,65%) |
95,02% (91,91–97,18%) |
0,896 |
|
SAT2/VII-ВНИИЗЖ |
55,0% (41,6–67,9%) |
98,1% (89,9–100,0%) |
75,2% (66,2–82,9%) |
0,516 |
|
SAT2-IZSLER |
40,0% (27,6–53,5%) |
100,0% (93,3–100,0%) |
68,1% (58,7–76,6%) |
0,385 |
|
* κ-критерий – согласованность результатов тестирования индивидуальных образцов сыворотки крови в ИФА с диагностическим статусом животных (consistency between ELISA test results of individual serum samples and the animals’ diagnostic status): < 0 – нет согласованности (no consistency); |
||||
ЗАКЛЮЧЕНИЕ
Разработанная тест-система на основе жидкофазного блокирующего варианта ИФА для определения антител к структурным белкам вируса ящура топотипа SAT2/XIV является специфичной и чувствительной. Уникальность тест-системы состоит в 100%-й степени гомологии с вакцинными продуктами, что позволяет максимально достоверно и эффективно оценивать антигенные и иммуногенные свойства противоящурной вакцины при ее производстве и последующем применении после введения животным. При испытаниях данная тест-система характеризовалась высокими значениями диагностической чувствительности (90%), диагностической специфичности (98%), диагностической точности (95%), что определяло высокую степень согласованности результатов реакции ИФА с известным диагностическим статусом обследуемых животных (κ-критерий – 0,896).
Список литературы
1. WOAH. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 13th ed. 2024. https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/A_summry.htm
2. Феррари Д., Пейтон Д., Дуффи С., Бартелс К., Найт-Джонс Т. Вакцинация против ящура и поствакцинальный мониторинг: руководство. Под ред. С. Метвалли, С. Мюнстерманн. Рим: ФАО, ВОЗЖ; 2020. 88 с. https://openknowledge.fao.org/handle/20.500.14283/i5975ru
3. Луговская Н. Н., Силантьева Е. А., Михалишин Д. В., Мороз Н. В., Малыгин М. П., Харитонова А. А. и др. Диагностическая тест-система для выявления антител к структурным белкам вируса ящура генотипа SAT2/VII в жидкофазном блокирующем варианте ИФА. Актуальные вопросы ветеринарной биологии. 2023; (4): 43–52. https://doi.org/10.24412/2074-5036-2023-4-43-52
4. ProMED, International society for infectious diseases. https://promedmail.org/promed-post/?id=20230204.8708168
5. Михалишин Д. В., Доронин М. И., Чвала И. А., Борисов А. В., Харитонова А. А., Гочмурадов Ы. М. и др. Вакцина против ящура генотипа SAT-2/XIV из штамма «SAT-2/XIV/2023» культуральная инактивированная эмульсионная. Патент № 2824660 Российская Федерация, МПК A61K 39/135 (2006.01). ФГБУ «Федеральный центр охраны здоровья животных». № 2024108919. Заявл. 03.04.2024. Опубл. 12.08.2024. Бюл. № 23.
6. Никифоров В. В., Доронин М. И., Борисов А. В., Чвала И. А., Михалишин Д. В., Фомина С. Н. и др. Штамм «SAT-2/XIV/2023» вируса ящура Aphtae epizooticae генотипа SAT-2/XIV для изготовления биопрепаратов для диагностики и специфической профилактики ящура. Патент № 2817257 Российская Федерация, МПК C12N 7/00 (2006.01). ФГБУ «Федеральный центр охраны здоровья животных». № 2023123055. Заявл. 04.09.2023. Опубл. 12.04.2024. Бюл. № 11.
7. Knowles N. J., Wadsworth J., Hicks H. M., Polo N., Mioulet V., Gizaw D., King D. P. Genome sequences of SAT 2 foot-and-mouth disease viruses belonging to topotype XIV. Submitted (28-FEB-2023) Vesicular Disease Reference Laboratory Group, The Pirbright Institute, United Kingdom. https://www.ncbi.nlm.nih.gov/protein/WKE35516.1
8. Knowles N. J., Wadsworth J., Hicks H. M., Polo N., Mioulet V., Gizaw D., King D. P. Genome sequences of SAT 2 foot-and-mouth disease viruses belonging to topotype XIV. Submitted (28-FEB-2023) Vesicular Disease Reference Laboratory Group, The Pirbright Institute, United Kingdom. https://www.ncbi.nlm.nih.gov/protein/WKE35517.1
9. Abualghusein I. H. M., Ababneh M. M. K., Al-Zghoul M. B., Alghizzawi D. A. A., Aboomer H. A. A. Submitted (07-JAN-2024) Basic Veterinary Science, Jordan University of Science and Technology, Jordan. https://www.ncbi.nlm.nih.gov/protein/WUR05443.1
10. Sahle M., Venter E. H., Dwarka R. M., Vosloo W. Genetic heterogeneity of SAT-2 type foot-and-mouth disease viruses in East Africa. Submitted (17-JUL-2003) Veterinary Tropical Diseases, Faculty of Veterinary Science, University of Pretoria, South Africa. https://www.ncbi.nlm.nih.gov/protein/AAR09103
11. Ahmed H. A., Salem S. A. H., Habashi A. R., Arafa A. A., Aggour M. G. A., Salem G. H., et al. Emergence of foot-and-mouth disease virus SAT 2 in Egypt during 2012. Transboundary and Emerging Diseases. 2012; 59 (6): 476–481. https://doi.org/10.1111/tbed.12015
12. Hassan A. M., El-Mayet F. S., El-Habbaa A. S., Shahein M. A., El Zowalaty M. E., Hagag N. M., Sharawi S. S. A. Molecular characterization of newly emerging foot-and-mouth disease virus serotype SAT 2 of Lib-12 lineage isolated from Egypt. Virus Research. 2022; 311: 198651. https://doi.org/10.1016/j.virusres.2021.198651
13. Hosein H. I., Rouby S. R., Hendy K. Submitted (23-MAY-2019) Veterinary Medicine, Faculty of Veterinary Medicine, Egypt. https://www.ncbi.nlm.nih.gov/protein/QEI49588.1
14. Abdulrahman D. A., Shaheen M. A., El-Deeb A. H., Shafik N. G., Hussein H. A. Characterization of FMDVs from vaccinated cattle and buffaloes in Egypt 2015–2017. Submitted (20-NOV-2017) Virology, Animal Health Research Institute (AHRI), Egypt. https://www.ncbi.nlm.nih.gov/protein/AXR97922.1
15. Laemmli U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227: 680–685. https://doi.org/10.1038/227680a0
16. Lugovskaya N. N., Scherbakov A. V., Yakovleva A. S., Tsyvanyuk M. A., Mudrak N. S., Drygin V. V., Borisov A. V. Detection of antibodies to avian infectious virus by a recombinant nucleocapsid protein-based enzyme-linked immunosorbent assay. Journal of Virological Methods. 2006; 135 (2): 292–296. https://doi.org/10.1016/j.jviromet.2006.03.019
17. Hamblin C., Barnett I. T. R., Hedger R. S. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus: I. Development and method of ELISA. Journal of Immunological Methods. 1986; 93 (1): 115–121. https://doi.org/10.1016/0022-1759(86)90441-2
18. Hamblin C., Barnett I. T. R., Crowther J. R. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus: II. Application. Journal of Immunological Methods. 1986; 93 (1): 123–129. https://doi.org/10.1016/0022-1759(86)90442-4
19. Hamblin C., Kitching R. P., Donaldson A. I., Crowther J. R., Barnett I. T. R. Enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus: III. Evaluation of antibodies after infection and vaccination. Epidemiology and Infection. 1987; 99 (3): 733–744. https://doi.org/10.1017/S0950268800066590
20. Луговская Н. Н., Калинина Е. Н., Малкова К. С., Воробьева О. В., Горячева Г. М., Майорова Т. К. Валидация методики определения уровня противоящурных антител в реакции жидкофазного блокирующего «сэндвич»-варианта иммуноферментного анализа. Ветеринария сегодня. 2015; (3): 22–29. https://elibrary.ru/umsjvj
21. Dho G., Grazioli S., Bugnetti M., Pezzoni G., Maree F. F., Esterhuysen J., et al. Ready-to-use kits for detection of antibody to FMDV serotypes SAT1 and SAT2. Open session of the Standing Technical and Research Committees of the EuFMD (Cavtat, Croatia; October 29–31, 2014). https://www.fao.org/fileadmin/user_upload/eufmd/Open_Session_2014PPTS/Parallel29oct/WPar8.pdf
Об авторах
Н. Н. ЛуговскаяРоссия
Луговская Наталия Николаевна - канд. биол. наук, ведущий научный сотрудник лаборатории профилактики ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Ю. С. Елькина
Россия
Елькина Юлия Сергеевна - канд. вет. наук, младший научный сотрудник лаборатории профилактики ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
М. А. Шевченко
Россия
Шевченко Максим Александрович - канд. вет. наук, младший научный сотрудник лаборатории профилактики ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Ы. М. Гочмурадов
Россия
Гочмурадов Ыхлас Мурадович - ветеринарный врач лаборатории профилактики ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Н. Д. Клюкина
Россия
Клюкина Надежда Дмитриевна - канд. вет. наук, старший научный сотрудник лаборатории профилактики ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Д. В. Михалишин
Россия
Михалишин Дмитрий Валерьевич - д-р вет. наук, главный эксперт по вакцинопрофилактике ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
А. В. Борисов
Россия
Борисов Алексей Валерьевич - канд. вет. наук, заведующий лабораторией профилактики ящура ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Рецензия
Для цитирования:
Луговская Н.Н., Елькина Ю.С., Шевченко М.А., Гочмурадов Ы.М., Клюкина Н.Д., Михалишин Д.В., Борисов А.В. Разработка и применение иммуноферментной тест-системы для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV. Ветеринария сегодня. 2025;14(3):283-293. https://doi.org/10.29326/2304-196X-2025-14-3-283-293
For citation:
Lugovskaya N.N., El’kina Yu.S., Shevchenko M.A., Gochmuradov Y.M., Klyukina N.D., Mikhalishin D.V., Borisov A.V. Development and application of ELISA test system for assessing humoral immunity against SAT2 topotype XIV foot-and-mouth disease virus. Veterinary Science Today. 2025;14(3):283-293. https://doi.org/10.29326/2304-196X-2025-14-3-283-293
JATS XML



































