Перейти к:
Антибиотикорезистентность бактерий рода Salmonella, выявленных в продукции животного происхождения в 2022–2024 гг.
https://doi.org/10.29326/2304-196X-2025-14-3-310-318
Аннотация
Введение. Несмотря на тот факт, что антибиотики – величайшее открытие человечества, они могут нанести огромный ущерб и привести к серьезным последствиям при нецелесообразном использовании.
Цель исследования. Исследование образцов животноводческой продукции с последующим выделением изолятов бактерий рода Salmonella, их типированием, определением и оценкой динамики развития антибиотикорезистентности.
Материалы и методы. Работу выполняли на базе отдела микробиологических исследований Владимирской испытательной лаборатории ФГБУ «ВНИИЗЖ». Для определения устойчивости бактерий к антибиотикам применяли диско-диффузионный метод. Значения зон задержки роста микроорганизмов интерпретировались согласно российским рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам» (МАКМАХ, версия 2025-01), подготовленным на основе рекомендаций Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST) и с использованием стандарта CLSI M100. Серологическую идентификацию проводили с помощью моно- и поливалентных О- и Н-сывороток «ПЕТСАЛ»® (ФГУП СПбНИИВС ФМБА России). Гены антибиотикорезистентности (blaCTX-M, blaOXA10, blaDHA, blaGES, blaKPC, blaOXA48-like, blaNDM, blaVIM) определяли методом полимеразной цепной реакции в режиме реального времени с применением тест-систем серии «РЕЗИСТОМ» (ООО НПФ «Литех», Россия).
Результаты. При исследовании образцов продукции животного происхождения в 2022–2024 гг. выявлено 42 изолята бактерий рода Salmonella. Наиболее часто детектируемый изолят – S. Enteritidis, а превалирующий продукт, в котором обнаруживали бактерии рода Salmonella, – продукция из мяса птицы. Выявленные изоляты имели максимальную резистентность к бензилпенициллину, эритромицину, норфлоксацину и тетрациклину. Большинство из них проявили множественную устойчивость сразу к нескольким антимикробным препаратам. Отмечен рост резистентности к цефалоспоринам, фторхинолонам, тетрациклинам, аминогликозидам, хлорамфениколу/левомицетину и сульфаметоксазолу/триметоприму. При исследовании методом полимеразной цепной реакции в режиме реального времени гены антибиотикорезистентности не обнаружены.
Заключение. Показано значительное распространение устойчивости к антимикробным препаратам, в том числе множественной, среди изолятов бактерий рода Salmonella, выявленных в продукции животного происхождения в 2022–2024 гг.
Ключевые слова
Для цитирования:
Акулич О.А., Шадрова Н.Б., Денисова Г.С. Антибиотикорезистентность бактерий рода Salmonella, выявленных в продукции животного происхождения в 2022–2024 гг. Ветеринария сегодня. 2025;14(3):310-318. https://doi.org/10.29326/2304-196X-2025-14-3-310-318
For citation:
Akulich O.A., Shadrova N.B., Denisova G.S. Antimicrobial resistance of Salmonella spp. detected in animal products in 2022–2024. Veterinary Science Today. 2025;14(3):310-318. https://doi.org/10.29326/2304-196X-2025-14-3-310-318
ВВЕДЕНИЕ
В 2024 г. Всемирная организация здравоохранения (ВОЗ) опубликовала список 24 резистентных к антибиотикам бактериальных патогенов, среди которых особенно выделяются грамотрицательные бактерии, устойчивые к противомикробным препаратам последнего поколения, в том числе бактерии рода Salmonella [1].
Антибиотикорезистентность – это проблема, затрагивающая все страны и требующая скоординированного подхода и действий на всех уровнях: здравоохранение, сельское хозяйство, окружающая среда, производство продуктов питания (в 2019 г., по данным ВОЗ, проблема вошла в десятку основных угроз глобальному здравоохранению) [2-4].
Некорректное и бесконтрольное использование антибиотиков является основным фактором, ведущим к развитию устойчивости к противомикробным препаратам. Особенно подвержены риску работники сельского хозяйства, учитывая тот факт, что в этой отрасли используется до 50–80% всех антибиотиков [5][6].
В связи с тем, что здоровье человека, животных, растений и окружающей среды, в том числе экосистем, тесно взаимосвязано и взаимозависимо, для борьбы с устойчивостью к противомикробным препаратам объединились ВОЗ, ФАО (Продовольственная и сельскохозяйственная организация Объединенных Наций), ЮНЕП (Программа Организаций Объединенных Наций по окружающей среде) и ВОЗЖ (Всемирная организация здравоохранения животных) в рамках концепции «Единое здоровье». ВОЗ создала Глобальную систему надзора за устойчивостью к противомикробным препаратам и их применением (GLASS) с единой методологией, а также в 2001 г. опубликовала Глобальную стратегию ВОЗ по сдерживанию резистентности к противомикробным препаратам. В 2022 г. ВОЗ была запущена Глобальная стратегия геномного эпиднадзора за возбудителями болезней, обладающих пандемическим и эпидемическим потенциалом, 2022–2032 гг. [7].
В рамках борьбы с устойчивостью к препаратам ФАО опубликовала призыв полностью отказаться от применения антибиотиков в целях профилактики и в качестве стимуляторов роста в животноводстве и аквакультуре. Наряду с этим комиссией ФАО/ВОЗ по стандартам на пищевые продукты «Кодекс Алиментариус» были приняты жесткие нормативы предельно допустимых уровней остаточного содержания лекарственных препаратов.
Кроме того, в рамках 79-й сессии Генеральной Ассамблеи Организации Объединенных Наций мировые лидеры приняли политическую декларацию, в которой взяли на себя обязательство по достижению четких целей, связанных с борьбой с устойчивостью к лекарственным препаратам.
В России проблема антибиотикорезистентности также обозначена на законодательном уровне. В 2017 г. распоряжением Правительства РФ № 2045-р была утверждена «Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года», которая определила государственную политику по ограничению распространения устойчивости микроорганизмов. В 2024 г. распоряжением Правительства РФ № 2214-р был утвержден план мероприятий на 2025–2030 гг. по реализации указанной стратегии, включающий вопросы нормативно-правового регулирования, информирования населения, системного мониторинга и другие, связанные с антибиотикорезистентностью.
Наряду с этим с 2022 г. в сфере ветеринарии действует перечень лекарственных препаратов, в отношении которых вводится ограничение на применение в лечебных целях (утвержден приказом Минсельхоза России от 18.11.2021 № 771), а с 2025 г. вступил в силу порядок назначения лекарственных препаратов для ветеринарного применения и перечень лекарственных средств для ветеринарного применения, отпускаемых по рецепту (утвержден приказом Минсельхоза России от 02.11.2022 № 776).
В 2024 г. в г. Москве была проведена первая Международная конференция БРИКС по антимикробной резистентности.
С целью контроля остаточного содержания лекарственных средств в пищевой продукции решением Совета Евразийской экономической комиссии от 23.06.2023 № 70 были внесены изменения в технические регламенты Таможенного союза, касающиеся установления допустимых уровней к 75 препаратам, а также новых требований представления информации о применяемых ветпрепаратах.
Одной из противодействующих мер в вопросах распространения антибиотикорезистентности является постоянное наблюдение за изменением чувствительности патогенов к антимикробным препаратам. С целью проведения анализа данных резистентности к антибактериальным лекарственным средствам в России существует онлайн-платформа AMRmap и другие AMR-сервисы: веб-продукты, посвященные вопросам антимикробной резистентности.
Бактерии рода Salmonella являются одной из четырех основных причин диарейных болезней во всем мире. Ежегодно заболевания, вызываемые исключительно бактериями рода Salmonella, уносят жизни более 200 000 человек во всем мире [8][9].
В течение последних 10 лет в Российской Федерации проблема сальмонеллезов продолжает оставаться актуальной ввиду существующих рисков инфицирования в условиях интенсивно развивающегося сельского хозяйства. Так, согласно государственным докладам Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека в 2024 г. в РФ заболеваемость сальмонеллезом составила 24,68 случая на 100 тыс. населения; в 2023 г. – 21,45 случая; в 2022 г. – 17,10 случая и в 2021 г. – 13,61 случая на 100 тыс. населения1 2 3 4.
Наиболее часто выявляемыми сероварами, вызывающими заболевания во всех странах, остаются: S. Enteritidis, S. Typhimurium и S. Infantis. Частота выделения других сероваров зависит от региона [10][11].
В настоящее время происходит увеличение числа устойчивых к лечению антибиотиками инфекций, в том числе вызванных бактериями рода Salmonella. Вместе с тем резистентные к лекарственным препаратам бактерии рода Salmonella представляют значительную угрозу для жизни населения и животного мира из-за своей широкой распространенности и способности заражать в том числе воду. Пищевая продукция – основной фактор передачи возбудителей сальмонеллеза [12-14].
Учитывая изложенное, целью работы было исследование образцов животноводческой продукции из трех регионов Центральной России (Владимирская, Костромская и Ивановская области) с последующим выделением изолятов бактерий рода Salmonella, типированием, определением и оценкой динамики антибиотикорезистентности в период с 2022 по 2024 г.
МАТЕРИАЛЫ И МЕТОДЫ
Работу проводили в отделе микробиологических исследований Владимирской испытательной лаборатории ФГБУ «ВНИИЗЖ». Использовали 42 изолята бактерий рода Salmonella, выделенных из продукции животного происхождения в 2022–2024 гг.
Реактивы и питательные среды: забуференная пептонная вода (HiMedia Laboratories Pvt Ltd., Индия), магниевая среда Раппапорта – Вассилиадиса (RVS-бульон; Merck KGaA, Германия), селенитовый бульон (Merck KGaA, Германия), триптон-соевый агар (TSA; Scharlau, Испания), ксилозо-лизиновый дезоксихолатный агар (ХLD-агар; ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии», Россия), висмут-сульфитный агар (VSA; Merck KGaA, Германия), агар Мюллера – Хинтона (МHA; ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии», Россия).
Микробиологический анализ проводили по ГОСТ 31659-2012 «Продукты пищевые. Метод выявления бактерий рода Salmonella». Навеску продукта (25 г) вносили в стерильный пакет с забуференной пептонной водой объемом 225 см3, гомогенизировали 1 мин и инкубировали при температуре 37 °С в течение 18–20 ч.
Полученные культуры пересевали (1 см3) в среды для селективного обогащения: RVS-бульон (10 см3) и селенитовый бульон (10 см3) – и инкубировали в течение 24 ч при температуре (41,5 ± 1,0) °С и 37 °С соответственно. Затем из каждой пробирки делали пересев штрихом бактериологической петлей согласно ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов» на две селективные агаризованные среды: XLD-arap и VSA – с последующим инкубированием при температуре 37 °С в течение (24 ± 3) ч.
Для идентификации отобранных колоний с ростом, характерным для бактерий рода Salmonella, и получения изолированных колоний осуществляли пересев с последующим культивированием на поверхности подсушенного TSA с дрожжевым экстрактом при температуре 37 °С в течение (24 ± 3) ч.
Принадлежность выросших колоний к бактериям рода Salmonella подтверждали посредством биохимических тестов API 20E (bioMérieux, Франция) и иммуноферментного анализа с использованием анализатора Mini Vidas (bioMérieux, Франция).
Серологическая идентификация. В рамках работы была проведена серологическая идентификация изолятов бактерий рода Salmonella, выделенных с применением реакции агглютинации на стекле с моно- и поливалентными О- и Н-сыворотками сухими диагностическими адсорбированными промышленного производства «ПЕТСАЛ»® (ФГУП СПбНИИВС ФМБА России). Серологический вариант штамма определялся на основании серологической формулы в соответствии со схемой Кауфмана – Уайта согласно МУ 4.2.4070-24
«Лабораторная диагностика сальмонеллезов, обнаружение сальмонелл в пищевых продуктах и объектах окружающей среды: методические указания» (утверждены Главным государственным санитарным врачом РФ 27.09.2024).
Определение антибиотикорезистентности. Чувствительность к антимикробным препаратам выделенных изолятов бактерий рода Salmonella определяли диско-диффузионным методом согласно МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам: методические указания».
Антибиотики (бумажные диски производства ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера», Россия): азитромицин 15 мкг, амикацин 30 мкг, амоксициллин 20 мкг, ампициллин/сульбактам 10 мкг, бензилпенициллин 10 ЕД/6 мкг, гентамицин 10 мкг, доксициклин 30 мкг, имипенем 10 мкг, канамицин 30 мкг, левофлоксацин 5 мкг, меропенем 10 мкг, норфлоксацин 10 мкг, сульфаметоксазол/триметоприм 23,75/1,25 мкг, стрептомицин 10 мкг, тетрациклин 30 мкг, хлорамфеникол/левомицетин 30 мкг, цефазолин 30 мкг, цефотаксим 30 мкг, цефуроксим 30 мкг, ципрофлоксацин 5 мкг, эритромицин 15 мкг.
Для определения антибиотикорезистентности использовали бактериальную суспензию с оптической плотностью 0,5 по стандарту МакФарланда, приготовленную из суточной культуры изолятов бактерий рода Salmonella, выросших на TSA. Плотность суспензии измеряли с помощью денситометра VITEK BIOMERIEUX model DENSICHEK (Франция).
В стерильные чашки Петри диаметром 100 мм наливали по 20 мл расплавленного TSA. Бактериальную суспензию не позднее 15 мин после ее приготовления инокулировали на подсушенную поверхность агара МHA с помощью стерильного хлопкового тампона штриховыми движениями без промежутков, затем размещали диски на поверхности агара (4 диска на одну чашку Петри). После аппликации дисков с антибиотиками чашки Петри инкубировали при 37 °С в течение (18 ± 2) ч. Оценку результатов осуществляли по наличию зон задержки роста микроорганизмов вокруг дисков, измеряя с точностью до 1 мм на темной матовой поверхности на расстоянии примерно 30 см от глаз при помощи линейки под углом 45°.
Интерпретацию результатов проводили согласно российским рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам» (МАКМАХ, версия 2025-01), подготовленным на основе рекомендаций Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST), и с использованием стандарта CLSI M100. В настоящее время комплекс подходов к оценке чувствительности и интерпретации результатов, предлагаемый EUCAST, является теоретически наиболее обоснованным [15, 16, 17].
Полимеразная цепная реакция в режиме реального времени. Для выделения ДНК бактерий рода Salmonella в работе использовали набор «Сорб-ГМО-Б» (ЗАО «Синтол», Россия).
Изучение молекулярно-генетических свойств выделенных изолятов бактерий рода Salmonella на наличие генов антибиотикорезистентности (blaCTX-M, blaOXA10, blaDHA, blaGES, blaKPC, blaOXA48-like, blaNDM, blaVIM) было проведено с применением тест-систем серии «РЕЗИСТОМ» (ООО НПФ «Литех», Россия) согласно инструкции производителя.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате исследований образцов продукции животного происхождения выявлено 42 изолята бактерий рода Salmonella: 15 изолятов – в 2022 г., 11 изолятов – в 2023 г., 16 изолятов – в 2024 г.).
Морфологические и культуральные свойства выделенных изолятов бактерий Salmonella были характерны для своего семейства и рода.
На рисунке 1 видно, что в рамках проведенных исследований чаще всего бактерии рода Salmonella обнаруживали в продукции из мяса птицы – 36 изолятов (85,7%), в частности в мясе кур – 24 изолята (57,1%). При этом, по данным Европейского центра профилактики и контроля заболеваний (ECDC), в Европейском союзе наиболее зараженной бактериями рода Salmonella продукцией на этапе распространения являются мясо птицы и полуфабрикаты, приготовленные из мяса птицы. В мясе и мясной продукции из индейки, а также в свинине аналогично определен высокий уровень загрязнения [10][18].
При серологической идентификации было установлено, что большинство изолятов бактерий рода Salmonella относятся к группе О:9 (D1) – 18 (42,9%) и группе О:7 (С1) – 13 (30,9%), еще 7 изолятов (16,7%) – к группе О:4 (В), 4 изолята (9,5%) – к группе О:8 (С2–С3). Результаты отражены на рисунке 2.
При серотипировании среди изолятов бактерий рода Salmonella чаще всего выявляли (рис. 3): S. Enteritidis – 14 (33,3%), S. Blegdam – 3 (7,1%), S. Derby – 2 (4,8%). При этом S. Enteritidis и S. Derby чаще обнаруживали в продукции из утки, а S. Blegdam – в мясе кур. Вместе с тем было установлено, что из 17 нетипируемых изолятов бактерий рода Salmonella (40,5%) 11 (26,2%) приходились на группу О:7 (С1).
В рамках исследования был проведен анализ устойчивости изолятов бактерий рода Salmonella к 21 лекарственному препарату. Полученные результаты представлены на рисунке 4.
Установлен относительно высокий общий уровень резистентности к ряду антибиотиков среди изолятов бактерий рода Salmonella, выделенных из продукции животного происхождения в 2022–2024 гг.
Максимальная частота устойчивости у изолятов бактерий рода Salmonella наблюдалась к эритромицину (80,9%), бензилпенициллину (78,6%), норфлоксацину (69,0%) и тетрациклину (40,5%).
Следует отметить, что все изоляты бактерий рода Salmonella оказались чувствительны к меропенему и имипенему.
В начале 2025 г. был опубликован «Сводный отчет Европейского союза об устойчивости к противомикробным препаратам зоонозных и индикаторных бактерий, обнаруженных у людей, животных и в продуктах питания в 2022–2023 гг.», где также представлена информация о том, что большая часть изолятов Salmonella резистентна в том числе к тетрациклину и сульфаниламидам. Кроме того, в нескольких странах наблюдалась тенденция к росту устойчивости к ципрофлоксацину и цефалоспоринам третьего поколения [19].
Эти и другие исследования [20] говорят о важности мониторинга чувствительности бактерий рода Salmonella ввиду роста резистентности к ряду критически важных противомикробных препаратов.
Наряду с этим в рамках испытаний установлено, что 90% изолятов бактерий рода Salmonella устойчивы более чем к одному антибиотику из исследуемых. Кроме того, 38% изолятов резистентны более чем к трем классам лекарственных средств.
Как видно на рисунке 5, устойчивость сразу к трем антимикробным препаратам продемонстрировали 13 изолятов (31,0%), к двум – 8 изолятов (19,0%), к восьми – 5 изолятов (11,9%).
Также в рамках работы выявлен изолят, резистентный сразу к 16 антибиотикам, и изолят, имеющий устойчивость к 19 антибиотикам из 21 используемого. Оба изолята относятся к группе О:4 (В) и обнаружены в мясе кур.
Как следует из государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2024 году», большинство устойчивых микроорганизмов рода Salmonella были выявлены в мясе птицы, яйцах и продуктах их переработки (97,2%), мясе и мясопродуктах (95,1%)5.
Исследования некоторых авторов также показывают, что большая часть выделяемых из продукции бактерий рода Salmonella резистентны как минимум к одному классу противомикробных препаратов. Так, Европейский центр профилактики и контроля заболеваний (ECDC) информирует о том, что люди, инфицированные Salmonella в Европейском союзе, часто имеют устойчивость к противомикробным препаратам, при этом более чем в 20% случаев – как минимум к трем классам противомикробных препаратов. Вместе с тем, по данным ВОЗ, с каждым годом растет антибиотикорезистентность к фторхинолонам и цефалоспоринам [1][18][21][22].
В настоящее время сообщения о множественной резистентности бактерий рода Salmonella появляются чаще. Изучение бактерий рода Salmonella, детектируемых в свиноводческой продукции, дает информацию о высокой их устойчивости к тетрациклину, стрептомицину и сульфаметоксазолу/триметоприму [23][24].
В ходе работы по исследованию выделенных из свиноводческой продукции бактерий рода Salmonella были получены аналогичные результаты, а также отмечена высокая резистентность к эритромицину 80% изолятов.
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека в государственном докладе за 2024 г. информирует о выявленной устойчивости бактерий рода Salmonella к одному и более лекарственному препарату, при этом наибольшая резистентность устанавливалась к тетрациклину, ципрофлоксацину и сульфаметоксазолу/триметоприму.
Таким образом, чрезмерное использование антибиотиков способствует распространению множественной устойчивости к целому ряду противомикробных препаратов, что влечет за собой более длительное и дорогостоящее лечение, а также летальные исходы и экономические потери, представляя особую опасность [25][26].
Рисунок 6 демонстрирует динамику роста числа изолятов бактерий рода Salmonella, резистентных к антимикробным препаратам одного класса, в период с 2022 по 2024 г.
Для лечения сальмонеллезов наиболее перспективным направлением на протяжении довольно длительного времени остается использование цефалоспоринов, в частности третьего поколения, так как данные лекарственные препараты обладают высокой активностью в отношении бактерий рода Salmonella, устойчивостью к микробным бета-лактамазам, биодоступностью и безвредностью при коротких курсах лечения. Кроме того, к эффективным противомикробным препаратам с хорошим проникновением внутрь клетки относятся фторхинолоны, однако в последнее время к ним во всем мире у бактерий рода Salmonella развивается резистентность [27][28].
В рамках исследования установлено (рис. 6А), что с 2022 г. возросла устойчивость изолятов бактерий рода Salmonella к цефалоспорину первого поколения (цефазолину) – на 18,0% (в 2024 г. было устойчиво 5 изолятов из 16 выделенных – 31,3%), к цефалоспорину второго поколения (цефуроксиму) – на 50,0% (в 2024 г. было устойчиво 8 изолятов из 16 выделенных – 50,0%), к цефалоспорину третьего поколения (цефотаксиму) – на 6,3% (в 2024 г. был устойчив 1 изолят из 16 выделенных – 6,3%, ранее резистентность у изолятов не обнаруживалась).
На рисунке 6B видно, что аналогичная ситуация наблюдалась в отношении норфлоксацина (фторхинолон второго поколения) – рост резистентности на 15,0% (в 2024 г. было устойчиво 12 изолятов из 16 выделенных – 75,0%), а также левофлоксацина (фторхинолон третьего поколения) – рост резистентности на 49,2% (в 2024 г. было устойчиво 10 изолятов из 16 выделенных – 62,5%).
Кроме того, изменилась устойчивость изолятов к хлорамфениколу/левомицетину (увеличение на 37,5%) и сульфаметоксазолу/триметоприму (увеличение на 17,5%) в 2022–2024 гг. (рис. 6C).
Также определили высокий рост устойчивости в 2022–2024 гг. к тетрациклинам (рис. 6D): тетрациклину (первое поколение) – на 29,6% (в 2024 г. было устойчиво 9 изолятов из 16 выделенных – 56,3%), доксициклину (второе поколение) – на 30,0% (в 2024 г. было устойчиво 8 изолятов из 16 выделенных – 50,0%).
При этом было отмечено повышение уровня резистентности микроорганизмов к антибиотикам группы аминогликозидов (рис. 6Е). Так, к амикацину (третье поколение) и канамицину (первое поколение) он вырос на 12,5% (в 2024 г. было устойчиво 2 изолята из 16 выделенных – 12,5%). В то же время значение устойчивости к стрептомицину (первое поколение) повысилось на 10,8% (в 2024 г. было устойчиво 6 изолятов из 16 выделенных – 37,5%).
В рамках работы у выделенных изолятов бактерий рода Salmonella генов антибиотикорезистентности blaCTX-M, blaOXA10, blaDHA, blaGES, blaKPC, blaOXA48-like, blaNDM, blaVIM не обнаружено.

Рис. 1. Распределение частоты выявления изолятов бактерий рода Salmonella в образцах продукции животного происхождения в 2022–2024 гг. по источникам выделения
Fig. 1. Frequency of Salmonella spp. isolate detection in animal product samples in 2022–2024, by isolation source

Рис. 2. Выявление О-групп изолятов бактерий рода Salmonella, выделенных из образцов продукции животного происхождения в 2022–2024 гг.
Fig. 2. Identification of O-groups of Salmonella spp. isolates recovered from samples of animal products in 2022–2024

Рис. 3. Серогрупповая принадлежность изолятов бактерий рода Salmonella, выделенных из образцов продукции животного происхождения в 2022–2024 гг.
Fig. 3. Serotyping of Salmonella spp. isolates recovered from animal product samples in 2022–2024
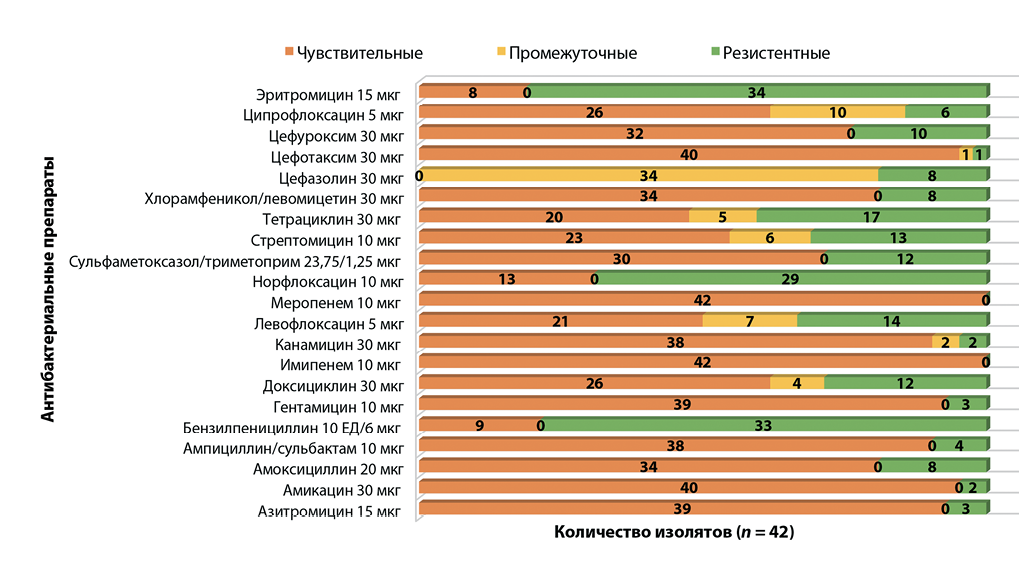
Рис. 4. Антибиотикорезистентность изолятов бактерий рода Salmonella, выделенных из продукции животного происхождения в 2022–2024 гг.
Fig. 4. Antimicrobial resistance of Salmonella spp. isolates recovered from animal products in 2022–2024

Рис. 5. Количество изолятов бактерий рода Salmonella, выделенных из образцов животноводческой продукции в 2022–2024 гг., со множественной антибиотикорезистентностью
Fig. 5. Number of Salmonella spp. isolates demonstrating multiple antimicrobial resistance recovered from animal product samples in 2022–2024

Рис. 6. Резистентность изолятов бактерий рода Salmonella к антибиотикам: А – цефалоспорины, B – фторхинолоны, C – хлорамфеникол/левомицетин и сульфаметоксазол/триметоприм, D – тетрациклины, E – аминогликозиды
Fig. 6. Resistance of Salmonella spp. isolates to the following antibiotics: A – cephalosporins, B – fluoroquinolones, C – chloramphenicol/levomycetin and sulfamethoxazole/trimethoprim, D – tetracyclines, E – aminoglycosides
ЗАКЛЮЧЕНИЕ
При проведении исследования было выявлено 42 изолята бактерий рода Salmonella, при этом превалирующими серовароми являлись: S. Enteritidis – 14 (33,3%), S. Blegdam – 3 (7,1%), S. Derby – 2 (4,8%).
Показано значительное распространение устойчивости, в том числе множественной. При этом изоляты бактерий рода Salmonella имели максимальную резистентность к эритромицину (80,9%), бензилпенициллину (78,6%), норфлоксацину (69,0%) и тетрациклину (40,5%). Также все изоляты бактерий рода Salmonella были чувствительны к меропенему и имипенему.
Большинство изолятов бактерий рода Salmonella проявили устойчивость сразу к трем антимикробным препаратам (31,0%), также обнаружен изолят, имеющий устойчивость сразу к 19 антибиотикам из 21 используемого в рамках исследования.
Кроме того, отмечен рост резистентности среди изолятов бактерий рода Salmonella к цефалоспоринам: первого поколения (цефазолину) – на 18,0%, второго поколения (цефуроксиму) – на 50,0%, третьего поколения (цефотаксиму) – на 6,3%; к фторхинолонам: второго поколения (норфлоксацину) – на 15,0%, третьего поколения (левофлоксацину) – на 49,2%; к тетрациклинам: первого поколения (тетрациклину) – на 29,6%, второго поколения (доксициклину) – на 30,0%.
Наряду с этим за исследуемый период с 2022 по 2024 г. на 37,5% увеличилась устойчивость изолятов к хлорамфениколу/левомицетину и на 17,5% – к сульфаметоксазолу/триметоприму.
Возросла резистентность и к аминогликозидам: к амикацину (третье поколение) и канамицину (первое поколение) – на 12,5%, к стрептомицину (первое поколение) – на 10,8%.
Генов антибиотикорезистентности (blaCTX-M, blaOXA10, blaDHA, blaGES, blaKPC, blaOXA48-like, blaNDM, blaVIM) у выделенных бактерий рода Salmonella не установлено.
Постоянный мониторинг качества продукции животного происхождения позволит своевременно выявлять популяционные изменения циркулирующих штаммов бактерий и разрабатывать эффективные стратегии контроля для снижения риска передачи резистентных штаммов и генов резистентности человеку. В то же время определение тенденции устойчивости к лекарственным препаратам выделяемых штаммов позволит в том числе избежать необоснованного назначения антибактериальных препаратов как в сфере ветеринарии, так и в сфере здравоохранения в рамках эпидемиологического надзора за сальмонеллезами, учитывая принцип «Единое здоровье».
1. https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=21796
2. https://www.rospotrebnadzor.ru/upload/iblock/b50/t4kqksh4b12a2iwjnha29922vu7naki5/GD-SEB.pdf
3. https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=27779
4. https://www.rospotrebnadzor.ru/upload/iblock/b8a/u6lsxjabw032jkdf837nlaezxu3ue09m/GD_SEB.pdf
5. https://www.rospotrebnadzor.ru/upload/iblock/b8a/u6lsxjabw032jkdf837nlaezxu3ue09m/GD_SEB.pdf
Список литературы
1. WHO Bacterial Priority Pathogens List, 2024: bacterial pathogens of public health importance to guide research, development and strategies to prevent and control antimicrobial resistance. Geneva: World Health Organization; 2024. 56 р. https://iris.who.int/bitstream/handle/10665/376776/9789240093461-eng.pdf?sequence=1
2. World Health Organization.Ten threats to global health in 2019. https://www.who.int/news-room/spotlight/ten-threats-to-global-health-in-2019
3. World health statistics 2024: monitoring health for the SDGs, Sustainable Development Goals. Geneva: World Health Organization; 2024. 86 р. https://iris.who.int/bitstream/handle/10665/376869/9789240094703-eng.pdf
4. Tarín-Pelló A., Suay-García B., Pérez-Gracia M.-T. Antibiotic resistant bacteria: current situation and treatment options to accelerate the development of a new antimicrobial arsenal. Expert Review of Anti-Infective Therapy. 2022; 20 (8): 1095–1108. https://doi.org/10.1080/14787210.2022.2078308
5. Di K. N., Pham D. T., Tee T. S., Binh Q. A., Nguyen T. C. Antibiotic usage and resistance in animal production in Vietnam: a review of existing literature. Tropical Animal Health and Production. 2021; 53 (3):340. https://doi.org/10.1007/s11250-021-02780-6
6. Мухина Е. Г., Артемьева М. А., Саунц Л. А., Тожибоева Б. Т. Социальная проблема антибиотикорезистентности. Universum: медицина и фармакология. 2017; (6). https://7universum.com/ru/med/archive/item/4898
7. Manyi-Loh C., Mamphweli S., Meyer E., Okoh A. Antibiotic use in agriculture and its consequential resistance in environmental sources: potential public health implications. Molecules. 2018; 23 (4):795. https://doi.org/10.3390/molecules23040795
8. Aleksandrowicz A., Carolak E., Dutkiewicz A., Błachut A., Waszczuk W., Grzymajlo K. Better together – Salmonella biofilm-associated antibiotic resistance. Gut Microbes. 2023; 15 (1):2229937. https://doi.org/10.1080/19490976.2023.2229937
9. Wang B. X., Butler D. S. С., Hamblin M., Monack D. M. One species, different diseases: the unique molecular mechanisms that underlie the pathogenesis of typhoidal Salmonella infections. Current Opinion in Microbiology. 2023; 72:102262. https://doi.org/10.1016/j.mib.2022.102262
10. Li S., He Y., Mann D. A., Deng X. Global spread of Salmonella Enteritidis via centralized sourcing and international trade of poultry breeding stocks. Nature Communications. 2021; 12:5109. https://doi.org/10.1038/s41467-021-25319-7
11. Егорова С. А., Кафтырева Л. А., Помазанов В. В. Современные тенденции развития устойчивости бактерий рода Salmonella к клинически значимым антибиотикам (обзор литературы). Клиническая лабораторная диагностика. 2020; 65 (5): 308–315. http://dx.doi.org/10.18821/0869-2084-2020-65-5-308-315
12. World Animal Protection: Global public health cost of antimicrobial resistance related to antibiotic use on factory farms. https://www.world-animalprotection.org.in/globalassets/pdfs/reports/english/global-public-health-technical-report.pdf
13. WHO estimates of the global burden of foodborne diseases: food-borne disease burden epidemiology reference group 2007–2015. Geneva: World Health Organization; 2015. 254 p. https://iris.who.int/bitstream/handle/10665/199350/9789241565165_eng.pdf?sequence=1
14. Wu S., Hulme J. P. Recent advances in the detection of antibiotic and multi-drug resistant Salmonella: an update. International Journal of Molecular Sciences. 2021; 22 (7):3499. https://doi.org/10.3390/ijms22073499
15. Определение чувствительности микроорганизмов к антимикробным препаратам: российские рекомендации. Версия 2025-01. Смоленск: СГМУ; МАКМАХ; 2025. 208 с. https://www.antibiotic.ru/library/ocmap2025
16. European Committee on Antimicrobial Susceptibility Testing. Routine and extended internal quality control for MIC determination and disk diffusion as recommended by EUCAST. Version 15.0, valid from 2025-01-01. https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/QC/v_15.0_EUCAST_QC_tables_routine_and_extended_QC.pdf
17. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. 35th ed. CLSI supplement M100. Clinical and Laboratory Standards Institute; 2025. 428 p.
18. Salmonellosis. In: European Centre for Disease Prevention and Control. Annual Epidemiological Report for 2022. Stockholm: ECDC; 2024. https://www.ecdc.europa.eu/en/publications-data/salmonellosis-annual-epidemiological-report-2022
19. The European Union summary report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food in 2022–2023. EFSA Journal. 2025; 23 (3):e9237. https://doi.org/10.2903/j.efsa.2025.9237
20. Виткова О. Н., Белоусов В. И., Иванова О. Е., Базарбаев С. Б. Изучение антибиотикорезистентности сальмонелл, выделенных от животных и из пищевых продуктов животного происхождения на территории Российской Федерации. Ветеринария Кубани. 2015; (2): 11–15. https://elibrary.ru/tppjdx
21. Rakitin A. L., Yushina Y. K, Zaiko E. V., Bataeva D. S., Kuznetsova O. A., Semenova A. A., et al. Evaluation of antibiotic resistance of Salmonella serotypes and whole-genome sequencing of multiresistant strains isolated from food products in Russia. Antibiotics. 2022; 11 (1):1. https://doi.org/10.3390/antibiotics11010001
22. Мендыбаева А. М., Рузаускас М., Алешина Ю. Е., Алиева Г. К., Муканов Г. Б., Рыщанова Р. М. Оценка риска появления резистентности к антибиотикам условно-патогенной и патогенной микрофлоры, выделяемой из продуктов животного происхождения. Вестник КрасГАУ. 2022; (2): 147–156. https://doi.org/10.36718/1819-4036-2022-2-147-156
23. Patchanee P., Tansiricharoenkul K., Buawiratlert T., Wiratsudakul A., Angchokchatchawal K., Yamsakul P., et al. Salmonella in pork retail outlets and dissemination of its pulsotypes through pig production chain in Chiang Mai and surrounding areas, Thailand. Preventive Veterinary Medicine. 2016; 130: 99–105. https://doi.org/10.1016/j.prevetmed.2016.06.013
24. Possebon F. S., Tiba Casas M. R., Nero L. A., Yamatogi R. S., Araújo J. P. Jr., Pinto J. P. A. N. Prevalence, antibiotic resistance, PFGE and MLST characterization of Salmonella in swine mesenteric lymph nodes. Preventive Veterinary Medicine. 2020; 179:105024. https://doi.org/10.1016/j.prevetmed.2020.105024
25. Соловьева А. С., Шубин Ф. Н., Кузнецова Н. А. Антибиотикорезистентность штаммов Salmonella enteritidis, выделенных в Дальневосточном и Сибирском федеральном округах. Здоровье. Медицинская экология. Наука. 2017; (5): 15–21. https://doi.org/10.5281/zenodo.1115444
26. Baquero F. Threats of antibiotic resistance: an obliged reappraisal. International Microbiology. 2021; 24 (4): 499–506. https://doi.org/10.1007/s10123-021-00184-y
27. Wen S. C. H., Best E., Nourse C. Non-typhoidal Salmonella infections in children: review of literature and recommendations for management. Journal of Paediatrics and Child Health. 2017; 53 (10): 936–941. https://doi.org/10.1111/jpc.13585
28. Konyali D., Guzel M., SoyerY. Genomic characterization of Salmonella enterica resistant to cephalosporin, quinolones, and macrolides. Current Microbiology. 2023; 80 (11):344. https://doi.org/10.1007/s00284-023-03458-y
Об авторах
О. А. АкуличРоссия
Акулич Ольга Андреевна - аспирант ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Н. Б. Шадрова
Россия
Шадрова Наталья Борисовна - канд. биол. наук, заведующий отделом микробиологических исследований ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Г. С. Денисова
Россия
Денисова Галина Сергеевна - канд. биол. наук, руководитель Владимирской испытательной лаборатории ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Рецензия
Для цитирования:
Акулич О.А., Шадрова Н.Б., Денисова Г.С. Антибиотикорезистентность бактерий рода Salmonella, выявленных в продукции животного происхождения в 2022–2024 гг. Ветеринария сегодня. 2025;14(3):310-318. https://doi.org/10.29326/2304-196X-2025-14-3-310-318
For citation:
Akulich O.A., Shadrova N.B., Denisova G.S. Antimicrobial resistance of Salmonella spp. detected in animal products in 2022–2024. Veterinary Science Today. 2025;14(3):310-318. https://doi.org/10.29326/2304-196X-2025-14-3-310-318
JATS XML



































