Перейти к:
Филогенетический анализ изолятов вируса бешенства, выделенных от животных на территории Волгоградской области
https://doi.org/10.29326/2304-196X-2025-14-3-241-248
Аннотация
Введение. Нижнее Поволжье, в том числе Волгоградская область, вплоть до настоящего времени относится к числу наиболее неблагополучных по бешенству регионов России. Сведения о генетическом разнообразии возбудителя бешенства в современный период для Волгоградской области представлены недостаточно, поэтому филогенетический анализ изолятов вируса бешенства из этого региона представляется актуальной научной задачей. Цель исследования. Проведение филогенетического анализа современных изолятов вируса бешенства, выделенных от животных на территории Волгоградской области, на основании полноразмерной последовательности гена нуклеопротеина.
Материалы и методы. Использовали головной мозг животных с диагнозом «бешенство». Анализ полученных нуклеотидных последовательностей гена нуклеопротеина вируса бешенства проводили с помощью байесовского метода строгих молекулярных часов. Ландшафтно-географическая карта Natural Earth использована для описания пространственного распределения изолятов возбудителя бешенства.
Результаты. Определена полноразмерная последовательность гена нуклеопротеина 13 изолятов вируса бешенства из Волгоградской области. Филогенетический анализ позволил установить, что представители популяции возбудителя бешенства из этого региона относятся к различным генетическим вариантам группы С, сформировавшимся в разное время. Генетическое родство с изолятами из Казахстана, Молдовы, центральных и южных регионов России, с Украины свидетельствует об интенсивном перемещении вируса бешенства на юге европейской части России. В то же время разные варианты вируса бешенства обнаружены на левом и правом берегах Волги.
Заключение. Все изученные изоляты возбудителя бешенства из Волгоградской области принадлежали к генетической группе С и отличались высоким генетическим разнообразием вариантов.
Ключевые слова
Для цитирования:
Чупин С.А., Чернышова Е.В., Чернышев Р.С., Груздев К.Н., Спиридонов А.Н., Варкентин А.В., Назаров Н.А., Зарва И.Д., Ботвинкин А.Д. Филогенетический анализ изолятов вируса бешенства, выделенных от животных на территории Волгоградской области. Ветеринария сегодня. 2025;14(3):241-248. https://doi.org/10.29326/2304-196X-2025-14-3-241-248
For citation:
Chupin S.A., Chernyshova E.V., Chernyshev R.S., Gruzdev K.N., Spiridonov A.N., Varkentin A.V., Nazarov N.A., Zarva I.D., Botvinkin A.D. Phylogenetic analysis of rabies virus isolates recovered from animals in Volgograd Oblast. Veterinary Science Today. 2025;14(3):241-248. https://doi.org/10.29326/2304-196X-2025-14-3-241-248
ВВЕДЕНИЕ
Применение молекулярно-генетических исследований в эпизоотологии существенно расширило возможности надзора за зоонозными инфекциями. Сведения о внутривидовом разнообразии и степени родства генетических линий возбудителей инфекционных болезней, полученные в результате филогенетического анализа нуклеотидных последовательностей отдельных генов и полных геномов, несут в себе ценную информацию о происхождении патогенов, особенностях их пространственного распространения и значении в патологии человека и животных. Сформировались и активно развиваются новые направления исследований и практической деятельности – молекулярная эпидемиология и геномный эпидемиологический надзор [1][2].
На территории Российской Федерации выявлено несколько генетических групп вируса бешенства, имеющих различную географическую привязку [3-7]. Представители генетической группы С («степная») [3] распространены наиболее широко и в настоящее время занимают территории от Восточной Европы до юга Сибири, Казахcтана и Северо-Восточного Китая [6][8-11]. С середины XX века основным резервуаром вируса бешенства на этой территории является лисица (Vulpes vulpes). Предполагалось, что эпизоотии «лисьего» бешенства начались в 1939 г. в Восточной Пруссии (Польский коридор) и за 20–30 лет распространились на запад (до Франции и Бельгии) и на восток (в Прибалтику, на Украину, в Белоруссию и западные регионы России) [12][13]. На картограммах хорошо прослеживается последовательное распространение «лисьего» бешенства в европейской части бывшего СССР [14]. В начале XXI века эпизоотии среди лисиц распространились на регионы Сибири (в Красноярский край и Забайкалье), которые оставались благополучными по бешенству на протяжении нескольких десятилетий [7][15].
В 1942 г. была описана вспышка бешенства среди диких животных в дельте Волги [13]. Считается, что этот район, наряду с Восточной Пруссией, послужил одним из центров распространения «лисьего» бешенства в СССР [13][16]. Нижнее Поволжье, в том числе Волгоградская область, вплоть до настоящего времени относится к числу наиболее неблагополучных по бешенству регионов России [7][16]. Практически вся территория Волгоградской области энзоотична [17][18]. Первичным резервуаром вируса бешенства здесь считается лисица, хотя в последние десятилетия до 38% всех зафиксированных случаев заболевания приходилось на собак и кошек, тогда как доля диких животных не превышала 25% [19]. Известно, что в 4 из 6 зарегистрированных после 2000 г. случаев бешенства у людей заражение произошло от собак и кошек [7][20]. Опубликованы нуклеотидные последовательности гена нуклеопротеина (гена N) всего двух изолятов вируса бешенства от животных из Волгоградской области, которые были отнесены к генетической группе С [3]. Сведения о генетическом разнообразии возбудителя бешенства в современный период для Волгоградской области представлены недостаточно, поэтому филогенетический анализ изолятов вируса из этого региона представляется актуальной научной задачей.
Целью работы являлось проведение филогенетического анализа современных изолятов вируса бешенства, выделенных от животных на территории Волгоградской области, на основании полноразмерной последовательности гена N.
МАТЕРИАЛЫ И МЕТОДЫ
Изучено 13 изолятов вируса бешенства, выделенных от животных на территории Волгоградской области в 2018–2021 гг. (табл. 1, рис. 1).
Выделение РНК из головного мозга животных и наработку в полимеразной цепной реакции с обратной транскрипцией двух перекрывающихся фрагментов генома, содержащих полноразмерный ген N вируса бешенства, с последующей очисткой и нуклеотидным секвенированием по Сэнгеру осуществляли согласно ранее опубликованному протоколу [5]. Полученные последовательности экспортировали в международную базу данных GenBank (номера доступа в GenBank представлены в таблице 1).
При выполнении филогенетического анализа использовали байесовский подход с применением пакета программ Bayesian Evolutionary Analysis Sampling Trees (BEAST X) [21]. Предварительно с помощью компьютерной программы Mega X оценивали модель, подходящую для построения филогенетического дерева, с определением байесовского коэффициента (BIC) и скорректированного коэффициента Акаике (AICc). По результатам теста была выбрана модель Хасегава – Кишино – Яно с гамма-распределением 4-й категории (HKY + G; ВIC = 21 360,059; AICc = 17 664,682) [22]. Филогенетическое дерево, отражающее апостериорную (эмпирическую, лат. a posteriori) вероятность времени образования внутренних (предковых) и терминальных узлов с 95%-м доверительным интервалом (95% ДИ), конструировали методом строгих молекулярных часов, устанавливая гетерохронную калибровку до года выделения образца, модель случайного начального дерева с постоянным размером популяции, длину марковской цепи Монте-Карло (MCMC) 1 × 108 c частотой дискретизации 1 × 105. Апостериорную прогностическую проверку проводили для всех таксонов, принадлежащих генетической группе С вируса бешенства.
Достоверность МСМС оценивали в программе Tracer при анализе выходных данных BEAST X [23].
Дерево аннотировали с помощью утилиты TreeAnnotator и установленных параметров устранения выбросов (burn-in = 10%, 10 000 000 состояний), максимальной достоверности клада (MCC) и сохранения заданной длины.
Визуализацию филогенетического дерева выполняли в программе FigTree v1.4.5 [24].
Для картографирования использована программа QGIS 3.2.1 и электронная ландшафтно-географическая карта Natural Earth. Точки на карту наносили по географическим координатам населенных пунктов, в которых выявлены случаи бешенства.
Таблица 1
Сведения об изолятах вируса бешенства, выделенных от животных на территории Волгоградской области
Table 1
Information on RABV isolates recovered from animals in the Volgograd Oblast
|
№ п/п |
Полное название изолята |
Координаты населенных пунктов |
Год |
Животное-хозяин |
Номер в GenBank |
|
|
широта |
долгота |
|||||
|
1 |
490_2/2018/Volgograd |
50,19760 |
42,69182 |
2018 |
собака |
OP311892 |
|
2 |
490_4/2018/Volgograd |
49,98861 |
46,68835 |
2018 |
собака |
OP311893 |
|
3 |
1563/2018/Volgograd |
50,99677 |
44,35670 |
2018 |
собака |
OP311840 |
|
4 |
1299/138/2021/Volgograd |
51,07931 |
42,51306 |
2021 |
КРС* |
OP311869 |
|
5 |
1299/139/2021/Volgograd |
50,08529 |
45,40216 |
2021 |
собака |
OP311870 |
|
6 |
1299/141/2021/Volgograd |
48,38944 |
42,35912 |
2021 |
собака |
OP311871 |
|
7 |
1299/142/2021/Volgograd |
48,09285 |
42,59016 |
2021 |
КРС |
OP311872 |
|
8 |
1299/143/2021/Volgograd |
50,24182 |
41,83726 |
2021 |
собака |
OP311873 |
|
9 |
1299/144/2021/Volgograd |
49,85802 |
42,33575 |
2021 |
собака |
OP311874 |
|
10 |
1299/145/2021/Volgograd |
49,35021 |
45,07359 |
2021 |
куница** |
OP311875 |
|
11 |
1299/146/2021/Volgograd |
49,73250 |
43,48296 |
2021 |
КРС |
OP311876 |
|
12 |
1299/147/2021/Volgograd |
48,24536 |
42,64595 |
2021 |
кошка |
OP311877 |
|
13 |
1299/148/2021/Volgograd |
49,85802 |
42,33575 |
2021 |
волк*** |
OP311878 |
|
* КРС – крупный рогатый скот (cattle); ** куница – Martes sp.; *** волк – Canis lupus. |
||||||
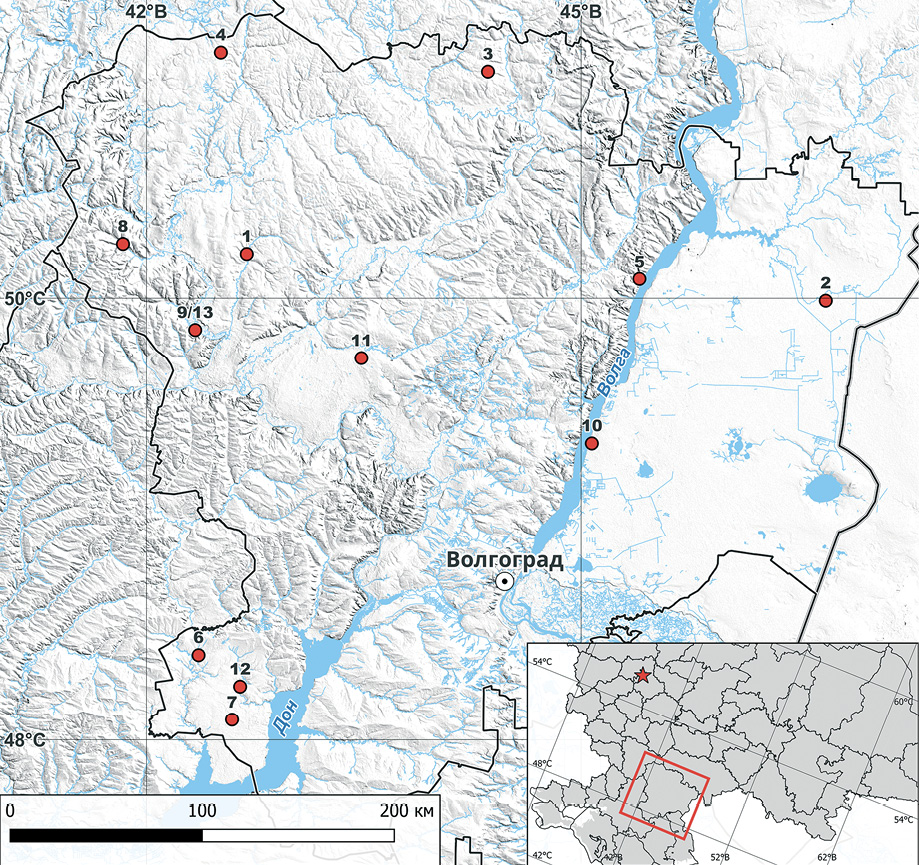
Рис. 1. Распределение выделенных от животных изолятов вируса бешенства по территории Волгоградской области (цифрами обозначены изоляты, указанные в таблице 1)
Fig. 1. Distribution of RABV isolates collected from animals in the Volgograd Oblast (the isolates listed in Table 1 are numbered)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Была определена полноразмерная нуклеотидная последовательность гена N (1353 н.) 13 полевых изолятов вируса бешенства, выделенных от животных на территории десяти районов Волгоградской области в период c 2018 по 2021 г. Места выявления изолятов представлены на карте (рис. 1).
Согласно предварительному анализу, все изученные изоляты относятся к генетической группе С вируса бешенства. Поэтому для построения филогенетического дерева из базы данных GenBank были взяты полноразмерные последовательности всех имеющихся изолятов этой группы, выявленных на территории РФ, с известным годом обнаружения. Кроме того, анализ изучаемых последовательностей на наличие близкородственных последовательностей с помощью поисковой системы BLAST (Basic Local Alignment Search Tool, https://blast.ncbi.nlm.nih.gov/Blast.cgi) позволил определить близкородственные изоляты, выявленные в Казахстане, Молдове, Польше и на Украине. Они также были включены в филогенетический анализ. Для наглядного представления группы С среди других генетических вариантов вируса были включены по несколько изолятов из других генетических групп, циркулирующих на территории Европы и европейской части России (кроме представителей клада Arctic-related ввиду очень отдаленного генетического родства). Таким образом, в филогенетическое дерево было включено 178 полноразмерных последовательностей гена N вируса бешенства, из них 121 последовательность принадлежала представителям генетической группы С. Для лучшей читаемости рисунка группы изолятов, не имеющих близкого генетического родства с изучаемыми изолятами, были «свернуты» (англ. collapsed). Полученное филогенетическое дерево представлено на рисунке 2.
Согласно топологии дерева все изучаемые изоляты относятся к генетической группе С, современный ареал которой в пределах Российской Федерации простирается от западных границ и областей средней полосы европейской части страны до степных и лесостепных территорий Сибири, повсеместно уходя за границы России на юге [3][6][5][11]. Вирус бешенства генетической линии С в Волгоградской области выделяли как от диких плотоядных, так и от домашних и сельскохозяйственных животных.
Все изученные изоляты уникальны по сравнению с выявленными ранее, в том числе и из Волгоградской области, и образуют несколько групп с высокой оценкой апостериорной вероятности (ОАВ) друг с другом и с ранее изученными изолятами из российских и зарубежных регионов.
Так, изолят 490_4/2018/Volgograd проявляет значительное сходство (99,85%) с изолятом Rab-8-4, выявленным в Туркестанской области Казахстана. Предположительное время существования последнего общего предка (ПВСПОП) для этой группы – 2015,9 г. (95% ДИ – от 2012,1 до 2016,93 г.), ОАВ группы – 1,0.
Изоляты 1299/143/2021/Volgograd и 1299/148/2021/Volgograd проявляют наибольшее родство с изолятами, выявленными ранее во Владимирской, Липецкой, Нижегородской и Рязанской областях (более 98,67%). ПВСПОП для этой группы – 2007,95 г. (95% ДИ – от 2002,48 до 2009,67 г.), ОАВ группы – 1,0.
Группа изолятов (490_2/2018/Volgograd, 1299/138/2021/Volgograd, 1299/139/2021/Volgograd, 1563/2018/Volgograd) проявляет наибольшее родство (более 98,9%) с изолятами, выявленными ранее в Нижегородской и Липецкой областях (но уже с другими, чем в предыдущих случаях). ПВСПОП для этой группы – 2001,43 г. (95% ДИ – от 1994,02 до 2002,65 г.), ОАВ группы – 1,0.
Еще пять изолятов из Волгоградской области (1299/142/2021/Volgograd, 1299/147/2021/Volgograd, 1299/141/2021/Volgograd, 1299/144/2021/Volgograd, 1299/146/2021/Volgograd) образуют группу с высокой ОАВ (1,0) с изолятами из Белгородской, Липецкой, Рязанской, Смоленской, Курской, Нижегородской, Московской областей, а также с изолятами, выявленными на территории других государств – Молдовы, Украины и Польши. Примечательно, что эта относительно плотная в генетическом отношении группа занимает чрезвычайно обширный ареал, простирающийся как минимум с севера на юг на 1000 км и с запада на восток на 2000 км. ПВСПОП для этой группы – 1996,13 г. (95% ДИ – от 1989,12 до 2003,42 г.).
Изолят 1299/145/2021/Volgograd генетически значительно отличается от других волгоградских изолятов и наибольшее (хотя и не слишком близкое) родство проявляет с изолятами, выявленными в Астраханской области (98,74%). Он образует группу, поддержанную высокой ОАВ (0,98), с изолятами вируса бешенства, выявленными в Оренбургской и Астраханской областях, а также в Казахстане. ПВСПОП для этой группы – 1978,98 г. (от 1974,35 до 1983,97 г.).
Два изолята (2070f и 2072f), выявленные в Волгоградской области I. V. Kuzmin et al. [3] в 2003 г., значительно отличаются от изучаемых изолятов из этого региона. Изолят 2070f образует группу с изолятом 1350/2008/Krasnodar из Краснодарского края (ОАВ – 1,0; ПВСПОП – 1984,33 г.; 95% ДИ – от 1977,17 до 1989,78 г.), а у изолята 2072f, хотя и наблюдается генетическое родство с изолятом 2070f (99,1%), однако эта группа имеет очень низкую поддержку ОАВ – 0,19.
Количество исследованных изолятов от разных групп животных примерно соответствует структуре заболеваемости за 2020–2024 гг. Более половины из них получены от собак и кошек (табл. 2).
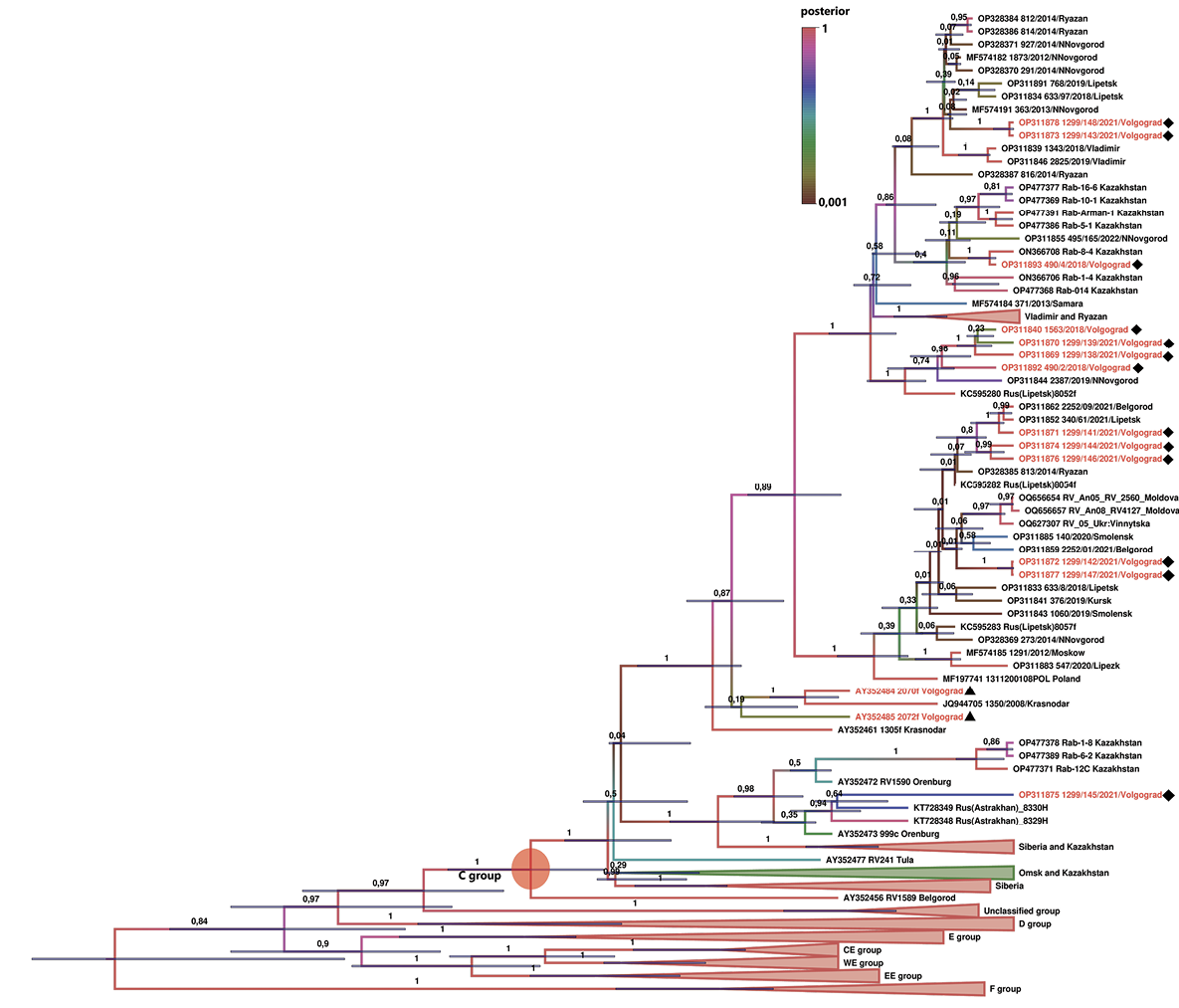
Рис. 2. Филогенетическое дерево, построенное с использованием полноразмерной нуклеотидной последовательности гена N вируса бешенства и алгоритма строгих молекулярных часов. Изоляты, выделенные от животных на территории Волгоградской области, обозначены красным шрифтом. Цифрами от 0 до 1 даны значения апостериорной вероятности выделения той или иной группы; этот же показатель обозначен цветом ветвей (расшифровка цвета дана на дополнительной шкале). Горизонтальная временная шкала внизу показывает годы существования последнего общего предка для той или иной группы, в узлах дерева синей полосой показаны 95% ДИ для этого значения. Розовым кругом обозначен последний общий предок представителей генетической группы С. Черными ромбами маркированы изучаемые изоляты, треугольниками – два ранее изученных изолята, выделенных на территории Волгоградской области
Fig. 2. Phylogenetic tree constructed using the full-length nucleotide sequence of RABV N gene and a strict molecular clock algorithm. Isolates collected from animals in the Volgograd Oblast are highlighted in red. Numbers (0–1) indicate posterior probability values for specific groups; the same parameter is indicated with the color of branches (see color scale for interpretation). The horizontal timeline at the bottom shows the estimated years of the most recent common ancestor for this or that group, with blue bars at nodes representing 95% confidence intervals for this value. The pink circle marks the most recent common ancestor of genetic group C. Black diamonds denote the studied isolates, while triangles represent two previously characterized isolates from the Volgograd Oblast
Таблица 2
Сведения о подтверждении бешенства у животных в Волгоградской области (2020–2024*) и источниках получения изолятов вируса для филогенетического анализа
Table 2
Data on rabies confirmation in animals from the Volgograd Region (2020–2024*) and sources of virus isolates for phylogenetic analysis
|
Категории животных |
Подтверждено случаев бешенства |
Исследовано изолятов |
||
|
n |
% |
n |
% |
|
|
Сельскохозяйственные животные (крупный рогатый скот, мелкий рогатый скот, лошадь) |
42 |
23,3 |
3 |
23,1 |
|
Домашние плотоядные (собака, кошка) |
109 |
60,6 |
8 |
61,5 |
|
Дикие плотоядные (лисица, волк и др.) |
29 |
16,1 |
2 |
15,4 |
|
Итого |
180 |
100 |
13 |
100 |
|
* Данные за 9 мес. 2024 г. (data for 9 months of 2024). |
||||
Таким образом, основной характеристикой популяции вируса бешенства в Волгоградской области является сильно выраженная гетерогенность, возможно, максимальная для регионов, изученных на данный момент достаточно хорошо. При этом практически все представители волгоградской популяции возбудителя бешенства имеют близких родственников в других регионах России и зарубежья, что говорит об активном перемещении вируса. Согласно литературным данным, нарастание эпизоотической напряженности имело место в Волгоградской области в 1988, 1991, 1997, 1998 и 2001 гг. [17]. Представители волгоградской популяции вируса бешенства относятся к разным генетическим вариантам, которые сформировались в разное время, на что указывает предположительный возраст последнего общего предка для этих вариантов. Возможно, пики эпизоотической напряженности совпадают по времени с распространением новых вариантов, после чего они «закрепляются» среди восприимчивых хозяев на определенной территории, продолжают эволюционировать и к настоящему времени дают такой пестрый генетический профиль популяции.
Обращают на себя внимание особенности локализации разных подгрупп вируса бешенства. Волгоградская область занимает срединную часть юго-востока Русской (Восточно-Европейской) равнины в пределах трех природных зон: лесостепной, степной и полупустынной [25]. Изоляты, собранные в лесостепных и степных районах северной части Волгоградской области на правобережье Волги (490_2/2018/Volgograd, 1563/2018/Volgograd, 1299/138/2021/Volgograd, 1299/139/2021/Volgograd, 1299/143/2021/Volgograd, 1299/144/2021/Volgograd, 1299/148/2021/Volgograd), имеют генетическое родство с изолятами из Среднего Поволжья и центральных регионов России. Вероятно, этому способствует отсутствие естественных барьеров для миграций диких плотоядных в северном направлении. Смежные территории характеризуются достаточно высокой численностью лисицы [26]. Изоляты вируса бешенства 1299/141/2021/Volgograd, 1299/142/2021/Volgograd, 1299/147/2021/Volgograd, имеющие сходство с изолятами, обнаруженными на Украине, в Молдове, Польше, западных и центральных регионах европейской части России, выявлены в юго-западной части Волгоградской области на правобережье Цимлянского водохранилища. Изоляты с левобережья Волги (490_4/2018/Volgograd, 1299/145/2021/Volgograd) генетически близки к изолятам с территорий, граничащих с Волгоградской областью на юге и востоке, что обусловлено общностью ландшафтов с полупустынями и сухими степями Казахстана и Астраханской области. Широкие водные преграды (Цимлянское, Волгоградское водохранилища и Волго-Донской канал), пересекающие всю область с северо-востока на юго-запад, замерзают на 2–3 мес. в году [25] и в течение большей части года представляют естественный барьер для распространения бешенства. В нашем распоряжении было всего 2 изолята с левобережья Волги, но оба отличались от изолятов с правого берега. Так, изолят 1299/145/2021/Volgograd, выявленный в Быковском районе Волгоградской области, группируется с изолятами, обнаруженными в Оренбургской и Астраханской (точное место происхождения изолятов неизвестно) областях, а также в Казахстане. Изолят 490/4/2018/Volgograd, выявленный в Палласовском районе Волгоградской области, имеет несколько близкородственных изолятов из Казахстана и один (что составляет единственное исключение) – из Нижегородской области. Районы с наиболее высокими показателями заболеваемости животных бешенством (Николаевский, Быковский, Ленинский, Октябрьский) [19] расположены на левом берегу Волги. Волго-Ахтубинская пойма, по-видимому, служит значимым экологическим руслом, связывающим Волгоградскую и Астраханскую области, что подтверждается генетическим сходством изолятов с этих территорий (1299/145/2021/Volgograd). Ограниченное количество исследованных изолятов не позволяет сделать более определенных выводов. Тем не менее полученные результаты заслуживают внимания для продолжения исследований и планирования мероприятий по оральной вакцинации лисиц.
ЗАКЛЮЧЕНИЕ
Все изученные изоляты вируса бешенства, выделенные от животных на территории Волгоградской области, отнесены к генетической группе С. В пределах этой линии популяция возбудителя бешенства в Волгоградской области отличается чрезвычайно высокой генетической вариабельностью. Генетическое родство изолятов из этого региона с изолятами из Казахстана, Молдовы, центральных и южных регионов России, с Украины свидетельствует об интенсивном перемещении хозяев вируса бешенства. Это обстоятельство необходимо учитывать при организации противоэпизоотических мероприятий.
Список литературы
1. Жебрун А. Б. От молекулярной к геномной и метагеномной эпидемиологии. Журнал микробиологии, эпидемиологии и иммунобиологии. 2014; 91 (3): 91–100. https://elibrary.ru/vobdlt
2. Акимкин В. Г., Семененко Т. А., Хафизов К. Ф., Углева С. В., Дубоделов Д. В., Колосовская Е. Н. Стратегия геномного эпидемиологического надзора. Проблемы и перспективы. Журнал микробиологии, эпидемиологии и иммунобиологии. 2024; 101 (2): 163–172. https://doi.org/10.36233/0372-9311-507
3. Kuzmin I. V., Botvinkin A. D., McElhinney L. M., Smith J. S., Orciari L. A., Hughes G. J., et al. Molecular epidemiology of terrestrial rabies in the former Soviet Union. Journal of Wildlife Diseases. 2004; 40 (4): 617–631. https://doi.org/10.7589/0090-3558-40.4.617
4. Чупин С. А., Чернышова Е. В., Метлин А. Е. Генетическая характеристика полевых изолятов вируса бешенства, выявленных на территории Российской Федерации в период 2008–2011 гг. Вопросы вирусологии. 2013; 58 (4): 44–49. https://elibrary.ru/rgqyth
5. Chupin S. A., Sprygin A. V., Zinyakov N. G., Guseva N. A., Shcherbinin S. V., Korennoy F. I., et al. Phylogenetic characterization of rabies virus field isolates collected from animals in European Russian regions in 2009–2022. Microorganisms. 2023; 11 (10):2526. https://doi.org/10.3390/microorganisms11102526
6. Deviatkin A. A., Lukashev A. N., Poleshchuk E. M., Dedkov V. G., Tkachev S. E., Sidorov G. N., et al. The phylodynamics of the rabies virus in the Russian Federation. PLoS ONE. 2017; 12 (2):e0171855. https://doi.org/10.1371/journal.pone.0171855
7. Полещук Е. М., Сидоров Г. Н., Нашатырева Д. Н., Градобоева Е. А., Пакскина Н. Д., Попова И. В. Бешенство в Российской Федерации: информационно-аналитический бюллетень. Омск: Издательский центр КАН; 2019. 110 с. https://elibrary.ru/bouwsw
8. Smreczak M., Orłowska A., Trębas P., Stolarek A., Freuling C., Müller T. Re-emergence of rabies in Mazowieckie Voivodeship, Poland, 2021. Zoonoses and Public Health. 2023; 70 (1): 111–116. https://doi.org/10.1111/zph.13005
9. Picard-Meyer E., Robardet E., Moroz D., Trotsenko Z., Drozhzhe Z., Biarnais M., et al. Molecular epidemiology of rabies in Ukraine. Archives of Virology. 2012; 157: 1689–1698. https://doi.org/10.1007/s00705-012-1351-6
10. Liu Y., Zhang S., Zhao J., Zhang F., Li N., Lian H., et al. Fox- and rac-coon-dog-associated rabies outbreaks in northern China. Virologica Sinica. 2014; 29 (5): 308–310. https://doi.org/10.1007/s12250-014-3484-0
11. Yessembekova G. N., Xiao Sh., Abenov A., Karibaev T., Shevtsov A., Asylulan А., et al. Molecular epidemiological study of animal rabies in Kazakhstan. Journal of Integrative Agriculture. 2023; 22 (4): 1266–1275. https://doi.org/10.1016/j.jia.2022.11.011
12. Steck F., Wandeler A. The epidemiology of fox rabies in Europe. Epidemiologic Reviews. 1980; 2 (1): 71–96. https://doi.org/10.1093/oxfordjournals.epirev.a036227
13. Селимов М. А. Бешенство. М.: Медицина; 1978. 336 с.
14. Botvinkin A., Kosenko M. Rabies in the European parts of Russia, Belarus and Ukraine. In: Historical Perspective of Rabies in Europe and the Mediterranean Basin. Eds. A. A. King, A. R. Fooks, M. Aubert, A. I. Wandeler. Paris: OIE; 2004; 47–63.
15. Полещук Е. М., Сидоров Г. Н. Анализ особенностей эпизоотолого-эпидемической ситуации и риск заражения бешенством в Российской Федерации в начале XXI века. Проблемы особо опасных инфекций. 2020; (4): 16–25. https://doi.org/10.21055/0370-1069-2020-4-16-25
16. Груздев К. Н., Метлин А. Е. Бешенство животных. 2-е изд., перераб. и доп. Владимир: ФГБУ «ВНИИЗЖ»; 2022. 442 с.
17. Авилов В. М., Сочнев В. В., Саввин А. В., Горячев И. И., Алиев А. А. Функционирование паразитарной системы бешенства в субъектах федерации Поволжского экономического района. Ветеринарная патология. 2004; (3): 127–134. https://elibrary.ru/hsoxed
18. Савченко С. Т., Чайка А. Н., Ромаcова Е. И., Масленникова Г. Ф., Махонин А. А., Фролова Г. И. и др. Состояние эпидемиологической и эпизоотологической ситуации в Волгоградской области по природно-очаговым и особо опасным инфекциям. Инфекция и иммунитет. 2012; 2 (1–2): 192. https://iimmun.ru/iimm/article/view/90/89
19. Аликова Г. А., Сочнев В. В., Авилов В. М., Козыренко О. В., Суворин В. В., Пашкина Ю. В. и др. Зоны риска рабической инфекции в Волгоградской области. Главные эпизоотологические параметры популяции животных: cборник научных трудов ФГБОУ ВПО НГСХА, представленных на2-йсессииМеждународнойнаучно-практической конференции (Нижний Новгород, 5–6 февраля 2014 г.). Т. 1. Нижний Новгород: БИКАР; 2015; 312–319. https://elibrary.ru/tqijur
20. Невинский А. Б., Арова А. А., Хлынина Ю. О. Клинический случай бешенства в Волгоградской области. Инфекционные болезни всовременном мире: эволюция, текущие ибудущие угрозы: cборник трудов ХIII Ежегодного Всероссийского конгресса по инфекционным болезням имени академика В. И. Покровского (Москва, 24–26 мая 2021 г.). М: Медицинское маркетинговое агентство; 2021; 120–121. https://elibrary.ru/jgusgf
21. Suchard M. A., Lemey P., Baele G., Ayres D. L., Drummond A. J., Rambaut A. Bayesian phylogenetic and phylodynamic data integration using BEAST 1.10. Virus Evolution. 2018; 4 (1):vey016. https://doi.org/10.1093/ve/vey016
22. Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution. 2018; 35 (6): 1547–1549. https://doi.org/10.1093/molbev/msy096
23. Rambaut A., Drummond A. J., Xie D., Baele G., Suchard M. A. Posterior summarization in Bayesian phylogenetics using Tracer 1.7. Systematic Biology. 2018; 67 (5): 901–904. https://doi.org/10.1093/sysbio/syy032
24. Sauvage T., Plouviez S., Schmidt W. E., Fredericq S. TREE2FASTA: a flexible Perl script for batch extraction of FASTA sequences from exploratory phylogenetic trees. BMC Research Notes. 2018; 11:164. https://doi.org/10.1186/s13104-018-3268-y
25. Рябинина Н. О. Природа и ландшафты Волгоградской области: монография. Волгоград: ВолГУ; 2015. 370 с.
26. Кинер Т. В., Зайцев В. А. Структура ареала обыкновенной лисицы (Vulpes vulpes L.) в лесной зоне Восточной Европы. Сибирский экологический журнал. 2010; 17 (1): 163–172. https://elibrary.ru/ldflib
Об авторах
С. А. ЧупинРоссия
Чупин Сергей Александрович - канд. биол. наук, ведущий научный сотрудник референтной лаборатории по бешенству и BSE, ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Е. В. Чернышова
Россия
Чернышова Елена Владимировна - канд. вет. наук, заведующий референтной лабораторией по бешенству и BSE, ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Р. С. Чернышев
Россия
Чернышев Роман Сергеевич - канд. биол. наук, младший научный сотрудник референтной лаборатории по африканской чуме свиней ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
К. Н. Груздев
Россия
Груздев Константин Николаевич - д-р биол. наук, профессор, главный научный сотрудник информационно-аналитического центра ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
А. Н. Спиридонов
Россия
Спиридонов Артем Николаевич - канд. вет. наук, руководитель информационно-аналитического центра ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
А. В. Варкентин
Россия
Варкентин Андрей Владимирович - канд. вет. наук, заведующий сектором информационно-аналитического центра ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
Н. А. Назаров
Россия
Назаров Николай Алексеевич - канд. биол. наук, ведущий научный сотрудник референтной лаборатории по бешенству и BSE ФГБУ «ВНИИЗЖ».
ул. Гвардейская, 6, мкр. Юрьевец, Владимир, 600901
И. Д. Зарва
Россия
Зарва Иван Дмитриевич - канд. мед. наук, заведующий кафедрой эпидемиологии ФГБОУ ВО ИГМУ Минздрава России.
ул. Красного Восстания, 1, Иркутск, 664003
А. Д. Ботвинкин
Россия
Ботвинкин Александр Дмитриевич - д-рмед. наук, профессор кафедры эпидемиологии ФГБОУ ВО ИГМУ Минздрава России.
ул. Красного Восстания, 1, Иркутск, 664003
Рецензия
Для цитирования:
Чупин С.А., Чернышова Е.В., Чернышев Р.С., Груздев К.Н., Спиридонов А.Н., Варкентин А.В., Назаров Н.А., Зарва И.Д., Ботвинкин А.Д. Филогенетический анализ изолятов вируса бешенства, выделенных от животных на территории Волгоградской области. Ветеринария сегодня. 2025;14(3):241-248. https://doi.org/10.29326/2304-196X-2025-14-3-241-248
For citation:
Chupin S.A., Chernyshova E.V., Chernyshev R.S., Gruzdev K.N., Spiridonov A.N., Varkentin A.V., Nazarov N.A., Zarva I.D., Botvinkin A.D. Phylogenetic analysis of rabies virus isolates recovered from animals in Volgograd Oblast. Veterinary Science Today. 2025;14(3):241-248. https://doi.org/10.29326/2304-196X-2025-14-3-241-248
JATS XML



































