Перейти к:
Разработка и апробация набора хромогенных сред для экспресс-диагностики мастита крупного рогатого скота
https://doi.org/10.29326/2304-196X-2025-14-2-171-178
Аннотация
Введение. Мастит крупного рогатого скота является одним из наиболее распространенных и экономически значимых заболеваний в молочном животноводстве. Для его диагностики предложены три хромогенные среды, каждая из которых предназначена для выделения и дифференциации определенных групп возбудителей мастита: среда I – для бактерий семейства Enterobacteriaceae, среда II – для микроорганизмов рода Staphylococcus, среда III – для бактерий рода Streptococcus.
Цель исследования. Оценка чувствительности, специфичности, дифференцирующих и ингибирующих свойств хромогенных сред, а также их апробация на образцах молока от коров с маститом.
Материалы и методы. Для оценки чувствительности использовали контрольные штаммы Streptococcus agalactiae, Staphylococcus aureus и Escherichia coli в различных концентрациях (1 × 100, 1 × 101, 1 × 102 КОЕ/мл). Рост микроорганизмов оценивали через 24 ч инкубации при 37 °C. Специфичность и дифференцирующие свойства изучали на 22 штаммах микроорганизмов, сравнивая их рост и цвет колоний на хромогенных и контрольной средах. Ингибирующие свойства оценивали по наличию или отсутствию роста культур. Апробацию сред проводили с использованием образцов молока от коров с маститом, используя стандартизированные методы посева и культивирования.
Результаты. Хромогенные среды показали сопоставимую с контрольной средой (колумбийский агар с добавлением 5% дефибринированной крови барана) чувствительность (p > 0,05). Среда I обеспечила дифференциацию микроорганизмов по цвету колоний, но имела низкие ингибирующие свойства. Среда II избирательно выделяла стафилококки, подавляя рост других бактерий. Среда III поддерживала рост энтерококков и стрептококков, в том числе Streptococcus agalactiae. Апробация на образцах молока подтвердила возможность дифференциации культур до вида.
Заключение. Разработанные хромогенные среды обеспечивают высокую точность диагностики мастита, сочетая чувствительность, специфичность и дифференцирующие свойства. Их комплексное использование позволяет охватить широкий спектр микроорганизмов и избирательно выделить целевые группы бактерий. Дальнейшая работа будет направлена на улучшение сред для подавления роста грибов и повышения точности диагностики.
Для цитирования:
Капустин А.В., Лаишевцев А.И., Савинов. В.А., Шастин. П.Н., Гильманов Х.Х., Хабарова А.В. Разработка и апробация набора хромогенных сред для экспресс-диагностики мастита крупного рогатого скота. Ветеринария сегодня. 2025;14(2):171-178. https://doi.org/10.29326/2304-196X-2025-14-2-171-178
For citation:
Kapustin A.V., Laishevtsev A.I., Savinov V.A., Shastin P.N., Gilmanov Kh.Kh., Khabarova A.V. Development and testing of a set of chromogenic media for rapid diagnosis of bovine mastitis. Veterinary Science Today. 2025;14(2):171-178. https://doi.org/10.29326/2304-196X-2025-14-2-171-178
ВВЕДЕНИЕ
Мастит крупного рогатого скота – это воспаление молочной железы, которое является одним из самых распространенных и экономически значимых заболеваний в молочном животноводстве [1][2][3]. Его распространение связано со множеством факторов, включающих нарушение гигиены доения, плохие условия содержания коров, неправильную технику доения, снижение иммунитета животных и отсутствие своевременной профилактики [4][5][6]. Мастит может протекать как в клинической форме с явными симптомами, такими как отек, покраснение и болезненность вымени, так и в субклинической, когда признаки воспаления отсутствуют, но качество молока ухудшается [7].
Этиология мастита включает две основные группы причин: механические и инфекционные. Механические связаны с травмами вымени, которые могут возникать вследствие неправильной техники доения, использования неисправного доильного оборудования, ушибов или повреждений при выпасе. Такие травмы создают благоприятные условия для возникновения инфекционного процесса, что может привести к развитию воспаления [8]. Однако основную роль в возникновении маститов играют патогенные микроорганизмы [9].
Наиболее распространенными возбудителями мастита являются Staphylococcus aureus, Streptococcus agalactiae, Escherichia coli и другие [10][11]. S. aureus является одним из наиболее опасных возбудителей, так как он способен вызывать хронические формы мастита, устойчивые к лечению [12][13][14][15]. S. agalactiae передается в основном через доильное оборудование и может длительное время сохраняться в организме коровы [16]. E. coli часто вызывает острые формы мастита, сопровождающиеся тяжелыми симптомами [17].
Для диагностики инфекционного мастита коров в арсенале ветеринарного врача существует ряд инструментов, которые имеют свои преимущества и недостатки [18][19][20][21][22][23][24]. Одним из наиболее распространенных методов является бактериологическое исследование молока [25][26]. Для этого образцы молока отбирают с соблюдением стерильности и высевают на питательные среды. После инкубации в термостате проводят идентификацию микроорганизмов по их морфологическим, биохимическим и культуральным свойствам. Этот метод позволяет точно определить возбудителя и подобрать эффективное лечение, однако он требует времени (2–3 дня) и специального оборудования [27]. Для ускорения диагностики инфекционного мастита могут использоваться хромогенные среды. Они содержат специальные субстраты, которые изменяют цвет под действием ферментов, вырабатываемых определенными микроорганизмами, и уже на следующие сутки после посева можно определить этиологическую единицу возбудителя мастита. На данный момент применяются различные виды экспресс-тестов, а именно подложки с питательной средой Compact Dry (R-Biopharm AG, Германия) или RIDA® COUNT (Chisso Corporation, Япония) [28][29]. Линейки наборов представлены различными тестами, направленными на выявление S. aureus, энтеробактерий, сальмонелл и на определение общего микробного числа, бактерий из группы кишечной палочки, дрожжей и плесеней.
В лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени К. И. Скрябина и Я. Р. Коваленко Российской академии наук» (ФГБНУ ФНЦ ВИЭВ РАН) была предложена собственная рецептура набора хромогенных сред, позволяющая дифференцировать возбудителей мастита, не прибегая к длительным лабораторным исследованиям. Набор представлен тремя различными хромогенными средами, которые при комплексном использовании позволяют сделать заключение о спектре возбудителей мастита в каждом конкретном случае. Это дает возможность установить спектр возбудителей, что, в свою очередь, может повлиять на выбор дальнейшей терапии.
Цель работы – определить эффективность и качество предложенного набора хромогенных сред для диагностики мастита крупного рогатого скота.
МАТЕРИАЛЫ И МЕТОДЫ
Хромогенные среды. Было приготовлено три хромогенные питательные среды.
Среда I предназначена для определения и дифференциации наиболее часто встречаемых микроорганизмов семейства Enterobacteriaceae.
Среда II предназначена для определения и дифференциации микроорганизмов рода Staphylococcus.
Среда III предназначена для определения и дифференциации микроорганизмов рода Streptococcus (в частности, S. agalactiae).
Для удобства применения три среды разместили в одной чашке Петри с секторами.
Эффективность хромогенных питательных сред определяли по ряду критериев: чувствительность, специфичность, культуральные свойства контрольных штаммов микроорганизмов, дифференцирующие и ингибирующие свойства. В качестве контрольной использовали коммерческую среду – колумбийский кровяной агар (HiMedia Laboratories Pvt Ltd., Индия) с добавлением 5% дефибринированной крови барана.
Контрольные штаммы. В качестве контрольных штаммов служили 22 культуры разных видов микроорганизмов из коллекции патогенных и вакцинных штаммов микроорганизмов – возбудителей инфекционных болезней животных ФГБНУ ФНЦ ВИЭВ РАН: E. coli ATCC 25922, S. agalactiae ATCC 8057, S. aureus ATCC 12600, Klebsiella pneumoniae B-1392, Proteus mirabilis B-1382, Pseudomonas aeruginosa B-1366, Salmonella typhimurium B-1025, Enterococcus faecalis B-1399, Enterococcus faecium 1921, Acinetobacter baumannii 2516, Enterobacter cloacae 1322, Staphylococcus hominis 1377, Staphylococcus equorum 2511, Staphylococcus haemolyticus 2505, Staphylococcus pseudintermedius B-1849, Morganella morganii 1418, Streptococcus uberis 2114, Streptococcus dysgalactiae 2432, Streptococcus pyogenes 1972, Aerococcus viridans 2320, Streptococcus canis 2326, Streptococcus suis 2383.
Подготовка разведений бактериальных суспензий. Исходные бактериальные взвеси готовили с концентрацией 1 × 10⁸ – 1 × 10⁹ КОЕ/мл, используя фармакопейный стандартный образец (ФСО 3.1.00085). Для получения необходимых посевных концентраций исходные суспензии последовательно титровали десятикратными разведениями.
Определение чувствительности. На исследуемые хромогенные и контрольную среды высевали штаммы S. agalactiae, S. aureus и E. coli по 1 мл в различных концентрациях: 1 × 10⁰, 1 × 10¹, 1 × 10² КОЕ/мл. Через (24 ± 2) ч инкубации при 37 °C сравнивали количество выросших колоний во всех посевах. Опыт проводили в трех повторностях. Для сравнения средних значений групп и определения статистически значимых различий между ними использовали тест Стьюдента (t-критерий): если p-значение < 0,05, различия считаются статистически значимыми.
Оценка специфичности. Специфичность определяли для каждой хромогенной среды отдельно. Сравнивали рост и характер изменений колоний различных штаммов бактерий на одной и той же опытной среде и отмечали наличие сходства или различий.
Оценка дифференцирующих свойств. Для определения дифференцирующих свойств сравнивали изменения контрольных штаммов на хромогенных и контрольной средах (структура, цвет колоний, цвет среды вокруг колоний).
Оценка ингибирующих свойств. Ингибирующие свойства определяли по наличию или отсутствию роста культур на хромогенных средах в сравнении с наличием роста на контрольной среде.
Апробация сред с образцами маститного молока. Было отобрано 8 образцов молока в количестве 10 мл от коров с маститом, который подтверждали тестом на соматические клетки «Кенотест» (CID Lines, Бельгия). Отбор проводили в стерильные контейнеры для хранения биологического материала. Срок хранения молока перед посевом составлял не более 2 ч с момента отбора. Температура хранения была в пределах +4…+8 °C. Посев совершали с помощью стерильного ватного тампона: погружали его в молоко, удаляли излишки влаги о стенки контейнера, после чего образец засевали сплошным газоном на три хромогенные среды. Учет результатов проводили после культивирования в течение 24 ч при температуре 37 °C.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для определения чувствительности хромогенных сред использовали три целевых штамма (S. agalactiae, S. aureus и E. coli), которые засевали по 1 мл в трех разных концентрациях (1 × 10⁰, 1 × 10¹, 1 × 10² КОЕ/мл). После культивирования в течение суток при 37 °C подсчитывали количество колониеобразующих единиц на всех средах. Результаты представлены в таблице 1.
Таблица 1
Средние значения колониеобразующих единиц для каждого исследуемого вида микроорганизма на опытных и контрольной средах
Table 1
Mean colony-forming unit values for each tested microorganism species in experimental and control media
|
КОЕ/мл |
Среда I |
Среда II |
Среда III |
Контроль |
|
|
S. agalactiae |
1 × 10² |
116,0 ± 11,4 |
Ингибируется |
117,7 ± 12,7 |
105,3 ± 21,4 |
|
1 × 10¹ |
20,3 ± 1,2 |
21,7 ± 3,8 |
23,0 ± 6,1 |
||
|
1 × 10⁰ |
3,7 ± 1,2 |
5,7 ± 1,5 |
3,3 ± 3,5 |
||
|
S. aureus |
1 × 10² |
112,0 ± 14,0 |
111,3 ± 8,3 |
Ингибируется |
118,3 ± 10,0 |
|
1 × 10¹ |
21,7 ± 3,2 |
17,3 ± 2,1 |
23,0 ± 6,1 |
||
|
1 × 10⁰ |
3,7 ± 2,5 |
4,0 ± 2,6 |
3,0 ± 2,6 |
||
|
E. coli |
1 × 10² |
100,3 ± 4,9 |
Ингибируется |
Ингибируется |
118,3 ± 9,1 |
|
1 × 10¹ |
27,0 ± 2,0 |
21,7 ± 1,5 |
|||
|
1 × 10⁰ |
4,3 ± 2,1 |
2,3 ± 2,3 |
|||
Для выявления статистически значимого различия или сходства использовали тест Стьюдента, результаты которого представлены в таблице 2.
Таблица 2
Оценка статистической достоверности (t-критерий Стьюдента) сравниваемых групп
Table 2
Statistical significance assessment (Student’s t-test) between compared groups
|
Сравниваемые группы |
КОЕ/мл |
S. agalactiae |
S. aureus |
E. coli |
|
Среда I vs контроль |
1 × 10² |
0,63 |
0,18 |
0,06 |
|
1 × 10¹ |
0,45 |
0,81 |
0,12 |
|
|
1 × 10⁰ |
0,89 |
0,42 |
0,18 |
|
|
Среда II vs контроль |
1 × 10² |
Ингибируется |
0,46 |
Ингибируется |
|
1 × 10¹ |
0,30 |
|||
|
1 × 10⁰ |
0,76 |
|||
|
Среда III vs контроль |
1 × 10² |
0,39 |
Ингибируется |
Ингибируется |
|
1 × 10¹ |
0,84 |
|||
|
1 × 10⁰ |
0,48 |
Исходя из полученных данных, можно сделать вывод, что хромогенные среды обеспечивают сопоставимые с контрольной средой результаты по чувствительности, что подтверждает статистический анализ (t-критерий Стьюдента, p > 0,05): различия между хромогенными средами и контрольной средой не являются статистически значимыми для всех используемых штаммов и концентраций. Таким образом, хромогенные среды обеспечивают хорошую высеваемость целевых микроорганизмов даже в минимальном количестве.
Изучение специфичности, дифференцирующих и ингибирующих свойств хромогенных сред проводили одномоментно с использованием 22 штаммов микроорганизмов различных видов. Результаты представлены в таблице 3.
Таблица 3
Результаты изучения специфичности, дифференцирующих и ингибирующих свойств хромогенных сред в сравнении с контрольной средой
Table 3
Results of tests for specificity, differentiation capacities and inhibitory properties of chromogenic media as compared with control medium
|
Микроорганизмы |
Среда I |
Среда II |
Среда III |
Контроль |
||||
|
Рост |
Цвет колонии |
Рост |
Цвет колонии |
Рост |
Цвет колонии |
Рост |
Цвет колонии |
|
|
Escherichia coli |
Хороший |
Бордовый |
Ингибируется |
Ингибируется |
Хороший |
Серовато-белый |
||
|
Klebsiella pneumoniae |
Хороший |
Фиолетово-синий |
Ингибируется |
Ингибируется |
Хороший |
Серовато-белый |
||
|
Proteus mirabilis |
Хороший |
Прозрачный |
Хороший |
Прозрачный |
Умеренный |
Прозрачный |
Хороший |
Серовато-белый |
|
Pseudomonas aeruginosa |
Хороший |
Серо-зеленый |
Ингибируется |
Хороший |
Сине-зеленый |
Хороший |
Сине-зеленый |
|
|
Salmonella typhimurium |
Хороший |
Прозрачный |
Ингибируется |
Ингибируется |
Хороший |
Серовато-белый |
||
|
Enterococcus faecalis |
Хороший |
Сине-голубой |
Ингибируется |
Хороший |
Сине-зеленый |
Хороший |
Серовато-белый |
|
|
Enterococcus faecium |
Хороший |
Сине-зеленый |
Ингибируется |
Хороший |
Сине-зеленый |
Хороший |
Серовато-белый |
|
|
Acinetobacter baumannii |
Хороший |
Бледно-желтый |
Ингибируется |
Ингибируется |
Хороший |
Серовато-белый |
||
|
Enterobacter cloacae |
Хороший |
Фиолетово-синий |
Ингибируется |
Ингибируется |
Хороший |
Серовато-белый |
||
|
Morganella morganii |
Хороший |
Янтарный |
Ингибируется |
Умеренный |
Белый |
Хороший |
Серовато-белый |
|
|
Staphylococcus aureus |
Хороший |
Золотистый |
Умеренный |
Фиолетовый |
Ингибируется |
Хороший |
Золотистый |
|
|
Staphylococcus hominis |
Хороший |
Белый |
Хороший |
Сине-зеленый |
Ингибируется |
Хороший |
Белый |
|
|
Staphylococcus equorum |
Хороший |
Фиолетово-розовый |
Хороший |
Сине-зеленый |
Ингибируется |
Хороший |
Белый |
|
|
Staphylococcus haemolyticus |
Хороший |
Белый |
Хороший |
Зеленый |
Ингибируется |
Хороший |
Серовато-белый |
|
|
Staphylococcus pseudintermedius |
Хороший |
Бежево-розовый |
Хороший |
Сине-зеленый |
Ингибируется |
Хороший |
Серовато-белый |
|
|
Streptococcus agalactiae |
Умеренный |
Бледно-розовый |
Ингибируется |
Хороший |
Голубой |
Хороший |
Серовато-белый |
|
|
Streptococcus uberis |
Умеренный |
Белый |
Ингибируется |
Умеренный |
Белый |
Хороший |
Серовато-белый |
|
|
Streptococcus dysgalactiae |
Умеренный |
Бледно-розовый |
Ингибируется |
Умеренный |
Белый |
Хороший |
Серовато-белый |
|
|
Streptococcus pyogenes |
Умеренный |
Белый |
Ингибируется |
Умеренный |
Белый |
Хороший |
Серовато-белый |
|
|
Aerococcus viridans |
Умеренный |
Белый |
Ингибируется |
Ингибируется |
Хороший |
Зеленоватый |
||
|
Streptococcus canis |
Умеренный |
Белый |
Ингибируется |
Умеренный |
Белый |
Хороший |
Серовато-белый |
|
|
Streptococcus suis |
Умеренный |
Бледно-розовый |
Ингибируется |
Умеренный |
Белый |
Хороший |
Серовато-белый |
|
Установлено, что среда I обладает высокой специфичностью: большинство исследуемых бактерий образовывали колонии с уникальными цветами. Например, E. coli формировали бордовые колонии, S. aureus – золотистые, P. aeruginosa – серо-зеленые, а S. equorum – фиолетово-розовые. Однако некоторые микроорганизмы, такие как E. cloacae и K. pneumoniae, имели схожий цвет колоний (фиолетово-синий), что может затруднить их визуальное различие. Ингибирующие свойства были выражены слабо: все исследуемые штаммы микроорганизмов демонстрировали рост в течение 24 ч. Тем не менее среда I обеспечивала эффективную дифференциацию контрольных штаммов по цвету колоний, что позволяет уже на ранних этапах визуально различать микроорганизмы.
Ингибирующие свойства среды II выражены сильно: рост большинства бактерий отсутствовал, за исключением целевых микроорганизмов – Staphylococcus spp. Стоит отметить, что специфичность у среды невысокая – большинство стафилококков окрашивались в сине-зеленый цвет. Однако одинаковый цвет имели преимущественно сапрофитные микроорганизмы, в то время как потенциально патогенные стафилококки (S. aureus и S. haemolyticus) отличались по цвету. Например, S. aureus образовали фиолетовые колонии, а S. hominis и S. equorum – сине-зеленые, что позволило визуально различить их. По сравнению с контрольной среда II обеспечивала дифференциацию стафилококков по цвету.
Среда III продемонстрировала хорошие ингибирующие свойства, эффективно подавляя рост большинства микроорганизмов, за исключением грамположительных кокков и некоторых представителей семейства Enterobacteriaceae. Дифференцирующие и специфические свойства среды были выражены слабо и проявлялись преимущественно для энтерококков, которые окрашивались в сине-зеленый цвет, и для S. agalactiae, образующих голубые колонии.
Использование в сочетании всех трех хромогенных сред обеспечивает комплексный подход к диагностике мастита, демонстрируя высокую чувствительность, специфичность и дифференцирующие свойства. Такой метод позволяет охватить широкий спектр микроорганизмов, избирательно выделяя целевые группы бактерий, такие как стафилококки, стрептококки и энтерококки.
Для проверки сред в реальных условиях были отобраны образцы молока, которые в дальнейшем высевали на три хромогенные среды. Результаты представлены на рисунке.
Использование одновременно трех сред для посева молока позволяет дифференцировать культуры практически до вида. Так, на рисунке (a) видно, что на средах I и III выросли микроорганизмы рода Enterococcus sp. (предположительно, E. faecalis, поскольку E. faecium имеет более темный зеленый цвет). Единичные колонии на среде II представлены бактериями Staphylococcus sp., при этом исключается рост S. aureus, поскольку он на среде II должен иметь фиолетовый цвет. Также можно увидеть бордовые колонии на среде I, что говорит о наличии E. coli в исследуемом образце. На рисунке (b) микробиом образца представлен практически только Enterococcus sp. Белые и зеленые колонии на средах I и II соответственно сформированы микроорганизмами рода Staphylococcus sp., но не S. aureus. На рисунке (c) представлена монокультура бактерий из рода Enterococcus sp., предположительно E. faecium. В четвертом образце на рисунке (d) все выделенные изоляты являются мицелиальными грибами. Еще одна проба молока показала результаты, схожие с рисунком (b), в трех других посевах рост микроорганизмов отсутствовал.
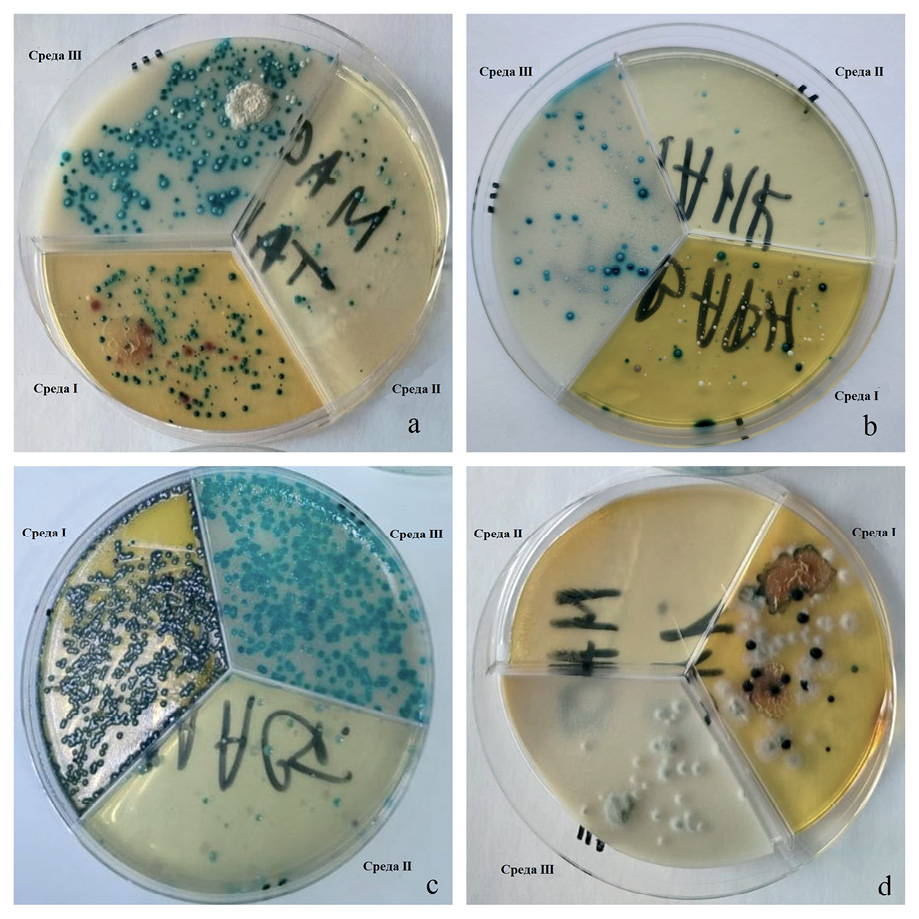
Рис. Апробация сред с образцами молока (культивирование при 37 °C в течение 24 ч)
Fig. Testing of culture media using milk samples (cultivated at 37 °C for 24 h)
ЗАКЛЮЧЕНИЕ
Разработанные хромогенные среды демонстрируют высокую эффективность для диагностики мастита крупного рогатого скота. Среда I, обладая высокой чувствительностью и дифференцирующими свойствами, позволяет проводить первичный скрининг и выявлять широкий спектр микроорганизмов, включающий представителей семейства Enterobacteriaceae. Среда II благодаря сильным ингибирующим свойствам избирательно выделяет стафилококки, что особенно важно для идентификации патогенных видов, таких как S. aureus. Среда III, хотя и имеет ограниченные дифференцирующие свойства, эффективно поддерживает рост энтерококков и стрептококков, в том числе S. agalactiae, что делает ее важной для диагностики мастита.
Комплексное использование всех трех сред обеспечивает высокую точность диагностики, позволяя не только охватить широкий спектр микроорганизмов, но и избирательно выделить целевые группы бактерий. Это значительно ускоряет процесс идентификации возбудителей и способствует своевременному назначению эффективной терапии. Апробация сред на образцах молока от коров с маститом подтвердила их практическую применимость и эффективность в реальных условиях.
В ходе исследований было отмечено, что на средах возможно развитие мицелиальных грибов, что может затруднить интерпретацию результатов. В связи с этим планируется продолжить работу по улучшению составов сред, исследуя различные препараты в разных концентрациях для ингибирования роста грибов. Это позволит повысить специфичность сред и исключить ложноположительные результаты, связанные с развитием нецелевых микроорганизмов.
Стоит отметить, что при использовании стандартизированных одноразовых петель для посева молока существует возможность примерного определения количества колониеобразующих единиц. Хотя этот метод не обеспечивает высокой точности, он позволяет примерно оценить степень обсемененности молока, что может быть полезно для предварительной оценки тяжести инфекции.
Таким образом, разработанные хромогенные среды представляют собой перспективный инструмент для экспресс-диагностики мастита, сочетающий в себе высокую чувствительность, специфичность и дифференцирующие свойства. Их использование в ветеринарной практике может значительно ускорить диагностику и улучшить эффективность лечения мастита, что положительно скажется на здоровье животных и продуктивности молочного стада.
Вклад авторов: Капустин А. В. – разработка концепции исследования, утверждение окончательного варианта статьи; Лаишевцев А. И. – подготовка и редактирование текста, утверждение окончательного варианта статьи; Савинов В. А. – разработка концепции и проведение исследований, сбор данных, их анализ и интерпретация, проведение статистического анализа; Шастин П. Н. – проведение исследований, сбор данных, их анализ и интерпретация, подготовка и редактирование текста; Гильманов Х. Х. – проведение исследований, сбор данных, их анализ и интерпретация, проведение статистического анализа; Хабарова А. В. – разработка концепции и проведение исследований, сбор данных, их анализ и интерпретация.
Contribution of the authors: Kapustin A. V. – conceptualization, final manuscript approval; Laishevtsev A. I. – text preparation and editing, final manuscript approval; Savinov V. A. – conceptualization and test conducting, data collection, analysis and interpretation, statistical analysis; Shastin P. N. – test conducting, data collection, analysis and interpretation, text preparation and editing; Gilmanov Kh. Kh. – test conducting, data collection, analysis and interpretation, statistical analysis; Khabarova A. V. – conceptualization and test conducting, data collection, analysis and interpretation.
Список литературы
1. Зюбин И. Н., Смирнов П. Н., Напримеров В. А., Нимацыренов Г. Г. Маститы крупного рогатого скота. Новосибирск: ООО «2Д»; 2009. 95 с.
2. Никитина М. В., Столбова О. А., Скосырских Л. Н. Лечебно-профилактические мероприятия при мастите крупного рогатого скота. Молочнохозяйственный вестник. 2019; (3): 31–39. https://elibrary.ru/qbdglc
3. Goulart D. B., Mellata M. Escherichia coli mastitis in dairy cattle: etiology, diagnosis, and treatment challenges. Frontiers in Microbiology. 2022; 13:928346. https://doi.org/10.3389/fmicb.2022.928346
4. Vakkamäki J., Taponen S., Heikkilä A.-M., Pyörälä S. Bacteriological etiology and treatment of mastitis in Finnish dairy herds. Acta Veterinaria Scandinavica. 2017; 59:33. https://doi.org/10.1186/s13028-017-0301-4
5. Осколкова М. В., Кузьмина Э. В. Этиология мастита и его взаимосвязь с гинекологическими заболеваниями крупного рогатого скота. Известия Оренбургского государственного аграрного университета. 2014; (4): 86–88. https://elibrary.ru/sucqyt
6. Pascu C., Herman V., Iancu I., Costinar L. Etiology of mastitis and antimicrobial resistance in dairy cattle farms in the western part of Romania. Antibiotics. 2022; 11 (1):57. https://doi.org/10.3390/antibiotics11010057
7. Мастит: этиология, профилактика, диагностика, лечение: учебное пособие. Cост. С. В. Щепеткина. 2-е изд., доп. СПб.: ФГБОУ ВО СПбГАВМ; 2020. 308 с. https://elibrary.ru/gozcpy
8. Никитина М. В., Столбова О. А., Скосырских Л. Н. Изучение этиологических факторов мастита крупного рогатого скота. Известия Оренбургского государственного аграрного университета. 2019; (5): 197–200. https://elibrary.ru/vhyltw
9. Иванов Е. В., Капустин А. В., Авдуевская Н. Н. Изучение воздействия вакцинации в отношении Staphylococcus aureus, вызывающего маститы и эндометриты у коров. Ветеринария сегодня. 2024; 13 (4): 360–365. https://doi.org/10.29326/2304-196X-2024-13-4-360-365
10. Ganguly S. Bacteriological examination of cow milk samples collected from case of chronic clinical mastitis. International Journal of Recent Development in Engineering and Technology. 2016; 5 (6): 8–9. https://www.researchgate.net/publication/303994840
11. Люсин Е. А. Критерии выбора антибактериальных препаратов при лечении мастита крупного рогатого скота. Аграрная наука. 2021; 347 (4): 50–52. https://doi.org/10.32634/0869-8155-2021-347-4-50-52
12. Ganguly S., Wakchaure R. Bacteriological analysis of cow milk sample suspected of being affected with sub-clinical mastitis. International Journal of Engineering and Innovative Technology. 2016; 6 (3): 38–39. https://www.researchgate.net/publication/309389480
13. Hoque M. N., Das Z. C., Rahman A. N. M. A., Haider M. G., Islam M. A. Molecular characterization of Staphylococcus aureus strains in bovine mastitis milk in Bangladesh. International Journal of Veterinary Science and Medicine. 2018; 6 (1): 53–60. https://doi.org/10.1016/j.ijvsm.2018.03.008
14. Музыка В. П., Стецко Т. И., Пашковская М. В., Падовский В. Н. Мониторинг чувствительности стафилококков к антимикробным веществам. Ученые записки УО ВГАВМ. 2012; 48 (2-1): 119–122. https://repo.vsavm.by/handle/123456789/600
15. Вареников М. В., Ташланов В. В., Морозов И. А. Профилактика мастита – высокая рентабельность молочного производства. Молочное и мясное скотоводство. 2014; (8): 32–35. https://elibrary.ru/tecawh
16. Salat O., Lemaire G., Durel L., Perrot F. Etiology of severe mastitis in French dairy herds. PLoS ONE. 2023; 18 (12):e0295614. https://doi.org/10.1371/journal.pone.0295614
17. Ali T., Kamran, Raziq A., Wazir I., Ullah R., Shah P., et al. Prevalence of mastitis pathogens and antimicrobial susceptibility of isolates from cattle and buffaloes in northwest of Pakistan. Frontiers in Veterinary Science. 2021; 8:746755. https://doi.org/10.3389/fvets.2021.746755
18. Tommasoni C., Fiore E., Lisuzzo A., Gianesella M. Mastitis in dairy cattle: on-farm diagnostics and future perspectives. Animals. 2023; 13 (15):2538. https://doi.org/10.3390/ani13152538
19. Abd El-Tawab A. A., Nabih A. M., Saad W. Bacteriological and molecular diagnosis of most common bacteria causing subclinical mastitis in cow. Benha Veterinary Medical Journal. 2019; 37 (2): 28–32. https://www.researchgate.net/publication/343114382
20. Kahya Demirbilek S., Yıldız M., Akkoç A., Mutlu A. M., Ardıçlı Ö., Aner H. Comparison of bacteriological culture method and multiplex real- time PCR for detection of mastitis. Research in Veterinary Science. 2024; 172:105237. https://doi.org/10.1016/j.rvsc.2024.105237
21. Adkins P. R. F., Middleton J. R. Methods for diagnosing mastitis. Vete rinary Clinics of North America: Food Animal Practice. 2018; 34 (3): 479–491. https://doi.org/10.1016/j.cvfa.2018.07.003
22. Челнокова М. И., Щербакова Н. А. Диагностика и терапия мастита коров. Известия Великолукской государственной сельскохозяйственной академии. 2018; (1): 20–24. https://elibrary.ru/uqrcaa
23. Черненок В. В., Хотмирова О. В., Черненок Ю. Н. Методы диагностики и лечения мастита у коров. Вестник Курской государственной сельскохозяйственной академии. 2020; (4): 40–43. https://elibrary.ru/ygwehu
24. Шлейникова А. А., Скубко О. Р. Диагностика мастита у крупного рогатого скота. Научноинновационное развитие ветеринарной науки и практики: материалы Национальной (Всероссийской) научно-практической конференции (Омск, 10 ноября 2022 г.). Омск: ФГБОУ ВО Омский ГАУ; 2022; 77–80. https://www.elibrary.ru/gmiyot
25. Ganguly S., Para P. A., Praveen P. K. Bacteriological examination of cow milk samples suspected of clinical mastitis: a case study. International Journal of Pure & Applied Bioscience. 2017; 5 (1): 207–209. https://doi.org/10.18782/2320-7051.2518
26. Ладанова М. А. Мастит у крупного рогатого скота. Актуальные вопросы ветеринарной медицины: материалы международной научной конференции, посвященной 100-летию кафедр клинической диагностики, внутренних болезней животных им. Синева А. В., акушерства и оперативной хирургии (Санкт-Петербург, 29–30 сентября 2022 г.). СПб.: СПбГУВМ; 2022; 75–79. https://doi.org/10.52419/3006-2022-5
27. Ganguly S., Padhy A., Sahoo S., Garg Sh. L., Praveen P. K., Wakchaure R. Bacteriological examination and antibiogram of milk sample of clinically infected dairy cow suffering from mastitis. International Journal of Medical Microbiology and Tropical Diseases. 2015; 1 (1): 6–7. https://www.researchgate.net/publication/290427340
28. Джангулова А. Н., Кухар Е. В., Аканова Ж. Ж., Курманов Б. А. Применение тестов Compact Dry в полевых условиях. Фундаментальные и прикладные научные исследования: актуальные вопросы, достижения и инновации: сборник статей XLVII Международной научно-практической конференции (Пенза, 30 июля 2021 г.). Пенза: МЦНС «Наука и Просвещение»; 2021; 63–70. https://elibrary.ru/unssnp
29. Галкин А. В., Соловьева О. И., Калашникова Г. Т., Елагина А. А. Диагностика возбудителей мастита у коров с помощью подложек RIDA® COUNT. Молочная река. 2012; (4): 44–45. https://elibrary.ru/egtmiu
Об авторах
А. В. КапустинРоссия
Капустин Андрей Владимирович, д-р биол. наук, доцент, первый заместитель директора,
Рязанский проспект, 24/1, г. Москва, 109428.
А. И. Лаишевцев
Россия
Лаишевцев Алексей Иванович, канд. биол. наук, ведущий научный сотрудник, и. о. заведующего лабораторией диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
В. А. Савинов.
Россия
Савинов Василий Александрович, канд. биол. наук, старший научный сотрудник лаборатории микологии и антибиотиков им. А. Х. Саркисова,
Рязанский проспект, 24/1, г. Москва, 109428.
П. Н. Шастин.
Россия
Шастин Павел Николаевич, канд. вет. наук, старший научный сотрудник лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
Х. Х. Гильманов
Россия
Гильманов Хамид Халимович, канд. биол. наук, старший научный сотрудник лаборатории лейкозологии,
Рязанский проспект, 24/1, г. Москва, 109428.
А. В. Хабарова
Россия
Хабарова Алла Викторовна, младший научный сотрудник лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
Рецензия
Для цитирования:
Капустин А.В., Лаишевцев А.И., Савинов. В.А., Шастин. П.Н., Гильманов Х.Х., Хабарова А.В. Разработка и апробация набора хромогенных сред для экспресс-диагностики мастита крупного рогатого скота. Ветеринария сегодня. 2025;14(2):171-178. https://doi.org/10.29326/2304-196X-2025-14-2-171-178
For citation:
Kapustin A.V., Laishevtsev A.I., Savinov V.A., Shastin P.N., Gilmanov Kh.Kh., Khabarova A.V. Development and testing of a set of chromogenic media for rapid diagnosis of bovine mastitis. Veterinary Science Today. 2025;14(2):171-178. https://doi.org/10.29326/2304-196X-2025-14-2-171-178
JATS XML



































