Перейти к:
К совершенствованию дифференциальной диагностики туберкулеза крупного рогатого скота в условиях Республики Дагестан
https://doi.org/10.29326/2304-196X-2025-14-2-164-170
Аннотация
Введение. При диагностике туберкулеза неспецифические реакции на туберкулин являются одной из наиболее важных проблем, увеличивающихся с каждым годом. Учитывая сложную ситуацию, в том числе и эпидемиологическую, совершенствование методов диагностики туберкулеза крупного рогатого скота является весьма актуальным.
Цель исследования. Разработка эффективного комплексного метода дифференциальной диагностики туберкулеза крупного рогатого скота и внедрение усовершенствованной схемы выявления инфекции в хозяйствах с различным эпизоотическим состоянием в условиях Республики Дагестан.
Материалы и методы. Аллергическим исследованиям подвергли 1670 гол. крупного рогатого скота, серологическим – 3502 образца сывороток крови, иммунологическим – 112 проб, бактериологическим – 57 проб патматериала, отобранного от животных, и 76 проб – из объектов внешней среды. В исследовании использовали штаммы культур Mycobacterium bovis, Mycobacterium bovis БЦЖ, Mycobacterium avium, Mycobacterium scrofulaceum.
Результаты. Установлено широкое распространение неспецифических реакций во всех категориях хозяйств республики. Определена диагностическая ценность внутрикожной и внутривенной проб в неблагополучных по туберкулезу стадах, где число дополнительно выявляемых больных составило 9,4%. Реакция связывания комплемента имеет низкую чувствительность и высокую специфичность. Результаты реакции непрямой гемагглютинации в большинстве случаев не подтверждаются классическими методами, что определяет ее низкую специфичность. Из 57 проб биоматериала было изолировано и идентифицировано 39 культур микобактерий: 8 (20,5%) – M. bovis; 31 (79,5%) – нетуберкулезные кислотоустойчивые виды, из которых 29 (93,5%) относятся к II группе по классификации Раньона, 2 (6,5%) – к III группе. Из 76 проб объектов внешней среды изолированы 43 культуры, из которых 2 (4,6%) отнесены к Mycobacterium bovis, 23 (53,5%) – ко II группе и 18 (41,9%) – к III группе по классификации Раньона. Наилучшими ростовыми и ингибирующими постороннюю микрофлору свойствами обладает яичная среда Левенштейна – Йенсена.
Заключение. Полученные данные являются базисной основой для разработки эффективного комплексного метода дифференциальной диагностики туберкулеза крупного рогатого скота.
Ключевые слова
Для цитирования:
Баратов М.О. К совершенствованию дифференциальной диагностики туберкулеза крупного рогатого скота в условиях Республики Дагестан. Ветеринария сегодня. 2025;14(2):164-170. https://doi.org/10.29326/2304-196X-2025-14-2-164-170
For citation:
Baratov M.O. Towards improved differential diagnostics of bovine tuberculosis in the Republic of Dagestan. Veterinary Science Today. 2025;14(2):164-170. https://doi.org/10.29326/2304-196X-2025-14-2-164-170
ВВЕДЕНИЕ
В борьбе с туберкулезом животных в Прикаспийском регионе, в том числе Республике Дагестан, достигнуты определенные успехи. В то же время анализ эпизоотической ситуации на данной территории свидетельствует о том, что степень распространения болезни в субъектах неодинаковая и количество неблагополучных пунктов за последние годы практически не изменилось [1][2][3][4].
Практика показывает, что за реализацией мероприятий по недопущению заноса инфекции в благополучные хозяйства и оздоровлению неблагополучных пунктов должен быть постоянный контроль. Массовые бесконтрольные перемещения скота, продуктов животноводства, кормов создают угрозу заноса возбудителя болезни в благополучные хозяйства. Все эти обстоятельства обуславливают необходимость постоянно совершенствовать меры профилактики и борьбы с туберкулезом крупного рогатого скота (КРС) с учетом изменяющейся эпизоотической обстановки и особенностей современного животноводства [5][6].
Одним из главных вопросов в системе мер борьбы является квалифицированная диагностика, нередко требующая проведения комплексных и специальных исследований, не регламентированных действующими правилами [7][8].
На фоне снижения заболеваемости животных туберкулезом все актуальнее становится проблема неспецифических реакций, проявление которых не связано с заболеванием. В то же время из-за несовершенства методов дифференциации такие реакции наносят большой экономический ущерб, выражающийся в неоправданном убое здорового поголовья и проведении ветеринарно-санитарных мероприятий [9][10].
В силу того что многие аспекты механизмов возникновения указанных реакций остаются неизученными, продолжает иметь место множественность понятий [11][12].
До настоящего времени не до конца выяснены этиологические факторы неспецифической сенсибилизации организма животных к ППД-туберкулину. Данные литературы отечественных и зарубежных исследователей показывают, что основной причиной неспецифической сенсибилизации организма у здоровых животных являются нетуберкулезные микобактерии и кислотоустойчивые актиномицеты, близкородственные по морфологическим, культуральным, физиологическим и генетическим свойствам микобактериям [13][14].
Имеются сообщения, что сенсибилизирующими свойствами к туберкулину обладают и микобактериоподобные микроорганизмы (коринебактерии, нокардии, родококки), имеющие общие группоспецифические данные с микобактериями [3][4][15][16][17].
Вместе с тем установлено, что не все больные туберкулезом животные реагируют на туберкулиновую пробу. Известно также, что при исследовании животных различными методами выявляются реагирующие только на определенную пробу, что, вероятно, связано с хроническим многостадийным течением болезни, воздействием факторов внешней среды, физиологическим состоянием организма и др. [18][19][20][21].
Безусловно, это затрудняет постановку диагноза «туберкулез» и вызывает необходимость использования комплекса диагностических тестов, в числе которых аллергический, серологический, бактериологический и иммунологический. Каждый из этих методов наряду с недостатками имеет и достоинства, благодаря чему и повышается эффективность диагностики [22][23][24].
Следует отметить, что в настоящее время единый алгоритм диагностики не разработан, более того, роль серологических и иммунологических методов, на наш взгляд, часто недооценивается [25][26][27].
В этой связи дальнейшее изучение вопросов сенсибилизации, распространения микобактерий и родственных микроорганизмов в природе, частоты их выделения из биоматериала реагирующих на туберкулин животных и объектов внешней среды, способности сенсибилизировать организм к туберкулину и их эпизоотическое значение имеют большую научную и практическую ценность.
МАТЕРИАЛЫ И МЕТОДЫ
Характер аллергических реакций подтверждали исследованием с использованием внутрикожной и симультанной проб с применением ППД-туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ) согласно «Ветеринарным правилам осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов туберкулеза»1, вступившим в силу 1 марта 2021 г. Всего исследовано 1670 гол. КРС разного возраста (коровы, нетели).
Провели сравнительный анализ результатов исследований: аллергических на основе внутрикожной, внутривенной, пальпебральной, глазной проб в неблагополучных по туберкулезу КРС хозяйствах – 170 гол., симультанной и пальпебральной проб в благополучных хозяйствах – 386 гол.; серологических: РСК с КТА (реакция связывания комплемента с комплексным туберкулезным антигеном) – 1411 образцов сывороток крови, РНГА (реакция непрямой гемагглютинации) с эритроцитарным диагностикумом – 2091 проба; иммунологических: РОК (реакция розеткообразования), РБТЛ (реакция бласттрансформации лимфоцитов), РСЛЛ (реакция специфического лизиса лейкоцитов) – 112 проб; бактериологических – 57 проб биоматериала и 76 проб из объектов внешней среды.
Отбор патматериала (кровь, кусочки пораженной ткани, лимфатические узлы), транспортировку, хранение, предпосевную обработку, подготовку питательных сред проводили согласно «Справочнику по микробиологическим и вирусологическим методам исследования» (под ред. М. О. Биргера, 1982).
В работе использовались эпизоотические штаммы культур Mycobacterium bovis, Mycobacterium bovis БЦЖ, Mycobacterium avium, Mycobacterium scrofulaceum, выделенные из гомогената патологического материала и объектов внешней среды, а также коллекционные штаммы этих культур, хранящиеся в лаборатории.
Биоматериал от реагировавшего на туберкулин КРС из неблагополучных по туберкулезу хозяйств обрабатывали по методу Аликаевой.
Кусочки патологического материала измельчали в фарфоровой ступке, растирали с битым стеклом, гомогенат разливали в стерильные флаконы в равных частях 1:1 с 3%-м раствором C12H25SO4Na (лаурилсульфат натрия), после перемешивания оставляли при комнатной температуре на 20 мин. Затем флаконы с гомогенатом центрифугировали в течение 20 мин при 1500 об/мин, сливали надосадочную жидкость, осадок промывали двукратно стерильной дистиллированной водой и проводили посевы на среды Левенштейна – Йенсена, Финн-2, Петраньяни, Гельберга и модифицированную среду Школьниковой с целью обнаружения и исключения дефектных по клеточной стенке форм микобактерий – L-форм.
Пробы из объектов внешней среды (сено, солома, соскобы с кормушек, почва, навоз) измельчали, заливали физраствором, растирали и разливали по флаконам в соотношении 1:1 с 5%-м раствором H2SO4 (серной кислоты) и оставляли при комнатной температуре на 30 мин. Затем флаконы центрифугировали при 1500 об/мин в течение 20 мин, сливали надосадочную жидкость, промывали осадок двукратно центрифугированием и использовали для посева. Каждую пробу из осадка высевали в 8 пробирках и инкубировали в термостате при температуре 37–38 °С.
Дифференциацию возбудителей туберкулеза и атипичных микобактерий проводили в соответствии с ГОСТ 26072–89 (СТ СЭВ 3457-81) «Животные и птица сельскохозяйственные. Методы лабораторной диагностики туберкулеза»2 и ГОСТ 27318–87 (СТ СЭВ 5627–86) «Животные сельскохозяйственные. Методы идентификации атипичных микобактерий»3.
Все манипуляции с животными выполняли в соответствии с Европейской конвенцией ETS № 123.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ результатов аллергических исследований свидетельствует о том, что в Республике Дагестан у КРС ответные реакции на ППД-туберкулин для млекопитающих распространены повсеместно, независимо от природно-климатических зон.
Количество реагирующих животных во всех категориях хозяйств составило 30,9% от числа исследованных, причем значительная часть – в благополучных хозяйствах, что указывает на широкое распространение неспецифических реакций у здорового КРС.
Следует отметить, что число реагирующих на туберкулин особей в благополучных хозяйствах горных и предгорных районов незначительно меньше, чем в хозяйствах равнинной зоны (табл. 1).
Таблица 1
Соотношение реагирующего на туберкулин и больного туберкулезом КРС в Республике Дагестан в 2022–2023 гг.
Table 1
Percentage ratio of tuberculin reactors and tuberculosis-infected cattle in the Republic of Dagestan in 2022–2023
|
Зона |
Исследовано КРС, гол. |
Количество реагирующего на туберкулин КРС |
Выявлено больного КРС, гол. |
Соотношение реагирующего и больного КРС, % |
|
|
гол. |
% |
||||
|
Горная |
167 |
45 |
26,9 |
2 |
4,44 |
|
Предгорная |
182 |
59 |
32,4 |
– |
– |
|
Равнинная |
201 |
66 |
32,8 |
4 |
6,06 |
|
Всего |
550 |
170 |
30,9 |
6 |
3,5 |
Приведенные цифры достоверно отличаются от ранее опубликованных данных, где отмечалась зависимость количества реагирующих на туберкулин животных от вертикальной зональности. Сопоставительный картографический анализ свидетельствует, что во второй половине прошлого века и начале текущего регистрировалась зависимость количества как реагирующих на туберкулин, так и подтвержденных на туберкулез диагнозов от численности и плотности размещения животных и приуроченности к равнинной зоне.
Полученные результаты свидетельствуют об отсутствии достоверных различий в численности реагирующих на туберкулин и больных туберкулезом животных в зависимости от природно-климатической зональности. Значительное количество реагирующих (45) и с выявленным туберкулезом (2) животных во всех категориях хозяйств в горной зоне (соотношение 4,44%), несмотря на наличие факторов, способствующих повышению иммунного статуса, объясняется беспорядочными бесконтрольными межхозяйственными связями, огромным количеством перегоняемого сезонного скота и большой долей случаев ввоза кормов из равнинной зоны.
Следует отметить, что отсутствие подтвержденного диагноза у КРС из числа реагирующих животных в предгорной зоне не следует интерпретировать как благополучие в пределах данной зоны, поскольку выявление больных животных ранее здесь происходило с не меньшей частотой, чем в равнинной зоне. Приводимые данные следует считать промежуточными и должны подтверждаться ежегодно.
Необходимо указать, что число реагирующего на туберкулин КРС заметно возрастает в весенние и осенние месяцы. На этот период приходится более 80% случаев выявления реагирующих животных от общего количества за год.
В целях сравнительного изучения эффективности различных аллергических методов в диагностике туберкулеза в неблагополучных хозяйствах были проведены исследования 170 гол. КРС внутрикожной, внутривенной, пальпебральной и глазной пробами (рис. 1).
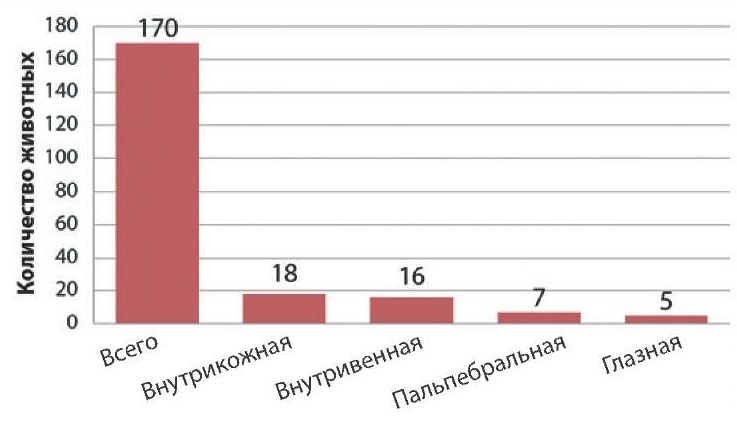
Рис. 1. Определение диагностической ценности аллергических проб в неблагополучных по туберкулезу хозяйствах
Fig. 1. Assessment of diagnostic value of tuberculin tests in tuberculosis-infected farms
В результате определены диагностическая ценность внутрикожной и внутривенной проб и их место в системе плановых исследований на туберкулез. Установлено, что для исследования животных из неблагополучных по туберкулезу стад наиболее результативным является их комплексное применение. При этом численность дополнительно выявляемых больных животных составляла 9,4%. Данный метод оказался эффективным и при первичной постановке диагноза для дифференциации неспецифических реакций на туберкулин.
При сравнительном испытании симультанной и пальпебральной проб на животных из благополучных хозяйств при первичной постановке диагноза (исследовано 386 гол.) получили неопределенные результаты (рис. 2): при применении симультанной пробы на ППД-туберкулин реагировало 19 гол. (4,9%), КАМ – 15 гол. (3,9%); при пальпебральном введении туберкулина – 4 гол. (1,0%).
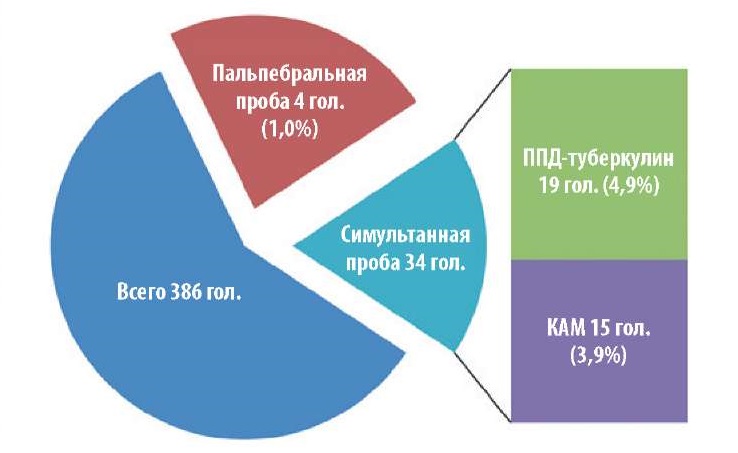
Рис. 2. Результаты сравнительного испытания симультанной и пальпебральной проб
Fig. 2. Results of comparative analysis of simultaneous and palpebral tests
В современных условиях, когда в Республике Дагестан сосредоточено 21,3% российского поголовья мелкого рогатого скота (1-е место в России), 5,3% поголовья крупного рогатого скота (3-е место), большая часть которого содержится в частных подворьях, важно определить эффективный метод дифференциации неспецифических реакций. Официально регламентированный метод симультанной пробы в этих условиях оказался неприемлем, проведение диагностического убоя по показаниям внутрикожной пробы не разрешено действующими правилами. Исследования показали, что в данном случае наиболее эффективной оказалась внутривенная проба, особенно при исследовании нескольких голов КРС частного владельца.
Сравнительный анализ показал, что при патолого-анатомическом осмотре и лабораторных исследованиях биоматериала от животных, реагировавших одновременно на внутрикожную и внутривенную пробы, в 95,8% случаев подтверждается туберкулез. Кроме того, в длительно неблагополучных по туберкулезу стадах внутривенная проба дополнительно выявляет анергичных к туберкулину животных, численность которых, по многочисленным данным, составляет от 0,2 до 0,7%.
В целях изучения частоты выявления реагирующих на внутрикожную пробу животных, находящихся в стойло-пастбищных условиях, провели исследования в частных подворьях двух населенных пунктов предгорной зоны (Карабудахкентский и Буйнакский районы – 167 гол.) и хозяйствах разных форм собственности равнинной зоны (СПК «Львовское» Бабаюртовского района – 123 гол., КФХ «Тельмана» Кизлярского района – 274 гол.). Результаты представлены на рисунке 3.
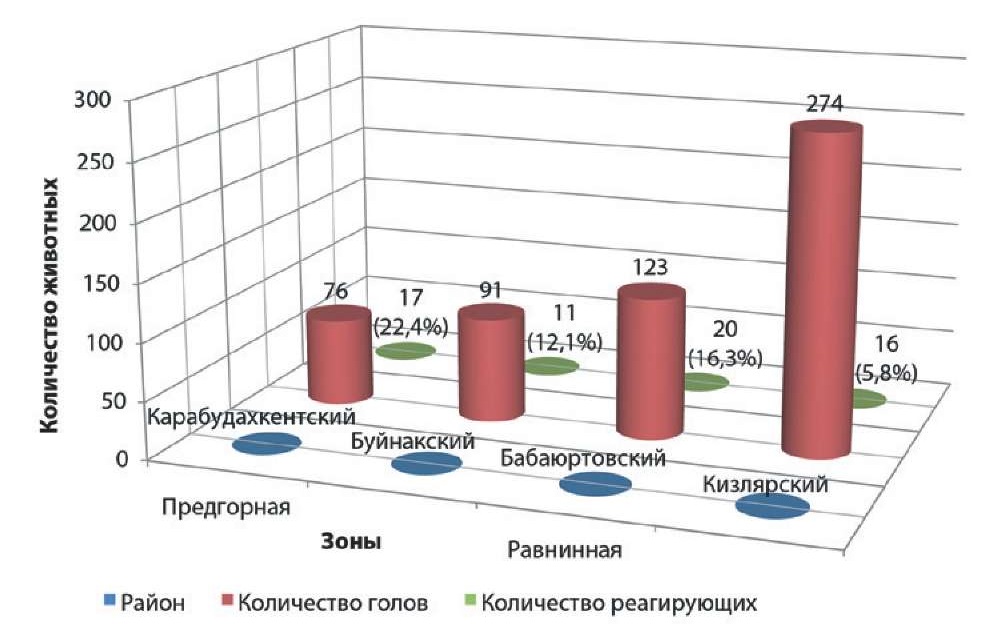
Рис. 3. Количество реагирующих на туберкулин животных, откармливаемых в стойло-пастбищных условиях
Fig. 3. Number of tuberculin reactors raised in stall/pasture conditions
Установлено, что во всех хозяйствах, кроме КФХ «Тельмана» Кизлярского района, количество реагирующего на ППД-туберкулин КРС составило более 10%.
Анализ результатов серологических исследований основан на параллельном использовании аллергических методов: 1411 проб сывороток крови животных в РСК с КТА и 2091 проба в РНГА с тремя эритроцитарными диагностикумами (M. bovis, M. avium, M. fortuitum). При этом не было обнаружено достоверной корреляции между количеством реагирующих на внутрикожную пробу и численностью животных, в сыворотках крови которых были обнаружены диагностические титры антител в серологических реакциях.
Низкая чувствительность и высокая специфичность РСК (от 85 до 100%) определяют ее место в диагностике. Считаем, что РСК с успехом можно использовать для выявления анергичных животных в длительно неблагополучных оздоравливаемых стадах. Наши наблюдения показывают, что число таких животных в отдельных хозяйствах может доходить до 10%.
Результаты высокочувствительной реакции РНГА с эритроцитарным диагностикумом в большинстве случаев не подтверждаются данными классических методов (патолого-анатомическим и лабораторным), что определяет ее низкую специфичность при выявлении туберкулеза. Данная реакция с несколькими диагностикумами может служить как дополнительный тест для дифференциации неспецифических реакций на туберкулин.
Изучение результатов тестов клеточного иммунитета (РОК, РБТЛ, РСЛЛ) показало, что они достаточно специфичны и чувствительны, однако их применение при массовых исследованиях практически невозможно из-за сложности методики постановки и они могут быть использованы в научных целях.
Результаты бактериологического анализа продемонстрировали, что M. bovis выделяется в чистой культуре практически во всех случаях исследования проб биоматериала от животных с характерными туберкулезными изменениями и примерно в 6% случаев при отсутствии таковых.
Из 57 проб биоматериала было изолировано и идентифицировано 39 культур микобактерий: 8 (20,5%) – M. bovis; 31 (79,5%) – нетуберкулезные кислотоустойчивые виды, из которых 29 (93,5%) относятся к II группе по классификации Раньона, 2 (6,5%) – к III группе.
Из объектов внешней среды было отобрано 76 проб, удалось изолировать 43 культуры, из которых 2 (4,6%) отнесены к M. bovis, 23 (53,5%) – к II группе, 18 (41,9%) – к III группе по классификации Раньона (табл. 2).
Таблица 2
Количество изолированных культур из объектов внешней среды и биоматериала
Table 2
Number of isolates from environmental and biological samples
|
Пробы |
Количество |
Изолировано |
Идентифицировано |
|||||
|
M. bovis |
Нетуберкулезные виды |
|||||||
|
II группа Раньона |
III группа Раньона |
|||||||
|
ед. |
% |
ед. |
% |
ед. |
% |
|||
|
Из биоматериала |
57 |
39 |
8 |
20,5 |
29 |
93,5 |
2 |
6,5 |
|
Из объектов внешней среды |
76 |
43 |
2 |
4,6 |
23 |
53,5 |
18 |
41,9 |
Выявлена нестабильность частоты изолирования отдельных видов микобактерий из биоматериала от животных в различные периоды эпизоотического процесса. Если в стадии проявления и развития данного процесса число изолирования M. bovis составляло около 40%, то на стадии угасания оно соответствовало 14%. Аналогичные изменения наблюдались и в группах нетуберкулезных микобактерий.
Следует отметить параллелизм в частоте и количестве выделения нетуберкулезных микобактерий из биоматериала и объектов внешней среды примерно в равных соотношениях во всех природно-климатических зонах.
Испытание ростовых свойств различных питательных сред проводили путем посева 34 культур микобактерий: 7 (20,6%) по результатам идентификации относились к М. bovis, 27 (79,4%) – к нетуберкулезным кислотоустойчивым видам, из них 11 (40,7%) принадлежали к II группе и 16 (59,3%) – к III группе по классификации Раньона. Высеваемость оценивали по количеству колоний и скорости роста (табл. 3).
Таблица 3
Показатели высеваемости на разных питательных средах
Table 3
Isolation rates for different nutrient media
|
Питательная среда |
M. bovis |
M. bovis БЦЖ |
М. avium |
M. scrofulaceum |
||||
|
Количество колоний |
Скорость роста, сут |
Количество колоний |
Скорость роста, сут |
Количество колоний |
Скорость роста, сут |
Количество колоний |
Скорость роста, сут |
|
|
Левенштейна – Йенсена |
15 |
17–19 |
10 |
8 |
19 |
8 |
16 |
7 |
|
Финн-2 |
9 |
17 |
6 |
7 |
17 |
11 |
13 |
6 |
|
Петраньяни |
5 |
20 |
7 |
6 |
10 |
12 |
8 |
10 |
|
Гельберга |
6 |
24 |
3 |
8 |
6 |
10 |
4 |
8 |
На среде Левенштейна – Йенсена регистрировали заметный рост как M. bovis (15 колоний без сопутствующей микрофлоры через 17–19 сут), так и нетуберкулезных микобактерий (19 колоний М. avium через 8 сут и 16 колоний M. srofulaceum через 7 сут). Среда Финн-2 незначительно уступала как по скорости роста, так и по количеству колоний (9 мелких колоний M. bovis через 17 сут; 6, 17, и 13 колоний M. bovis БЦЖ, М. avium и M. srofulaceum соответственно через 6–11 сут). На остальных средах культура росла медленно в виде мелких колоний.
ВЫВОДЫ
- Показана эффективность комплекса дифференциально-диагностических тестов, включающего пальпебральную, внутривенную и внутрикожную туберкулиновую пробы. Комплексное использование этих проб обеспечивает полноту выявления больных животных в неблагополучных по туберкулезу стадах и надежность дифференциации неспецифических реакций на ППД-туберкулин для млекопитающих.
- Исследования, проведенные за последние 3 года, указывают на высокую частоту выявления реагирующих на туберкулин животных, число которых в отдельных хозяйствах достигает более 18%. В большинстве случаев природа данных реакций остается невыясненной.
- Анализ результатов серологических исследований указал на достаточно высокую специфичность РСК при диагностике туберкулеза. Считаем целесообразным применение данной реакции в качестве дополнительного метода, в частности для выявления анергичных к туберкулину животных. Серологическая (РНГА) и иммунологические реакции (РБТЛ, РСЛЛ и РОК) не нашли в настоящее время широкого применения для диагностики туберкулеза животных на практике, оставаясь при этом интересными для науки.
- Сравнительное изучение наиболее часто используемых в лабораторных условиях сред показало, что яичная среда Левенштейна – Йенсена по высеваемости и скорости роста как типичных, так и нетуберкулезных форм микобактерий превосходит остальные. По высеваемости среда Финн-2 заметно уступает, хотя по скорости роста в ряде случаев превосходит среду Левенштейна – Йенсена.
Вклад автора: Баратов М. О. – формулировка ключевых целей и задач исследования, проведение исследований, сбор, анализ и интерпретация полученных данных, создание рисунков и таблиц, подготовка рукописи.
Contribution of the author: Baratov M. O. – formulation of key research objectives and tasks, testing, data collection, analysis, and interpretation, design of graphical elements and tables, paper drafting.
1. https://docs.cntd.ru/document/565721619
2. https://docs.cntd.ru/document/1200025492
3. https://docs.cntd.ru/document/1200025497
Список литературы
1. Баратов М. О., Сакидибиров О. П., Ахмедов М. М. Эпизоотические особенности туберкулеза крупного рогатого скота. Экологические проблемы сельского хозяйства и научно-практические пути их решения: сборник научных трудов Международной научнопрактической конференции (Махачкала, 5–6 июня 2017 г.). Махачкала: Дагестанский ГАУ; 2017; 102–108. https://elibrary.ru/zgksmn
2. Баратов М. О. К совершенствованию диагностики туберкулеза крупного рогатого скота. Ветеринария сегодня. 2020; (4): 261–265. https://doi.org/10.29326/2304-196X-2020-4-35-261-265
3. Баратов М. О., Сакидибиров О. П. Туберкулез крупного рогатого скота в Республике Дагестан: проблемы и перспективы. Ветеринария. 2021; (1): 24–28. https://doi.org/10.30896/0042-4846.2021.24.1.24-28
4. Нуратинов Р. А., Газимагомедов М. Г. Туберкулез. Махачкала: Планета-Дагестан; 2009. 336 с.
5. Гулюкин М. И., Найманов А. Х., Овдиенко Н. П., Ведерников В. А., Верховский О. А., Толстенко Н. Г. и др. Методические наставления по проведению исследований при микобактериозах животных. М.: ГНУ ВНИИЭВ им. Я. Р. Коваленко; 2012. 85 с.
6. Донченко А. С., Овдиенко Н. П., Донченко Н. А. Диагностика туберкулеза крупного рогатого скота: монография. Новосибирск: Сибирское отделение РАСХН; 2004. 308 с.
7. Найманов А. Х., Овдиенко Н. П., Помыканов Н. П. Диагностика туберкулеза крупного рогатого скота в индивидуальных хозяйствах. Актуальные проблемы инфекционной патологии и иммунологии животных: материалы конференции (Москва, 16–17 мая 2006 г.). М.: ИзографЪ; 2006; 297–302. https://elibrary.ru/vyftgj
8. Камалиева Ю. Р. Ретроспективный анализ частоты проявления неспецифических реакций на туберкулин у крупного рогатого скота в Республике Татарстан. Молодежные разработки и инновации в решении приоритетных задач АПК: материалы Международной научной конференции. Т. 1. Казань: Казанская ГАВМ; 2020; 278–280. https://elibrary.ru/vwhcco
9. Баратов М. О., Гусейнова П. С. К поиску причин сенсибилизации крупного рогатого скота к ППД-туберкулину для млекопитающих. Ветеринария сегодня. 2021; 10 (4): 271–276. https://doi.org/10.29326/2304196X-2021-10-4-271-276
10. Дорожко В. П. Специфическая стимуляция при серологической диагностике туберкулеза крупного рогатого скота: автореф. дис. … кан. вет. наук. Киев; 1971. 20 с.
11. Муковнин А. А., Найманов А. Х., Гулюкин А. М. Туберкулез крупного рогатого скота в России. Ветеринария. 2020; (7): 19–24. https://doi.org/10.30896/0042-4846.2020.23.7.19-24
12. Мингалеев Д. Н. Новые средства и методы профилактики туберкулеза молодняка крупного рогатого скота: автореф. дис. … д-ра вет. наук. Казань; 2018. 42 с.
13. Ионина С. В., Донченко Н. А., Донченко А. С. Взаимосвязь циркуляции атипичных микобактерий туберкулеза во внешней среде с проявлением туберкулиновых реакций у сельскохозяйственных животных. Инновации и продовольственная безопасность. 2016; (1): 41–44. https://doi.org/10.31677/2311-0651-2016-0-1-41-44
14. Бокова Т. В. Частота неспецифического реагирования на ППД туберкулин крупного рогатого скота, инфицированного BLV, и разработка схем оздоровления племенных стад от лейкоза в Алтайском крае: автореф. дис. … канд. вет. наук. Барнаул; 2001. 27 с.
15. Azuma I., Ajisaka M., Yamamura Y. Polysaccharides of Mycobacterium bovis Ushi 10, Mycobacterium smegmatis, Mycobacterium phlei, and atypical Mycobacterium P1. Infection and Immunity. 1970; 2 (3): 347–349. https://doi.org/10.1128/iai.2.3.347-349.1970
16. Harriff M. J., Cansler M. E., Toren K. G., Canfield E. T., Kwak S., Gold M. C., Lewinsohn D. M. Human lung epithelial cells contain Mycobacterium tuberculosis in a late endosomal vacuole and are efficiently recognized by CD8+ T cells. PLoS ONE. 2014; 9 (5):e97515. https://doi.org/10.1371/journal.pone.0097515
17. Monin L., Griffiths K. L., Slight S., Lin Y., Rangel-Moreno J., Khader S. A. Immune requirements for protective Th17 recall responses to Mycobacterium tuberculosis challenge. Mucosal Immunology. 2015; 8 (5): 1099–1109. https://doi.org/10.1038/mi.2014.136
18. Власенко В. С. Оптимизация методов контроля и коррекции иммунного статуса при туберкулезе и лейкозе крупного рогатого скота: автореф. дис. … д-ра биол. наук. Казань; 2011. 43 с.
19. Протодьяконова Г. П. Эпизоотологические и эпидемиологические особенности туберкулеза в Якутии, усовершенствование методов диагностики и специфической профилактики: автореф. дис. … д-ра вет. наук. Новосибирск; 2015. 35 с.
20. Carneiro P. A. M., de Moura Sousa E., Viana R. B., Monteiro B. M., Do Socorro Lima Kzam A., de Souza D. C., et al. Study on supplemental test to improve the detection of bovine tuberculosis in individual animals and herds. BMC Veterinary Research. 2021; 17:137. https://doi.org/10.1186/s12917-021-02839-4
21. Khairullah A. R., Moses I. B., Kusala M. K. J., Tyasningsih W., Ayuti S. R., Rantam F. A., et al. Unveiling insights into bovine tuberculosis: a comprehensive review. Open Veterinary Journal. 2024; 14 (6): 1330–1344. https://doi.org/10.5455/OVJ.2024.v14.i6.2
22. Петров Р. В., Хаитов Р. М. Основы иммунитета и иммунная биотехнология. Вестник Российской академии медицинских наук. 2000; (11): 18–21.
23. Tizard I. R. Veterinary Immunology: an Introduction. 6th ed. Philadelphia: Saunders; 2000. 482 p.
24. Ramos D. F., Silva P. E., Dellagostin O. A. Diagnosis of bovine tuberculosis: review of main techniques. Brazilian Journal of Biology. 2015; 75 (4): 830–837. https://doi.org/10.1590/1519-6984.23613
25. Barksdale L., Kim K. S. Mycobacterium. Bacteriological Reviews. 1977; 41 (1): 217–372. https://doi.org/10.1128/br.41.1.217-372.1977
26. Радченков В. П., Соколовская И. И. Розеткообразующие лимфоциты крупного рогатого скота и рациональные методы их выявления. Сельскохозяйственная биология. 1983; (12): 87–91.
27. Джупина С. И. Фундаментальные знания эпизоотического процесса – основа контроля туберкулеза крупного рогатого скота. Ветеринарная патология. 2004; (1–2): 45–47. https://elibrary.ru/hsowdp
Об авторе
М. О. БаратовРоссия
Баратов Магомед Омарович, д-р вет. наук, главный научный сотрудник, заведующий лабораторией инфекционной патологии сельскохозяйственных животных
ул. Дахадаева, 88, г. Махачкала, 367000.
Рецензия
Для цитирования:
Баратов М.О. К совершенствованию дифференциальной диагностики туберкулеза крупного рогатого скота в условиях Республики Дагестан. Ветеринария сегодня. 2025;14(2):164-170. https://doi.org/10.29326/2304-196X-2025-14-2-164-170
For citation:
Baratov M.O. Towards improved differential diagnostics of bovine tuberculosis in the Republic of Dagestan. Veterinary Science Today. 2025;14(2):164-170. https://doi.org/10.29326/2304-196X-2025-14-2-164-170
JATS XML



































