Перейти к:
Выделение аденовируса собак 2-го серотипа и определение параметров культивирования
https://doi.org/10.29326/2304-196X-2024-13-4-352-359
Аннотация
Аденовирусная инфекция собак, вызванная аденовирусом 2-го серотипа, является преимущественно респираторным заболеванием, которое классически проявляется поражением органов дыхательной системы. Заболеваемость собак инфекционным ларинготрахеитом наиболее часто регистрируется в центральной части Российской Федерации и имеет тенденцию к росту. В связи с этим сохраняется актуальность профилактической иммунизации против данного заболевания. В первую очередь для формирования длительного и напряженного иммунитета у животных при изготовлении вакцины необходимо использовать штаммы вируса, распространенные на конкретной территории и актуальные на данный отрезок времени. Целью данного исследования являлось выделение возбудителя аденовироза собак 2-го типа из биологического материала от животных с признаками аденовирусной инфекции, обладающего устойчивостью на протяжении пяти и более пассажей, а также определение параметров его культивирования. В результате эксперимента было выделено пять изолятов вируса, один из которых обладал оптимальными свойствами для использования при производстве вакцинных препаратов. При проведении сравнительного анализа чувствительности к выделенному вирусу перевиваемых культур клеток Vero, MDCK линий NBL-2 и NBL-9, а также первично трипсинизированных культур клеток (почка щенка, селезенка щенка, почка котенка, селезенка котенка) было установлено, что наиболее чувствительной является клеточная культура MDCK линии NBL-2. Следующим этапом было определение параметров культивирования вируса в данной культуре клеток. В результате установлены оптимальные условия, при которых происходит накопление вируса в максимальных титрах: возраст монослоя культуры клеток для заражения – 48 ч, множественность заражения – 0,01 ТЦД50/кл, время предварительного контакта – 60 мин, температура – (37,0 ± 0,5) °С, срок культивирования – 120 ч.
Ключевые слова
Для цитирования:
Климова А.А. Выделение аденовируса собак 2-го серотипа и определение параметров культивирования. Ветеринария сегодня. 2024;13(4):352-359. https://doi.org/10.29326/2304-196X-2024-13-4-352-359
For citation:
Klimova A.A. Canine adenovirus serotype 2 isolation and determination of its cultivation parameters. Veterinary Science Today. 2024;13(4):352-359. https://doi.org/10.29326/2304-196X-2024-13-4-352-359
ВВЕДЕНИЕ
Аденовирусная инфекция собак (инфекционный ларинготрахеит), вызванная аденовирусом 2-го серотипа (CAV-2), является преимущественно респираторным заболеванием, классическим проявлением которого является поражение органов дыхательной системы [1-3]. Возбудитель инфекции широко распространен в центральной части Российской Федерации из-за плотной популяции собак и регулярного проведения мероприятий, для которых характерно скученное содержание животных. Несмотря на регулярную профилактическую вакцинацию животных, заболеваемость инфекционным ларинготрахеитом имеет тенденцию к росту.
Аденовирус собак 2-го серотипа относится к сфере Varidnaviria, царству Bamfordvirae, типу Preplasmiviricota, классу Tectiliviricetes, отряду Rowavirales, семейству Adenoviridae, роду Mastadenovirus, виду Mastadenovirus canidae. Внесен в реестр Международного комитета по систематике вирусов (International Committee on Taxonomy of Viruses, ICTV) в 1976 г. [4]. Был впервые выделен в Канаде в 1961 г. [5].
В настоящий момент известно два серотипа возбудителя аденовирусной инфекции собак: 1-й серотип (Canine adenovirus 1, CAV-1) характеризуется генерализованным влиянием на организм животного, поражает большинство основных органов и вызывает инфекционный гепатит; вирус 2-го серотипа (Canine adenovirus 2, CAV-2), как и многие представители рода Mastadenovirus, характеризуется локальным действием и вызывает преимущественно поражение органов респираторного тракта, реже – желудочно-кишечного тракта [2][6-9].
Аденовирус собак 1-го серотипа (CAV-1) более вирулентен по сравнению с CAV-2. Возбудитель 2-го серотипа является безоболочечным ДНК-вирусом, ослабленным вариантом CAV-1, с которым имеет общность нуклеотидной последовательности около 75% [10]. Коинфекция с другими вирусами повышает патогенность аденовирусов [11].
Аденовирус собак 2-го серотипа был зарегистрирован у собак, енотов, лошадей, крупного рогатого скота, кошек и волков. Субклинически присутствует в популяции диких плотоядных [11-14].
Необходимо отметить, что симптомокомплекс, называемый «инфекционный ларинготрахеит собак» (или «вольерный кашель»), вызывают многие микроорганизмы, к числу которых, помимо аденовируса 2-го серотипа, относятся такие возбудители, как вирус чумы плотоядных, герпесвирус собак, вирус парагриппа собак, вирус гриппа собак, респираторный коронавирус собак, пневмовирус собак, а также следующие бактерии: Mycoplasma cynos, Bordetella bronchiseptica и подвид Streptococcus equi [3][15-18]. Бокавирус и гепацивирус собак в редких случаях вызывают симптомы заболевания респираторного тракта и не рассматриваются при дифференциации [19].
В отношении культивирования CAV-2 представлены различные сведения. Известно, что аденовирусы наилучшим образом размножаются в клетках тех видов животных, которые являются их природными хозяевами [6]. К вирусу наиболее чувствительны культуры клеток почки собаки и не чувствительны другие виды клеточных культур собачьего происхождения. Не чувствительны также к вирусу первичные или перевиваемые культуры клеток других млекопитающих, таких как люди, овцы, обезьяны. В мировой практике как оптимальная система культивирования CAV-2 зарекомендовала себя перевиваемая культура клеток почки собаки Мадина – Дарби (Madin – Darby Canine Kidney, MDCK) [11][20-22]. Согласно другим исследованиям, CAV-2 возможно культивировать в том числе в культуре клеток Vero (перевиваемая культура клеток почки африканской зеленой мартышки) [7].
Целью данного исследования являлось выделение аденовируса собак 2-го серотипа, обладающего устойчивостью на протяжении пяти и более пассажей, а также определение параметров его культивирования.
Подбор культур клеток для размножения вируса CAV-2 осуществляли на основании имеющихся в наличии клеточных линий путем серийных пассажей из числа основных, используемых для культивирования вирусов собак и рекомендованных для культивирования аденовирусов.
Общепринято для выделения вируса использовать первичную линию клеток естественно восприимчивых животных, которые, как правило, являются более чувствительными для заражения. В связи с этим для проведения первого пассажа была выбрана первично трипсинизированная культура клеток почки щенка. Также данная культура клеток приоритетна для выделения вируса из патологического материала вследствие высокой потенции эмбриональных клеток к росту.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы биоматериала (смывы из носовой и ротовой полости) были получены от собак с подозрением на аденовирусную инфекцию, которые поступали в ветеринарные клиники и приюты Владимирской, Вологодской и Нижегородской областей в период с 2019 по 2022 г.
Диагностика. Для подтверждения наличия CAV-2 в материале и проведения дифференциальной диагностики методом полимеразной цепной реакции (ПЦР) использовалась коммерческая тест-система «АДЕНОВИР» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия).
В процессе пассирования вируса CAV-2 для определения наличия антигена вируса применялась иммунохроматографическая тест-система Asan Easy Test CAV2 (Asan Pharmaceutical Co., Ltd., Корея) согласно инструкции производителя.
Культуры клеток. Для исследования были отобраны: перевиваемые культуры клеток MDCK (линии NBL-2 и NBL-9) и Vero, первично трипсинизированные клеточные культуры почки щенка, селезенки щенка, почки котенка, селезенки котенка. Исходная концентрация клеток в клеточной суспензии для MDCK линий NBL-2 и NBL-9 составила 400 тыс/см3, для культур клеток Vero – 200–250 тыс/см3, для первично трипсинизированных культур клеток – 300–400 тыс/см3. Критерием выбора культуры клеток для заражения являлся полностью сформированный монослой без признаков дегенерации клеток. Для данных культур клеток был применен стационарный способ культивирования при температуре (37,0 ± 0,5) °С.
При проведении пассажей использовались пластиковые культуральные флаконы с рабочей площадью поверхности 25 см3 (Т25).
Питательные среды. Согласно паспортам на культуры клеток были использованы следующие питательные среды: в качестве ростовой среды для культуры клеток MDCK – ПСП (питательная среда полусинтетическая) с добавлением 5% сыворотки крупного рогатого скота, антибиотиков (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3) и в качестве поддерживающей среды – ПСП без сыворотки; в качестве ростовой среды для перевиваемой культуры клеток Vero и первично трипсинизированных культур – ПСС (питательная среда синтетическая) с добавлением глютамина (0,584 г/л), 10% сыворотки крупного рогатого скота, антибиотиков (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3) и в качестве поддерживающей среды – ПСС с добавлением антибиотиков без сыворотки.
Подготовка материала для внесения в культуру клеток. Вируссодержащую суспензию отфильтровали при помощи мембранного фильтра Millipore, MCE, 20 мкм (Merck Millipore, США), центрифугировали при 3000 об/мин в течение 15 мин. Далее отбирали надосадочную жидкость, добавляли антибиотики (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3) и после экспозиции в течение 1 ч при температуре 2–8 °С использовали для заражения культуры клеток.
Выделение вируса производили на первично трипсинизированной культуре клеток почки щенка.
Заражение культуры клеток. Для каждого пассажа аденовируса собак 2-го серотипа использовали три культуральных флакона Т25. Перед инокуляцией вируса на клеточный монослой ростовую питательную среду сливали, монослой трехкратно отмывали раствором Хенкса и вводили вируссодержащую суспензию; множественность заражения составила 0,01 ТЦД50/кл. Культуральные флаконы помещали в термостат с соблюдением температурного режима (37,0 ± 0,5) °С на 1 ч. По прошествии 1 ч вносили поддерживающую питательную среду, помещали культуральные флаконы в термостат при температуре (37,0 ± 0,5) °С и просматривали под инвертированным микроскопом каждые 12 ч на наличие характерных морфологических изменений клеток: при поражении монослоя более 80% флаконы подвергали замораживанию при температуре минус (45 ± 5) °С до следующего пассажа.
Также было изучено влияние следующих факторов на уровень титра инфекционной активности вируса:
– время культивирования;
– температура культивирования;
– возраст монослоя культуры клеток;
– множественность заражения;
– время предварительного контакта.
Титрование вируса проводилось по общепринятой методике [23][24] в трех повторностях для каждого образца. Использовались 96-луночные плоскодонные микропланшеты Costar® (Corning, США). После внесения компонентов реакции планшеты культивировали 5 сут (120 ч) при температуре (37 ± 0,5) °С, концентрации СО2 5% и просматривали ежедневно под инвертированным микроскопом. Титр вируса оценивали по количеству лунок с цитопатогенным действием. Расчет титра проводили по методу Кербера и выражали в lg ТЦД50/см3.
Анализ результатов. Результаты, полученные в ходе исследований, обрабатывали в программе для работы с электронными таблицами Microsoft Office Exсel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Патологический материал, отобранный для выделения вируса, предварительно был исследован методом ПЦР для выявления наличия вирусного генома CAV-2. Пробы, положительные в ПЦР, были использованы в дальнейшей работе. Для выделения аденовируса собак 2-го серотипа была использована первично трипсинизированная культура клеток почки щенка. Данные о титрах инфекционной активности после первого пассажа представлены в таблице 1.
Установлено, что все изоляты, наличие генома CAV-2 в которых было подтверждено методом ПЦР, обладали инфекционной активностью в различной степени и их использование в работе было целесообразным.
С целью оценки репродуктивной способности и стабильности вируса были проведены пять последовательных пассажей в первично трипсинизированной культуре клеток почки щенка. Результаты исследования представлены в таблице 2.
Исходя из полученных данных, для дальнейшего культивирования был отобран вируссодержащий материал изолята № 5 (в дальнейшем получивший название «Юнити»), так как он обладал стабильностью в течение пяти пассажей, характерное цитопатическое действие (ЦПД) вируса проявлялось на уровне каждого пассажа; титр инфекционной активности находился в пределах от (3,33 ± 0,29) до (4,33 ± 0,29) lg ТЦД50/см3. Вируссодержащие материалы изолятов № 1, 2, 3, 4, титр которых был ниже 3,0 lg ТЦД50/см3, в дальнейшем исследовании не использовали. На следующих этапах при изучении культуральных свойств вируса был использован материал изолята № 5 третьего пассажа с максимальным для данного изолята титром.
На уровне первого пассажа проявление ЦПД аденовируса собак 2-го серотипа отмечали через 24 ч после внесения вируссодержащей суспензии в культуру клеток. Поражение монослоя на площади 80% наблюдали через 72 ч. На уровне второго и дальнейших пассажей морфологические изменения клеток отмечали через 24–48 ч, поражение монослоя на площади 80% регистрировали через 72–120 ч.
Для изучения чувствительности различных культур клеток к CAV-2 было проведено пять последовательных пассажей. В чувствительных культурах клеток ЦПД вируса проявлялось однотипно и наблюдалось с первого пассажа. Титр инфекционной активности CAV-2 определяли путем микротитрования в культуре клеток MDCK. При отсутствии цитопатического действия наличие антигена в культуральной жидкости устанавливали при помощи иммунохроматографической тест-системы. При получении отрицательного результата на протяжении двух пассажей дальнейшие исследования на культуре клеток не проводились. Титр инфекционной активности вируса в отобранных культурах клеток представлен в таблицах 2 (для культуры клеток почки щенка) и 3 (для других клеточных культур).
Установили, что в перевиваемой культуре клеток Vero, первично трипсинизированных клеточных культурах почки котенка и селезенки котенка аденовирус собак 2-го серотипа не накапливается, видимых морфологических изменений клеток выявлено не было; иммунохроматографическая тест-система показала отсутствие антигена возбудителя аденовирусной инфекции собак в культуральной жидкости начиная со второго пассажа. При микротитровании титр вируса не был определен. Культивирование вируса в первично трипсинизированной клеточной культуре селезенки щенка приводило к постепенному снижению инфекционной активности вируса. Учитывая полученные результаты, использование указанных культур клеток для культивирования нецелесообразно.
Инфекционная активность вируса в первично трипсинизированной культуре клеток почки щенка составила (4,33 ± 0,29) lg ТЦД50/см3 на уровне третьего пассажа; титр вируса в перевиваемой культуре клеток MDCK был равен (4,25 ± 0,25) lg ТЦД50/см3 на уровне пятого пассажа.
В результате исследований, представленных в таблицах 2 и 3, были выявлены следующие наиболее чувствительные культуры клеток: перевиваемая культура клеток MDCK линий NBL-2 (так называемая родительская) [22] и NBL-9, а также первично трипсинизированная клеточная культура почки щенка. Однако использование первично трипсинизированной культуры для последующего культивирования вируса с целью изготовления биопрепаратов для диагностики и специфической профилактики нерационально, так как она является сезонной из-за использования доноров ткани. Субкультивирование первично трипсинизированных культур невозможно вследствие их низкой технологичности.
При формировании монослоя MDCK линии NBL-9 было отмечено неравномерное размещение клеток на поверхности флакона, что потенциально может отрицательно влиять на накопление вируса и способствовать ошибочной оценке наличия ЦПД при микроскопии (рис. 1). Титр инфекционной активности при культивировании в MDCK линии NBL-2 был незначительно выше. Таким образом, для дальнейшего подбора условий культивирования вируса была отобрана перевиваемая культура клеток MDCK линии NBL-2 (рис. 2).
Интактная культура клеток MDCK линии NBL-2 представлена на рисунке 3. Проявление ЦПД вируса через 96 и 120 ч отражено на рисунках 4 и 5 (увеличение 200× и 400×), где отчетливо просматриваются отдельные округлившиеся рефрактильные клетки, которые постепенно отслаиваются от стекла. В начале процесса морфологические изменения клеток имели очаговый характер, далее наблюдалась деструкция монослоя, приводящая к отделению клеток от поверхности культурального флакона. По мере размножения вируса число клеток, подвергшихся дегенерации, увеличивалось и в монослое образовывались пустоты. По краям сохранившихся участков монослоя концентрировались пораженные клетки, образуя большие конгломераты, напоминающие грозди винограда.
Для проведения дальнейших исследований необходимо было определить время культивирования, за которое накапливался CAV-2 в максимальных титрах. Результаты исследования представлены в таблице 4.
Установлено, что максимальное накопление вируса происходило на 5-е сутки культивирования (4,08 ± 0,29 lg ТЦД50/см3). При культивировании вируса в течение 48, 72 и 96 ч уровень репродукции вируса был в диапазоне от (1,25 ± 0,25) до (3,08 ± 0,29) lg ТЦД50/см3. Титр инфекционной активности снижался до значений (3,42 ± 0,14) и (3,08 ± 0,14) lg ТЦД50/см3 при культивировании в течение 144 и 168 ч соответственно. Снижение инфекционной активности вируса, вероятно, связано с замедлением процессов обмена веществ клеток с внешней средой при длительном культивировании.
Также предварительно было исследовано влияние температурного режима (39,0 ± 0,5) °С на жизнеспособность культуры клеток MDCK. При данной температуре были отмечены морфологические изменения в культуре клеток через 12 ч. Через 24 ч монослой отторгался от поверхности. Вследствие этого данный диапазон температур не применяли для культивирования вируса.
Из результатов, представленных в таблице 5, можно сделать вывод, что при температуре (35,0 ± 0,5) °С активность CAV-2 была ниже и максимальный титр вируса составил (2,83 ± 0,29) lg ТДЦ50/см3 после 144 ч культивирования. При температуре культивирования (37,0 ± 0,5) °С в культуре клеток MDCK линии NBL-2 активность вируса была максимальной (4,33 ± 0,14 lg ТДЦ50/см3) через 120 ч культивирования. Далее наблюдалось постепенное снижение титра инфекционной активности CAV-2.
На следующем этапе определяли оптимальный для заражения вирусом возраст клеточного монослоя. Для этого использовали монослой через 24, 48, 72, 96 ч после внесения клеток MDCK в культуральный флакон, а также культуру клеток, внесенную в культуральный флакон непосредственно перед инокуляцией вируссодержащего материала. Результаты учитывали через 120 ч (5 сут) инкубации в термостате при температуре (37,0 ± 0,5) °С.
Исходя из полученных данных (табл. 6), оптимальным сроком формирования монослоя культуры клеток для заражения является 48 ч, титр вируса составил (4,08 ± 0,38) lg ТЦД50/см3. При инокуляции CAV-2 в суспензию клеток до формирования монослоя титр вируса был равен (2,42 ± 0,14) lg ТЦД50/см3. Монослой при этом формировался медленнее, чем у интактной культуры клеток, и в большей степени проявлялась тенденция к формированию кластеров клеток. При культивировании в течение 72 и 96 ч, вероятно, снижались процессы обмена веществ клеток и репродукции вируса. Титр инфекционной активности при этом составил (3,83 ± 0,14) и (3,08 ± 0,29) lg ТЦД50/см3 соответственно.
С целью изучения влияния множественности заражения на уровень накопления CAV-2 в культуре клеток MDCK линии NBL-2 применяли следующие дозы инфицирования: 0,1; 0,01; 0,001; 0,0001 ТЦД50/кл. Инкубацию прекращали при разрушении 80% площади монослоя клеток и отделении их от поверхности. Полученные результаты приведены в таблице 7.
При дозе заражения 0,1 ТЦД50/кл ЦПД наблюдалось уже через 48 ч после внесения суспензии вируса в культуру клеток. Однако титр CAV-2 составил (3,08 ± 0,38) lg ТЦД50/см3 и был ниже, чем при дозе заражения 0,01 ТЦД50/кл (4,33 ± 0,29 lg ТЦД50/см3), что связано с быстрым разрушением монослоя и, как следствие, отсутствием возможности накопления вируса в максимальной концентрации. При множественности заражения 0,001 и 0,0001 ТЦД50/кл титр инфекционной активности вируса был низким и находился на уровне (2,17 ± 0,14) и (1,75 ± 0,25) lg ТЦД50/см3 соответственно; ЦПД в культуре клеток наблюдалось через 96 ч.
Фактор продолжительности предварительного контакта (адсорбции) вируса с монослоем культуры клеток MDCK также представляет интерес в связи с его влиянием на накопление вируса.
Установлено, что при культивировании без адсорбции титр инфекционной активности CAV-2 составил (2,16 ± 0,14) lg ТЦД50/см3. Предварительный контакт вируса с монослоем улучшает репродукцию CAV-2, что характеризуется повышением его инфекционного титра. Оптимальным для максимального накопления вируса временем был предварительный контакт в течение 60 мин: титр инфекционной активности составил (4,33 ± 0,29) lg ТЦД50/см3. При времени предварительной адсорбции 30 и 90 мин титр инфекционной активности находился на уровне (4,08 ± 0,38) и (4,08 ± 0,14) lg ТЦД50/см3 соответственно.
Таблица 1
Инфекционная активность CAV-2 в первично трипсинизированной культуре клеток почки щенка при вирусовыделении на уровне первого пассажа
Table 1
CAV-2 infectivity in primary trypsinized baby dog kidney cell culture when the virus was isolated at the first passage
|
Номер изолята |
Титр инфекционной активности, lg ТЦД50/см3 |
|
1 |
1,83 ± 0,14 |
|
2 |
1,67 ± 0,29 |
|
3 |
1,92 ± 0,38 |
|
4 |
2,42 ± 0,29 |
|
5 |
3,33 ± 0,29 |
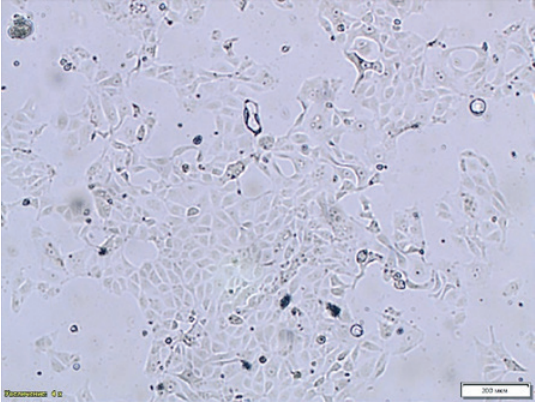
Рис. 1. Формирование монослоя через 24 ч, культура клеток MDCK линии NBL-9 (увеличение 200×)
Fig. 1. Monolayer formation – age: 24 hours, MDCK cell culture NBL-9 line (200× magnification)
Таблица 2
Последовательное культивирование CAV-2 в первично трипсинизированной культуре клеток почки щенка
Table 2
Serial CAV-2 cultivation in primary trypsinized baby dog kidney cell culture
|
Номер пассажа вируса |
Титр инфекционной активности, lg ТЦД50/см3 |
||||
|
изолят № 1 |
изолят № 2 |
изолят № 3 |
изолят № 4 |
изолят № 5 |
|
|
1 |
1,83 ± 0,14 |
1,67 ± 0,29 |
1,92 ± 0,38 |
2,42 ± 0,29 |
3,33 ± 0,29 |
|
2 |
0,83 ± 0,58 |
1,67 ± 0,29 |
2,25 ± 0,25 |
2,50 ± 0,43 |
4,17 ± 0,14 |
|
3 |
– |
1,17 ± 0,14 |
2,50 ± 0,25 |
2,17 ± 0,14 |
4,33 ± 0,29 |
|
4 |
– |
– |
2,58 ± 0,14 |
1,75 ± 0,25 |
4,08 ± 0,14 |
|
5 |
– |
– |
2,33 ± 0,29 |
– |
3,92 ± 0,14 |
|
«–» – исследование не проводилось (not tested). |
|||||
Таблица 3
Чувствительность различных перевиваемых и первично трипсинизированных культур клеток к изоляту «Юнити» CAV-2
Table 3
Susceptibility of different continuous and primary trypsinized cell cultures to CAV-2 Yunity isolate
|
Культура клеток |
Титр инфекционной активности, lg ТЦД50/см3 |
||||
|
1-й пассаж |
2-й пассаж |
3-й пассаж |
4-й пассаж |
5-й пассаж |
|
|
Перевиваемые культуры клеток |
|||||
|
MDCK NBL-2 |
4,33 ± 0,29 |
4,00 ± 0,25 |
4,08 ± 0,14 |
4,17 ± 0,14 |
4,25 ± 0,25 |
|
MDCK NBL-9 |
4,00 ± 0,25 |
3,92 ± 0,38 |
3,83 ± 0,29 |
4,00 ± 00 |
3,83 ± 0,14 |
|
Vero |
< 1,0* |
< 1,0 |
– |
– |
– |
|
Первично трипсинизированные культуры клеток |
|||||
|
СЩ |
2,42 ± 0,14 |
2,17 ± 0,29 |
1,50 ± 0,25 |
1,17 ± 0,29 |
0,92 ± 0,14 |
|
ПК |
< 1,0 |
< 1,0 |
– |
– |
– |
|
СК |
< 1,0 |
< 1,0 |
– |
– |
– |
|
* данные микротитрования (microtitration results); «–» – не исследовали (not tested); |
|||||
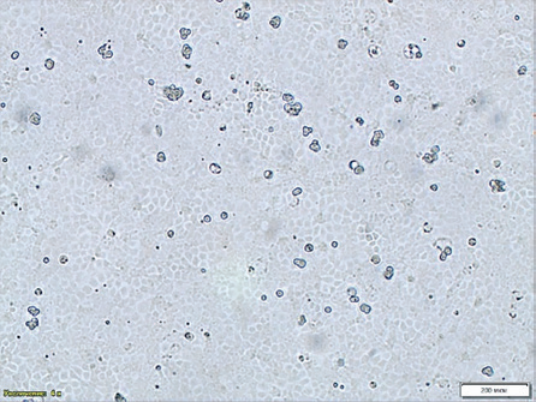
Рис. 2. Формирование монослоя через 24 ч, культура клеток MDCK линии NBL-2 (увеличение 200×)
Fig. 2. Monolayer formation – age: 24 hours, MDCK cell culture NBL-2 line (200× magnification)

Рис. 3. Интактная перевиваемая культура клеток MDCK линии NBL-2 (увеличение 200×)
Fig. 3. Intact continuous MDCK cell culture NBL-2 line (200× magnification)

Рис. 4. Проявление ЦПД CAV-2 через 96 ч после инфицирования перевиваемой культуры клеток MDCK линии NBL-2 (увеличение 200×)
Fig. 4. CAV-2 CPE manifestation 96 hours after infection of continuous MDCK cell culture NBL-2 line (200× magnification)
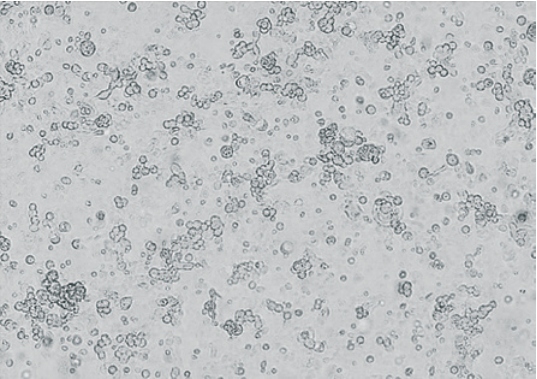
Рис. 5. Проявление ЦПД CAV-2 через 120 ч после инфицирования перевиваемой культуры клеток MDCK линии NBL-2 (увеличение 400×)
Fig. 5. CAV-2 CPE manifestation 120 hours after infection of continuous MDCK cell culture NBL-2 line (400× magnification)
Таблица 4
Накопление CAV-2 в зависимости от времени культивирования в перевиваемой культуре клеток MDCK линии NBL-2
Table 4
CAV-2 accumulation depending on the time of cultivation in continuous MDCK NBL-2 line cell culture
|
Время культивирования, ч |
Титр инфекционной активности, |
|
48 |
1,25 ± 0,25 |
|
72 |
2,92 ± 0,38 |
|
96 |
3,08 ± 0,29 |
|
120 |
4,08 ± 0,29 |
|
144 |
3,42 ± 0,14 |
|
168 |
3,08 ± 0,14 |
Таблица 5
Титр инфекционной активности CAV-2 в зависимости от температуры культивирования в перевиваемой культуре клеток MDCK линии NBL-2
Table 5
CAV-2 infectivity titre depending on temperature of cultivation in continuous MDCK NBL-2 line cell culture
|
Продолжительность культивирования |
Титр инфекционной активности, lg ТЦД50/см3 |
|
|
(35,0 ± 0,5) °С |
(37,0 ± 0,5) °С |
|
|
1 сут (24 ч) |
0 |
0 |
|
2 сут (48 ч) |
0,92 ± 0,14 |
1,17 ± 0,14 |
|
3 сут (72 ч) |
2,67 ± 0,14 |
3,33 ± 0,14 |
|
4 сут (96 ч) |
2,75 ± 0,25 |
3,58 ± 0,14 |
|
5 сут (120 ч) |
2,83 ± 0,14 |
4,33 ± 0,29 |
|
6 сут (144 ч) |
2,83 ± 0,29 |
3,58 ± 0,29 |
|
7 сут (168 ч) |
1,75 ± 0 |
2,17 ± 0,14 |
Таблица 6
Корреляция возраста монослоя культуры клеток MDCK линии NBL-2 с титром инфекционной активности CAV-2
Table 6
Correlation of MDCK NBL-2 line cell culture monolayer age with CAV-2 infectivity titre
|
Срок формирования монослоя, ч |
Титр инфекционной активности, lg ТЦД50/см3 |
|
0 |
2,42 ± 0,14 |
|
24 |
3,17 ± 0,14 |
|
48 |
4,08 ± 0,38 |
|
72 |
3,83 ± 0,14 |
|
96 |
3,08 ± 0,29 |
Таблица 7
Титр инфекционной активности CAV-2 в зависимости от заражающей дозы в культуре клеток MDCK линии NBL-2
Table 7
CAV-2 infectivity titre depending on infectious dose in MDCK NBL-2 line cell culture
|
MOI, ТЦД50/кл |
Время культивирования, ч |
Титр инфекционной активности, lg ТЦД50/см3 |
|
0,1 |
48 |
3,08 ± 0,38 |
|
0,01 |
72 |
4,33 ± 0,29 |
|
0,001 |
96 |
2,17 ± 0,14 |
|
0,0001 |
96 |
1,75 ± 0,25 |
|
MOI – множественность заражения (multiplicity of infection). |
||
ЗАКЛЮЧЕНИЕ
В результате проведенной работы был выделен аденовирус собак 2-го типа, обладающий стабильностью на протяжении пяти пассажей и высоким титром инфекционной активности.
Были изучены параметры культивирования изолята CAV-2 в перевиваемых и первично трипсинизированных культурах клеток. В результате исследований отобрана наиболее чувствительная клеточная культура MDCK линии NBL-2, позволяющая получить вируссодержащий материал с высоким титром (4,33 ± 0,29 lg ТЦД50/см3). Установлено, что условиями, способствующими накоплению CAV-2 в максимальных титрах, являются: использование для заражения монослоя культуры клеток, сформированного в течение 48 ч; множественность заражения 0,01 ТЦД50/кл; время предварительной адсорбции 60 мин; культивирование при температуре (37,0 ± 0,5) °С в течение 120 ч.
Полученные результаты исследований могут быть использованы при разработке диагностических тест-систем, вакцинных препаратов для профилактики аденовирусной инфекции собак, вызванной вирусом 2-го серотипа.
Список литературы
1. Савина Н. Н., Екимов А. А., Трухин В. П., Евтушенко А. Э., Жиренкина Е. Н., Синегубова Е. О., Слита А. В. Оценка методов инактивирования аденовируса птиц при производстве гриппозных вакцин. Медицина экстремальных ситуаций. 2021; (3): 84–89. https://doi.org/10.47183/mes.2021.032
2. Chander V., Sharma G. K., Bhatt M., Nandi S., Mahajan S., Singh M., et al. Isolation and genetic characterization of canine adenovirus type 2 from a domestic dog showing neurological symptoms. Brazilian Journal of Microbiology. 2021; 52 (4): 2521–2528. https://doi.org/10.1007%2Fs42770-021-00540-0
3. Ford R. B., Vaden S. L. Canine infectious tracheobronchitis. In: Infectious Diseases of the Dog and Cat. Ed. by C. E. Greene. 2nd ed. Philadelphia: W. B. Saunders Company; 1998; 33–38.
4. ICTV. Taxon Details. https://ictv.global/taxonomy/taxondetails?taxnode_id=202302418&taxon_name=Mastadenovirus%20canidae
5. Ditchfi d J., Macpherson L. W., Zbitnew A. Association of canine adenovirus (Toronto A 26/61) with an outbreak of laryngotracheitis (“Kennel Cough”): A preliminary report. Canadian Veterinary Journal. 1962; 3 (8): 238–247. https://pubmed.ncbi.nlm.nih.gov/17421510
6. Баррет Т., Берд П., Клегг Дж., Гулд Э., Халл Р., Инглис С. и др. Вирусология. Методы. Под. ред. Б. Мейхи. М.: Мир; 1988. 344 с.
7. Диагностика и профилактика инфекционных болезней собак и кошек: руководство для практикующих ветеринарных врачей. Под ред. Т. И. Алипера. М.: ЗооВетКнига; 2017. 304 с.
8. Macartney L., Cavanagh H. M. A., Spibey N. Isolation of canine adenovirus-2 from the faeces of dogs with enteric disease and its unambiguous typing by restriction endonuclease mapping. Research in Veterinary Science. 1988; 44 (1): 9–14. https://doi.org/10.1016/0034-5288(88)90004-5
9. Ramidi A., Ganji V. K., Buddala B., Yella N. R., Manthani G. P., Putty K. E3 gene-based genetic characterization of canine adenovirus-2 isolated from cases of canine gastroenteritis in India revealed a novel group of the virus. Intervirology. 2020; 62 (5–6): 216–221. https://doi.org/10.1159/000507329
10. Buonavoglia C., Martella V. Canine respiratory viruses. Veterinary Research. 2007; 38 (2): 355–373. https://doi.org/10.1051/vetres:2006058
11. Zhu Y., Xu J., Lian S., Zhang R., Hou J., Wang M., Yan X. Difference analysis between canine adenovirus types 1 and 2. Frontiers in Cellular and Infection Microbiology. 2022; 12:854876. https://doi.org/10.3389/fcimb.2022.854876
12. Day M. J., Carey S., Clercx C., Kohn B., MarsilIo F., Thiry E., et al. Aetiology of canine infectiousrespiratory disease complex and prevalence of its pathogensin Europe. Journal of Comparative Pathology. 2020; 176: 86–108. https://doi.org/10.1016/j.jcpa.2020.02.005
13. Dowgier G., Lahoreau J., Lanave G., Losurdo M., Varello K., Lucente M. S., et al. Sequential circulation of canine adenoviruses 1 and 2 in captive wild carnivores, France. Veterinary Microbiology. 2018; 221: 67–73. https://doi.org/10.1016/j.vetmic.2018.05.025
14. Timurkan M. O., Aydin H., Alkan F. Detection and molecular characterization of canine adenovirus type 2 (CAV-2) in dogs with respiratory tract symptoms in shelters in Turkey. Veterinarski Arhiv. 2018; 88 (4): 467–479. https://doi.org/10.24099/vet.arhiv.0052
15. Koptopoulos G., Cornwell H. J. C. Canine adenoviruses: a review. Veterinary Bulletin. 1981; 51 (3): 135–142. https://www.cabidigitallibrary.org/doi/pdf/10.5555/19812282132
16. Vieson M. D., Piñeyro P., LeRoith T. A review of the pathology and treatment of canine respiratory infections. Veterinary Medicine: Research and Reports. 2012; 3: 25–39. https://doi.org/10.2147/vmrr.s25021
17. O’Neill D., Jackson C., Guy J., Church D., McGreevy P., Thomson P., Brodbelt D. Epidemiology of canine upper respiratory disorders in brachycephalic and non-brachycephalic breeds attending veterinary practices in England. BSAVA Congress Proceedings (9–12 April, 2015). Birmingham: British Small Animal Veterinary Association; 2015; 481–482. https://doi.org/10.22233/9781910443521.65.4
18. Balboni A., Mollace C., Giunti M., Dondi F., Prosperi S., Battilani M. Investigation of the presence of canine adenovirus (CAdV) in owned dogs in Northern Italy. Research in Veterinary Science. 2014; 97 (3): 631–636. https://doi.org/10.1016/j.rvsc.2014.10.010
19. Priestnall S. L., Mitchell J. A., Walker C. A., Erles K., Brownlie J. New and emerging pathogens in canine infectious respiratory disease. Veterinary Pathology. 2014; 51 (2): 492–504. https://doi.org/10.1177/0300985813511130
20. Gaush C. R., Hard W. L., Smith T. F. Characterization of an established line of canine kidney cells (MDCK). Proceedings of the Society for Experimental Biology and Medicine. 1966; 122 (3): 931–935. https://doi.org/10.3181/00379727-122-31293
21. American Type Culture Collection. https://www.atcc.org
22. Valentich J. D. Morphological similarities between the dog kidney cell line MDCK and the mammalian cortical collecting tubule. Annals of the New York Academy of Sciences. 1981; 372 (1): 384–405. https://doi.org/10.1111/j.1749-6632.1981.tb15490.x
23. Климова А. А., Комарова А. А., Киселев А. М., Галкина Т. С. Методические рекомендации по титрованию вируса аденовироза собак микрометодом: утв. ФГБУ «ВНИИЗЖ» 14.06.2022 № 35–22. Владимир; 2022. 11 с.
24. Глинская Е. В., Тучина Е. С., Петров С. В. Вирусология. Методические материалы: учебно-методическое пособие. Саратов; 2013. 84 с.
Об авторе
А. А. КлимоваРоссия
Климова Анастасия Антоновна, ветеринарный врач лаборатории профилактики болезней мелких домашних животных
мкр. Юрьевец, г. Владимир, 600901
Рецензия
Для цитирования:
Климова А.А. Выделение аденовируса собак 2-го серотипа и определение параметров культивирования. Ветеринария сегодня. 2024;13(4):352-359. https://doi.org/10.29326/2304-196X-2024-13-4-352-359
For citation:
Klimova A.A. Canine adenovirus serotype 2 isolation and determination of its cultivation parameters. Veterinary Science Today. 2024;13(4):352-359. https://doi.org/10.29326/2304-196X-2024-13-4-352-359



































