Перейти к:
Характеристика микробиоты кишечного тракта у телят с различными формами острой катаральной бронхопневмонии
https://doi.org/10.29326/2304-196X-2024-13-3-275-281
Аннотация
Кишечный барьер является одним из важнейших компонентов, поддерживающих гомеостаз в желудочно-кишечном тракте, поэтому изменения бактериального состава могут привести к повышенной проницаемости кишечника и кишечной транслокации условно-патогенных микроорганизмов с последующим развитием либо осложнением различных инфекционных заболеваний. Проведена сравнительная характеристика микробиоты кишечного тракта телят с компенсированной, субкомпенсированной и декомпенсированной острой катаральной бронхопневмонией в условиях животноводческих ферм Владимирской и Московской областей. Объектом исследования служили телята в возрасте 1–3 мес., больные острой катаральной бронхопневмонией (n = 37). Оценку степени тяжести заболевания осуществляли на основании проведенных клинико-лабораторных исследований. Контролем служил материал, отобранный от клинически здоровых животных (n = 8). Показано, что у телят при компенсированной острой катаральной бронхопневмонии качественный и количественный состав кишечного микробиома не отличается от клинически здоровых животных. При клинической манифестации субкомпенсированной и декомпенсированной острой катаральной бронхопневмонии у телят в кишечнике происходит существенный количественный и качественный сдвиг микробиома, что свидетельствует о возникновении дисбактериоза. Считаем, что данное направление достаточно актуально и требует дальнейших скрупулезных исследований.
Ключевые слова
Для цитирования:
Родионова Н.Ю., Куликов Е.В., Сотникова Е.Д., Прозоровский И.Е., Ватников Ю.А., Руденко В.Б., Руденко П.А. Характеристика микробиоты кишечного тракта у телят с различными формами острой катаральной бронхопневмонии. Ветеринария сегодня. 2024;13(3):275-281. https://doi.org/10.29326/2304-196X-2024-13-3-275-281
For citation:
Rodionova N.Yu., Kulikov E.V., Sotnikova E.D., Prozorovskiy I.E., Vatnikov Yu.A., Rudenko V.B., Rudenko P.A. Characteristics of the intestinal tract microbiota in calves with various forms of acute catarrhal bronchopneumonia. Veterinary Science Today. 2024;13(3):275-281. https://doi.org/10.29326/2304-196X-2024-13-3-275-281
ВВЕДЕНИЕ
В последнее время в связи с интенсификацией молочного животноводства наблюдается увеличение концентрации крупного рогатого скота на животноводческих комплексах. Это, в свою очередь, создает неблагоприятные условия, способствующие снижению устойчивости животных к различным вредным воздействиям окружающей среды, в том числе к негативному влиянию ассоциаций условно-патогенной микрофлоры, циркулирующей в фермерских биогеоценозах [1-3]. Факторные инфекции у крупного рогатого скота встречаются достаточно часто и наносят значительный экономический ущерб животноводству. К числу наиболее частых факторных инфекций относятся акушерско-гинекологические заболевания коров, а также пневмоэнтериты телят. Для предотвращения данных инфекций крупного рогатого скота необходимо соблюдать профилактические меры, включающие регулярную вакцинацию, поддержание гигиены в стойлах животных, контроль за кормлением и поением, а также регулярный осмотр и лечение больных животных [4-6].
В настоящее время в животноводческих хозяйствах среди высокопродуктивных животных широко распространены респираторные заболевания, которые чаще всего диагностируются у молодняка. При этом экономические потери для отрасли складываются из падежа животных, потери продуктивности у больных или выздоровевших особей, замедления их роста и развития, затрат на лечение и профилактику [7]. Бронхопневмония телят регистрируется практически во всех зонах нашей страны и среди всех патологий в хозяйствах занимает второе место после желудочно-кишечных заболеваний, достигая 20–30% [8]. Этиологическими факторами неспецифической бронхопневмонии телят является комплекс причин: скученность содержания, снижение резистентности и иммунологической реактивности организма новорожденных животных, воздействие неблагоприятных факторов внешней среды, стресс, несбалансированное кормление, а также условно-патогенная микробиота дыхательных путей, которая в указанных условиях может приобрести патогенные свойства [9-11].
Триллионы микроорганизмов, обитающих в кишечном тракте, являются важными регуляторами здоровья, поэтому качественные и количественные нарушения в микробных биотопах кишечника могут вызывать либо осложнять различные заболевания инфекционного характера [12-15]. Синдром «дырявой кишки» – это заболевание, характеризующееся повышенной проницаемостью кишечника. Поскольку кишечный барьер является одним из важнейших компонентов, поддерживающих гомеостаз в желудочно-кишечном тракте, потеря его целостности из-за изменений бактериального состава, снижения уровней экспрессии белков плотных соединений и повышенной концентрации провоспалительных цитокинов может привести к увеличению проницаемости кишечника с последующим развитием желудочно-кишечных и иных заболеваний. Транслокация микроорганизмов и их токсичных метаболитов за пределы биотопа – желудочно-кишечного тракта – является одним из последствий синдрома «дырявой кишки» [16-18].
Транслокация кишечной микробиоты является процессом, при котором микроорганизмы из кишечного тракта проникают через его стенку в кровоток и распространяются по организму. Это может играть значительную роль при развитии инфекционных заболеваний различной этиологии, в том числе и респираторного характера. Так, патогенные микроорганизмы, попадая в кровоток посредством кишечной транслокации, могут вызвать системный воспалительный ответ организма, что ухудшает течение инфекции. Также бактерии, проникая через стенку кишечника, могут стать причиной развития метастатических инфекций различных органов и тканей, что может привести к осложнению уже имеющегося заболевания и более тяжелому течению болезни. Кроме этого, кишечная транслокация микроорганизмов может способствовать формированию бактериемии, что может привести к развитию сепсиса и шокового состояния. Проникновение инфекционных агентов из кишечного тракта в кровоток может также стать причиной рецидивов инфекции после завершения антибиотикотерапии [19-22].
В целом кишечная транслокация микроорганизмов играет важную роль в развитии и течении различных инфекционных заболеваний, поэтому контроль этого процесса может быть ключевым аспектом в лечении таких состояний. В этой связи изучение роли кишечной транслокации микроорганизмов при острой катаральной бронхопневмонии различной степени тяжести является актуальным вопросом, требующим своевременного и грамотного решения.
Новизна работы состоит в том, что впервые исследовано состояние биотопа прямой кишки у телят с острой катаральной бронхопневмонией различной степени тяжести. Показано, что в зависимости от тяжести инфекционного процесса возникают существенные качественные и количественные сдвиги, характеризующиеся развитием дисбактериоза кишечника.
Цель работы – провести сравнительную характеристику микробиоты кишечного тракта телят с компенсированной, субкомпенсированной и декомпенсированной острой катаральной бронхопневмонией в условиях животноводческих ферм Владимирской и Московской областей.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено за счет гранта Российского научного фонда (проект № 24-26-00091, https://rscf.ru/project/24-26-00091) на базе животноводческих ферм Владимирской и Московской областей с общим поголовьем 3680 гол., в том числе 1690 коров. Бактериологические исследования проводили на базе ветеринарной лаборатории ООО «ВЕТТЕСТ» (г. Москва).
Объектом исследования служили телята в возрасте 1–3 мес., больные острой катаральной бронхопневмонией (n = 37). Диагноз ставили комплексно с учетом данных анамнеза, клинического осмотра, а также микробиологических исследований. Животные, которых лечили в течение 14 дней до отбора проб, были исключены из исследования. Оценку степени тяжести острой катаральной бронхопневмонии телят (1-я степень – компенсированная; 2-я степень – субкомпенсированная; 3-я степень – декомпенсированная) осуществляли на основании проведенных клинико-лабораторных исследований. В зависимости от степени тяжести бронхопневмонии животные были разделены на три группы: телята с легкой (компенсированной, n = 12), средней (субкомпенсированной, n = 14) и тяжелой (декомпенсированной, n = 11) степенью тяжести заболевания. Контролем служил материал, отобранный от клинически здоровых животных (n = 8).
От опытных телят в утренние часы отбирали пробы фекалий в стерильные пробирки. При проведении микробиологических исследований из полученного биологического материала с помощью пипетки Пастера производили посевы на питательные среды. Для дрожжеподобных грибов использовали глюкозный агар Сабуро; для стафилококков – пептонно-солевую среду, желточно-солевой агар и мясо-пептонный агар (МПА); для энтеробактерий – агар Эндо, среду Плоскирева, среду Кинга и висмут-сульфит агар; для бифидобактерий – среду Блаурокка; для лактобактерий – обезжиренное молоко и агар MRS. Посевы снова инкубировали в термостате при 37–38 °C в течение 24 ч, а при отсутствии роста чашки выдерживали до 3 дней. После изучения культурально-морфологических свойств из всех отдельных типовых колоний делали пересевы в пробирки и инкубировали при 37–38 °С в течение 24 ч. Полученные таким образом чистые культуры бактерий проверяли на подвижность в препаратах раздавленной капли с помощью фазово-контрастной микроскопии в затемненном поле зрения и подвергали идентификации.
Для количественного бактериологического исследования в стерильные пробирки со стерильным физиологическим раствором хлорида натрия в объеме 9,0 см3 отбирали 1,0 г фекалий. Из содержимого первой пробирки, которое считалось за разведение 10-1, готовили дальнейшие десятикратные разведения до 10-10. Затем из каждой пробирки проводили посевы 0,1 см3 полученной смеси в чашки Петри на поверхность твердых питательных сред (Эндо, МПА, Сабуро, Блаурокка, MRS, ПСЛ, Кинга, Ресселя, висмут-сульфит агар, желточно-солевой агар).
Количество микроорганизмов (С) в 1,0 см3 фекалий, отобранных от телят с острой катаральной бронхопневмонией, рассчитывали по приведенной ниже формуле и выражали в логарифмах с основанием 10:
C = (N/V) × K,
где N – среднее количество колоний в одной бактериологической чашке; V – объем суспензии, который наносят во время посева на агар (см3); К – кратность разведения.
Морфологию бактерий изучали в мазках, окрашенных по Граму и Романовскому – Гимзе. Дальнейшую идентификацию по биохимическим свойствам осуществляли в соответствии с «Определителем бактерий Берджи»2.
Полученные результаты исследований обрабатывали статистически и представляли в виде таблиц. Все расчеты проводили с помощью программы STATISTICA 7.0. (StatSoft, США), при этом предварительно оценивали нормальность распределения с помощью тестов Шапиро – Уилка. В случае нормального распределения количественных переменных для сравнения двух групп применяли t-тест Стьюдента для независимых выборок. Рассчитывали среднее арифметическое (Mean), среднеквадратическую ошибку (SE) и стандартное отклонение (SD). Достоверность разницы аналитов между показателями контрольной и опытными группами рассчитывали по методу Манна – Уитни3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении эпизоотологического обследования выявлено 37 телят в возрасте от 1 до 3 мес. с острой катаральной бронхопневмонией. Клинические исследования позволили разделить животных на три группы по степени тяжести болезни: 12 телят отнести к легкой, компенсированной форме (незначительное угнетение, субфебрильная температура тела, поверхностное жесткое дыхание, серозные истечения из носа), 14 – к средней, субкомпенсированной (угнетение, повышение температуры, учащение пульса и дыхания, сухие хрипы и кашель, обильные серозно-катаральные истечения), а 11 – к тяжелой, декомпенсированной (выраженное угнетение и истощение, отсутствие аппетита, снижение реакции на внешние раздражители, повышение температуры, учащение пульса и дыхания, болезненный сухой кашель, хрипы, очаги притупления перкуторного звука, обильный серозно-катаральный экссудат зеленоватого цвета).
Проведение микробиологических исследований проб бронхоальвеолярного лаважа, отобранных от больных животных, показало, что возникновение бронхопневмонии у телят обусловлено достаточно широким спектром условно-патогенной микрофлоры. Так, из образцов исследуемого содержимого бронхов было изолировано 115 бактерий тринадцати видов, отнесенных к девяти родам. При этом чаще из проб бронхоальвеолярного лаважа выделяли Staphylococcus аureus – 18 (15,6%) культур, Mannheimia haemolytica – 18 (15,6%) штаммов, Escherichia сoli – 15 (13,1%) изолятов, Pasteurella multocida – 11 (9,6%) культур и Klebsiella pneumonia – 11 (9,6%) штаммов. Значительно реже изолировали культуры Staphylococcus intermedius и Proteus mirabilis – по 3 (2,6%) случая соответственно.
Количество микроорганизмов (lg) в 1 г фекалий телят при компенсированной, субкомпенсированной и декомпенсированной острой катаральной бронхопневмонии представлены в таблице.
Анализ полученных результатов показал, что у телят при компенсированной острой катаральной бронхопневмонии качественный и количественный состав кишечного микробиома не отличается от клинически здоровых животных.
Представленные данные демонстрируют, что в кишечном биотопе животных с клинической манифестацией средней степени тяжести острой катаральной бронхопневмонии происходят существенные количественные и качественные сдвиги, которые свидетельствуют о развитии дисбактериоза. При субкомпенсированной бронхопневмонии в пробах фекалий телят регистрировали достоверное увеличение Enterobacter spp. – в 1,26 раза (р < 0,05), Citrobacter spp. – в 1,35 раза (р < 0,05), Klebsiella spp. – в 1,90 раза (р < 0,01), Proteus spp. – в 1,66 раза (р < 0,01), Pseudomonas spp. – в 2,58 раза (р < 0,001), Clostridium spp. – в 2,06 раза (р < 0,001) и Candida spp. – в 2,12 раза (р < 0,01) при сравнении с показателями животных группы контроля. Это наблюдали на фоне высокодостоверного (р < 0,001) снижения представителей родов Lactobacillus и Bifidobacterium с (10,42 ± 0,72) до (8,59 ± 0,76) lg и с (10,94 ± 0,73) до (9,06 ± 0,62) lg, на 17,56 и 17,18% соответственно при сравнении с показателями клинически здоровых телят.
Результаты, приведенные в таблице, также указывают на то, что у телят при наиболее тяжелой, декомпенсированной, степени острой катаральной бронхопневмонии наблюдали значительные количественные и качественные дисбиотические сдвиги микробиоты кишечного тракта. Так, у больных животных при исследовании проб фекалий регистрировали достоверное увеличение представителей родов Escherichia – в 1,21 раза (р < 0,001), Enterobacter – в 1,63 раза (р < 0,001), Citrobacter – в 1,83 раза (р < 0,001), Klebsiella – в 3,08 раза (р < 0,001), Proteus – в 1,90 раза (р < 0,001), Pseudomonas – в 3,57 раза (р < 0,001), Staphylococcus – в 1,24 раза (р < 0,05), Streptococcus – в 1,38 раза (р < 0,01), Bacillus – в 1,47 раза (р < 0,01), Clostridium – в 3,34 раза (р < 0,001) и дрожжевых грибов из рода Candida – в 2,82 раза (р < 0,001) при сравнении с показателями животных контрольной группы. Представленные количественные различия регистрировали на фоне высокодостоверного снижения в пробах фекалий опытных животных Lactobacillus spp. (р < 0,001) и Bifidobacterium spp. (р < 0,001) с (10,42 ± 0,72) до (6,51 ± 1,08) lg и с (10,94 ± 0,73) до (7,36 ± 0,81) lg, на 37,5 и 32,7% соответственно в сравнении с группой контроля. Приведенные данные получены нами впервые.
Качественная характеристика микрофлоры кишечника телят при острой катаральной бронхопневмонии компенсированной, субкомпенсированной и декомпенсированной степени тяжести приведена на рисунке.
Таблица
Состав и количество (lg) условно-патогенной микрофлоры в 1 г фекалий телят при различных формах острой катаральной бронхопневмонии (М ± m)
Table
Composition and quantity (lg) of opportunistic microflora in 1 g of calf feces in various forms of acute catarrhal bronchopneumonia (М ± m)
Род микроорганизмов | Контроль (n = 8) | Легкая степень (n = 12) | Средняя степень (n = 14) | Тяжелая степень (n = 11) |
Escherichia | 7,07 ± 0,96 | 7,40 ± 0,77 | 7,69 ± 0,79 | 8,55 ± 0,61*** |
Enterobacter | 2,65 ± 0,70 | 2,72 ± 0,77 | 3,35 ± 0,50* | 4,31 ± 0,82*** |
Citrobacter | 2,26 ± 0,75 | 2,34 ± 0,78 | 3,05 ± 0,84* | 4,14 ± 0,70*** |
Klebsiella | 0 | 0 | 1,90 ± 1,43** | 3,08 ± 1,02*** |
Proteus | 1,79 ± 0,51 | 2,01 ± 0,69 | 2,97 ± 0,85** | 3,40 ± 0,76*** |
Pseudomonas | 0 | 0 | 2,58 ± 0,72*** | 3,57 ± 0,78*** |
Staphylococcus | 3,61 ± 0,78 | 3,50 ± 0,71 | 3,93 ± 0,75 | 4,47 ± 0,76* |
Streptococcus | 3,59 ± 0,75 | 3,26 ± 0,91 | 4,17 ± 0,65 | 4,95 ± 0,78** |
Bacillus | 2,74 ± 0,89 | 2,65 ± 0,85 | 3,13 ± 0,49 | 4,02 ± 0,97** |
Clostridium | 0 | 0 | 2,06 ± 1,13*** | 3,34 ± 0,67*** |
Lactobacillus | 10,42 ± 0,72 | 10,27 ± 0,67 | 8,59 ± 0,76*** | 6,51 ± 1,08*** |
Bifidobacterium | 10,94 ± 0,73 | 10,72 ± 0,84 | 9,06 ± 0,62*** | 7,36 ± 0,81*** |
Candida | 1,29 ± 1,48 | 1,28 ± 1,27 | 2,74 ± 0,77** | 3,64 ± 0,88*** |
* р < 0,05; ** р < 0,01; *** р < 0,001 в сравнении с группой контроля (as compared with the control group). | ||||
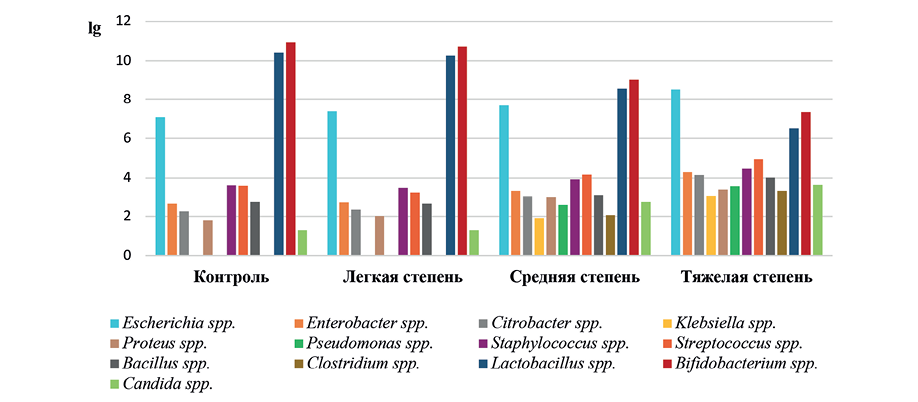
Рис. Качественные изменения кишечной микрофлоры у телят при острой катаральной бронхопневмонии различной степени тяжести
Fig. Qualitative changes in the intestinal microflora in calves with acute catarrhal bronchopneumonia of varying severity
Как видим, при наиболее легком, компенсированном, течении болезни не выявляли представителей родов Klebsiella, Pseudomonas и Clostridium, которые были изолированы при более тяжелом течении заболевания – субкомпенсированной и декомпенсированной степеней тяжести. Стоит предположить, что тяжесть бронхопневмонии может быть связана с развитием дисбактериоза кишечника и возникновением феномена кишечной транслокации микроорганизмов из природного, эволюционно сложившегося биотопа в очаг деструкции – легкие. Поэтому в дальнейших исследованиях необходимо определить идентичность микрофлоры кишечного тракта с изолированными из легочной ткани микроорганизмами при бронхопневмонии.
Таким образом, предложены новые критерии оценки тяжести острой катаральной бронхопневмонии у телят. Так, при клинической манифестации субкомпенсированной и декомпенсированной острой катаральной бронхопневмонии у телят в кишечнике происходят существенные количественные и качественные нарушения микробиома, что свидетельствует о возникновении дисбактериоза. Развитие дисбактериоза кишечника, предположительно, может служить своеобразным триггером формирования и прогрессирования патологий респираторного тракта. Полученные данные совпадают с рядом исследований состояния микробиома кишечника при воспалительных процессах различной локализации [20][23]. Это подтверждает важную роль кишечной микробиоты и проницаемости кишечника (нормальной и повышенной) при манифестации многих инфекционных болезней. Однако доступные на настоящий момент данные выборочны и недостаточны, их оценка является предметом дискуссий, а клиническое значение требует дополнительного изучения. В этой связи считаем, что изучение состояния микрофлоры кишечника у животных при воспалительных и инфекционных процессах требует дальнейших скрупулезных исследований.
ЗАКЛЮЧЕНИЕ
Дана детальная характеристика микробиоты кишечного тракта у телят с острой катаральной бронхопневмонией при различной степени тяжести инфекционного процесса. Показано, что у телят при компенсированной острой катаральной бронхопневмонии качественный и количественный состав кишечного микробиома не отличается от клинически здоровых животных. Установлено, что при субкомпенсированной острой катаральной бронхопневмонии в кишечном биотопе животных происходят существенные количественные и качественные сдвиги, которые свидетельствуют о развитии дисбактериоза. Так, в пробах фекалий регистрировали достоверное увеличение представителей родов Enterobacter, Citrobacter, Klebsiella, Proteus, Pseudomonas, Clostridium и Candida на фоне высокодостоверного снижения представителей родов Lactobacillus и Bifidobacterium на 17,56 и 17,18% соответственно при сравнении с показателями клинически здоровых телят. У телят с острой катаральной бронхопневмонией при наиболее тяжелой, декомпенсированной, степени течения наблюдали еще более значительные количественные и качественные дисбиотические сдвиги микробиоты кишечного тракта. Так, в пробах фекалий от больных животных при сравнении с показателями животных контрольной группы регистрировали достоверное увеличение представителей родов Escherichia, Enterobacter, Citrobacter, Klebsiella, Proteus, Pseudomonas, Staphylococcus, Streptococcus, Bacillus, Clostridium и дрожжевых грибов из рода Candida. Это выявляли на фоне высокодостоверного снижения в пробах фекалий опытных животных представителей родов Lactobacillus и Bifidobacterium на 37,5 и 32,7% соответственно в сравнении с контролем. Следует отметить, что при субкомпенсированной и декомпенсированной острой катаральной бронхопневмонии в пробах фекалий телят, в отличие от здоровых животных и животных с легкой степенью патологии, обнаружены представители родов Klebsiella, Pseudomonas и Clostridium.
1.
2. Хоулт Дж., Криг Н., Снит П., Стейли Дж., Уилльямс С. Определитель бактерий Берджи. В 2 т. М.: Мир; 1997. 800 с.
3. Реброва О. Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиа Сфера; 2002. 312 с.
Список литературы
1. Wang Y., Zhang P., Wu J., Chen S., Jin Y., Long J., et al. Transmission of livestock-associated methicillin-resistant Staphylococcus aureus between animals, environment, and humansin the farm. Environmental Science and Pollution Research. 2023; 30 (37): 86521–86539. https://doi.org/10.1007/s11356-023-28532-7
2. Van Boeckel T. P., Brower C., Gilbert M., Grenfell B. T., Levin S. A., Robinson T. P., et al. Global trends in antimicrobial use in food animals. Proceedings of the National Academy of Sciences. 2015; 112 (18): 5649–5654. https://doi.org/10.1073/pnas.1503141112
3. Alarcon P., Strang C. L., Chang Y. M., Tak M. Economic evaluation of antimicrobial usage surveillance in livestock. Scientific & Technical Review. 2023; 42: 42–51. https://doi.org/10.20506/rst.42.3347
4. Rudenko A., Glamazdin I., Lutsay V., Sysoeva N., Tresnitskiy S., Rudenko P. Parasitocenoses in cattle and their circulation in small farms. E3S Web of Conferences. 2022; 363:03029. https://doi.org/10.1051/e3sconf/202236303029
5. Peng Z., Hu Z., Li Z., Zhang X., Jia C., Li T., et al. Antimicrobial resistance and population genomics of multidrug-resistant Escherichia coli in pig farms in mainland China. Nature Communications. 2022; 13:1116. https://doi.org/10.1038/s41467-022-28750-6
6. Patterson L., Navarro-Gonzalez N., Jay-Russell M. T., Aminabadi P., Pires A. F. A. Risk factors of Shiga toxin-producing Escherichia coli in livestock raised on diversified small-scale farmsin California. Epidemiology and Infection. 2022; 150:e125. https://doi.org/10.1017/S0950268822001005
7. Buczinski S., Pardon B. Bovine respiratory disease diagnosis: What progress has been made in clinical diagnosis? Veterinary Clinics of North America: Food Animal Practice. 2020; 36 (2): 399–423. https://doi.org/10.1016/j.cvfa.2020.03.004
8. Сергеева Н. Н., Дедкова А. И. Эффективность различных схем лечения бронхопневмонии телят. Вестник аграрной науки. 2021; (5): 64–68. https://doi.org/10.17238/issn2587-666X.2021.5.64
9. Горпинченко Е. А., Лифенцова М. Н., Заико К. С., Ратников А. Р. Фармакопрофилактика неспецифической бронхопневмонии телят с использованием аэрозолей. Ветеринарная патология. 2021; (3): 24–33. https://doi.org/10.25690/VETPAT.2021.80.88.001
10. Kalaeva E., Kalaev V., Chernitskiy A., Alhamed M., Safonov V. Incidence risk of bronchopneumonia in newborn calves associated with intrauterine diselementosis. Veterinary World. 2020; 13 (5): 987–995. https://doi.org/10.14202/vetworld.2020.987-995
11. Kuchmenko T., Shuba A., Umarkhanov R., Chernitskiy A. Portable electronic nose for analyzing the smell of nasalsecretionsin calves: Toward noninvasive diagnosis of infectious bronchopneumonia. Veterinary Sciences. 2021; 8 (5):74. https://doi.org/10.3390/vetsci8050074
12. Руденко П. А. Современные подходы к борьбе с гнойно-воспалительными процессами у мелких домашних животных. Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2016; (3): 26–29. https://elibrary.ru/waifrh
13. Hsu C. L., Schnabl B. The gut-liver axis and gut microbiota in health and liver disease. Nature Reviews Microbiology. 2023; 21 (11): 719–733. https://doi.org/10.1038/s41579-023-00904-3
14. Zhang K., Wang N., Lu L., Ma X. Fermentation and metabolism of dietary protein by intestinal microorganisms. Current Protein & Peptide Science. 2020; 21 (8): 807–811. https://doi.org/10.2174/1389203721666200212095902
15. Andrade M. E. R., Araújo R. S., de Barros P. A. V., Soares A. D. N., Abrantes F. A., de Vasconcelos Generoso S. V., et al. The role of immunomodulators on intestinal barrier homeostasis in experimental models. Clinical Nutrition. 2015; 34 (6): 1080–1087. https://doi.org/10.1016/j.clnu.2015.01.012
16. Twardowska A., Makaro A., Binienda A., Fichna J., Salaga M. Preventing bacterial translocation in patients with leaky gut syndrome: nutrition and pharmacological treatment options. InternationalJournal of Molecular Sciences. 2022; 23 (6):3204. https://doi.org/10.3390/ijms23063204
17. Bischoff S. C., Barbara G., Buurman W., Ockhuizen T., Schulzke J.-D., Serino M., et al. Intestinal permeability – a new targetfor disease prevention and therapy. BMC Gastroenterology. 2014; 14:189. https://doi.org/10.1186/ s12876-014-0189-7
18. Stanley D., Mason L. J., Mackin K. E., Srikhanta Y. N., Lyras D., Prakash M. D., et al. Translocation and dissemination of commensal bacteria in post-stroke infection. Nature Medicine. 2016; 22 (11): 1277–1284. https://doi.org/10.1038/nm.4194
19. Ардатская М. Д., Шевцов В. В., Жакот А. Н., Феданков И. Н., Митрохин С. Д., Миронов А. Ю., Пономарева Е. В. Метаболиты микрофлоры различных биотопов при заболеваниях бронхолегочной системы. Экспериментальная и клиническая гастроэнтерология. 2014; (3): 46–54. https://elibrary.ru/szuuwt
20. Руденко П. А. Роль дисбактериоза кишечника в механизмах формирования и прогрессирования хирургической инфекции у кошек. Научная жизнь. 2018; (1): 84–98. https://elibrary.ru/ystjek
21. Orlando G., Pisani F., Mastrantonio P., Bonanni L., Di Cocco P., D’Angelo M., et al. Eubacterium plautii infection in a kidney transplant recipient: a noteworthy case of pleural effusion and fever. Clinical Transplantation. 2008; 22 (4): 520–524. https://doi.org/10.1111/j.1399-0012.2008.00805.x
22. Pernomian L., Duarte-Silva M., de Barros Cardoso C. R. The aryl hydrocarbon receptor (AHR) as a potential target for the control of intestinal inflammation: Insights from an immune and bacteria sensor receptor. Clinical Reviews in Allergy & Immunology. 2020; 59 (3): 382–390. https://doi.org/10.1007/s12016-020-08789-3
23. Zysset-Burri D. C., Morandi S., Herzog E. L., Berger L. E., Zinkernagel M. S. The role of the gut microbiome in eye diseases. Progress in Retinal and Eye Research. 2023; 92:101117. https://doi.org/10.1016/j.preteyeres.2022.101117
Об авторах
Н. Ю. РодионоваРоссия
Родионова Наталья Юрьевна - ассистент департамента ветеринарной медицины Аграрно-технологического института РУДН
ул. Миклухо-Маклая, 6, г. Москва, 117198
Е. В. Куликов
Россия
Куликов Евгений Владимирович - канд. биол. наук,
доцент департамента ветеринарной медицины Аграрно-технологического института РУДН
ул. Миклухо-Маклая, 6, г. Москва, 117198
Е. Д. Сотникова
Россия
Сотникова Елена Дмитриевна - канд. биол. наук,
доцент департамента ветеринарной медицины Аграрно-технологического института РУДН
ул. Миклухо-Маклая, 6, г. Москва, 117198
И. Е. Прозоровский
Россия
Прозоровский Иван Ежиевич - ассистент департамента ветеринарной медицины Аграрно-технологического института РУДН
ул. Миклухо-Маклая, 6, г. Москва, 117198
Ю. А. Ватников
Россия
Ватников Юрий Анатольевич - д-р вет. наук, профессор, директор департамента ветеринарной медицины Аграрно-технологического института РУДН
ул. Миклухо-Маклая, 6, г. Москва, 117198
В. Б. Руденко
Россия
Руденко Виктория Борисовна -младший научный сотрудник лаборатории биологических испытаний
проспект Науки, 6, г. Пущино, 142290, Московская область
П. А. Руденко
Россия
Руденко Павел Анатольевич - д-р вет. наук, профессор департамента ветеринарной медицины Аграрно-технологического института РУДН
ул. Миклухо-Маклая, 6, г. Москва, 117198
Рецензия
Для цитирования:
Родионова Н.Ю., Куликов Е.В., Сотникова Е.Д., Прозоровский И.Е., Ватников Ю.А., Руденко В.Б., Руденко П.А. Характеристика микробиоты кишечного тракта у телят с различными формами острой катаральной бронхопневмонии. Ветеринария сегодня. 2024;13(3):275-281. https://doi.org/10.29326/2304-196X-2024-13-3-275-281
For citation:
Rodionova N.Yu., Kulikov E.V., Sotnikova E.D., Prozorovskiy I.E., Vatnikov Yu.A., Rudenko V.B., Rudenko P.A. Characteristics of the intestinal tract microbiota in calves with various forms of acute catarrhal bronchopneumonia. Veterinary Science Today. 2024;13(3):275-281. https://doi.org/10.29326/2304-196X-2024-13-3-275-281
JATS XML



































