Перейти к:
Адъювантные свойства производных хитозана при введении мышам антирабической вакцины
https://doi.org/10.29326/2304-196X-2024-13-2-177-182
Аннотация
Для специфической иммунопрофилактики особенно актуальным остается вопрос поиска препарата, который бы отвечал всем требованиям, предъявляемым к современным адъювантам. В литературе много сведений о положительном влиянии хитозана, в том числе и на иммунную систему. В статье представлены результаты доклинических испытаний препаратов на основе различных форм хитозана, которые являются экономически доступными. В качестве испытуемых были взяты три препарата производства ООО «Биопрогресс» (г. Щелково, Россия): хитозан водорастворимый (сукцинат) – 2%-й раствор; хитозан пищевой (водорастворимый) – 2%-й раствор; хитозан пищевой (кислоторастворимый) – 2%-й раствор; а также вакцина против бешенства «Рабиков» производства ФКП «Щелковский биокомбинат» (Россия). Изучение иммуногенных свойств препаратов хитозана проводили на 85–100-суточных самках белых лабораторных мышей массой 21–35 г. Животные были поделены на 37 групп по 6 мышей в каждой. Препараты хитозана применяли подкожно или внутримышечно сочетанно с антирабической вакциной или без таковой. Животным контрольных групп вводили либо физиологический раствор, либо только вакцину. Также была сформирована группа интактных животных. Показано, что хитозан водорастворимый (сукцинат) при подкожном введении, хитозан пищевой (кислоторастворимый) в концентрации 1:64 и выше и хитозан пищевой (водорастворимый) в концентрации 1:108 при подкожном и внутримышечном способах введения повышают уровень поствакцинальных антирабических антител. Таким образом, исследуемые препараты на основе хитозана не оказывают негативного влияния на организм лабораторных животных и обладают иммуногенными свойствами.
Ключевые слова
Для цитирования:
Доброскок К.Б., Ярыгина Е.И., Липатова М.С., Калмыкова М.С. Адъювантные свойства производных хитозана при введении мышам антирабической вакцины. Ветеринария сегодня. 2024;13(2):177-182. https://doi.org/10.29326/2304-196X-2024-13-2-177-182
For citation:
Dobroskok K.B., Yarygina E.I., Lipatova M.S., Kalmykova M.S. Adjuvant properties of chitosan derivatives administered to mice with anti-rabies vaccine. Veterinary Science Today. 2024;13(2):177-182. https://doi.org/10.29326/2304-196X-2024-13-2-177-182
ВВЕДЕНИЕ
Проблемами эффективной и безопасной специфической профилактики болезней животных занимаются ученые всего мира. Несмотря на достигнутые успехи в производстве вакцин, поиск экономически выгодного, безопасного адъюванта, который бы способствовал усилению иммунного ответа, актуален по сей день.
Современные адъюванты должны повышать иммунный ответ (клеточный и/или гуморальный), легко метаболизироваться в организме и быть доступными для массового применения [1][2].
В настоящее время в мире ведется активное изучение свойств хитозана [3–20]. Его производные широко применяются в фармацевтической промышленности и в ветеринарии. Препараты на основе хитозана проявляют множество биологических эффектов, включая антимикробную и гипохолестеринемическую активность при доставке лекарств. С их помощью увеличивают скорость диссоциации плохо растворимых лекарственных средств, повышают степень их всасывания, регулируют высвобождение лекарственных веществ и создают препараты пролонгированного действия [2]. Также отмечено, что раствор хитозана усиливает как гуморальный, так и клеточный иммунный ответ при подкожном введении вакцин [15]. Также возможно инъекционное введение хитозана в составе лекарственных и вакцинных препаратов [21].
В доступной литературе есть информация по исследованию хитозана в качестве сорбента антигена и стимулятора поствакцинального иммунного ответа [3][7][8][9][10][12][13][14][17][18][19][20][22]. Прогресс в изучении свойств производных хитозана позволяет предположить, что именно они могут соответствовать основным требованиям, выдвигаемым к современным адъювантам.
Предварительно для подбора оптимальных концентраций препаратов на основе хитозана для введения животным нами были проведены исследования по определению степени цитотоксичности различных разведений испытуемых образцов на перевиваемой культуре клеток почки теленка ПТ-80 [6][11].
Цель данного исследования – изучить адъювантные свойства производных хитозана в различных концентрациях при введении мышам антирабической вакцины.
МАТЕРИАЛЫ И МЕТОДЫ
Хитозан. В качестве исходных были взяты следующие препараты хитозана производства ООО «Биопрогресс» (г. Щелково, Россия), приготовленные на основе физиологического раствора (NaCl 0,9%-й):
- хитозан водорастворимый (сукцинат), 2%-й раствор – препарат № 1;
- хитозан пищевой (водорастворимый), 2%-й раствор – препарат № 2;
- хитозан пищевой (кислоторастворимый), 2%-й раствор – препарат № 3.
Вакцины против бешенства животных:
- вакцина против бешенства «Рабиков» производства ФКП «Щелковский биокомбинат» (Россия);
- вакцина против бешенства «Рабиес» (IntervetInternational, B.V., Нидерланды) была использована для сравнения протективности с отечественной вакциной «Рабиков» в рамках реализации мероприятий по импортозамещению.
Схема опыта с животными. Для проведения исследования было сформировано 37 однородных групп самок белых лабораторных мышей массой 21–35 г, возрастом 85–100 сут по 6 гол. в каждой, которым вводили исследуемые препараты в объеме 0,3 см³ по схеме, указанной в таблице.
Таблица
Способы введения исследуемых препаратов группам мышей
Table
Routes of administration of the tested products to the mice groups
|
Препарат |
Разведение |
Номер группы |
Способ введения |
|
Опытные группы |
|||
|
Препараты с вакциной «Рабиков» |
|||
|
Препарат № 1 |
1:4 |
1 |
внутримышечно |
|
2 |
подкожно |
||
|
1:64 |
3 |
внутримышечно |
|
|
4 |
подкожно |
||
|
1:10⁸ |
5 |
внутримышечно |
|
|
6 |
подкожно |
||
|
Препарат № 2 |
1:4 |
7 |
внутримышечно |
|
8 |
подкожно |
||
|
1:64 |
9 |
внутримышечно |
|
|
10 |
подкожно |
||
|
1:10⁸ |
11 |
внутримышечно |
|
|
12 |
подкожно |
||
|
Препарат № 3 |
1:64 |
13 |
внутримышечно |
|
14 |
подкожно |
||
|
1:10⁸ |
15 |
внутримышечно |
|
|
16 |
подкожно |
||
|
Контрольные группы |
|||
|
Физиологический раствор |
|||
|
Физиологический раствор (NaCl 0,9%-й) |
– |
17 |
внутримышечно |
|
– |
18 |
подкожно |
|
|
Контроль вакцин |
|||
|
Вакцина «Рабиков» |
– |
19 |
подкожно |
|
Вакцина «Рабиес» |
– |
20 |
подкожно |
|
Исследуемые препараты без вакцины |
|||
|
Препарат № 1 |
1:4 |
21 |
внутримышечно |
|
22 |
подкожно |
||
|
1:64 |
23 |
внутримышечно |
|
|
24 |
подкожно |
||
|
1:10⁸ |
25 |
внутримышечно |
|
|
26 |
подкожно |
||
|
Препарат № 2 |
1:4 |
27 |
внутримышечно |
|
28 |
подкожно |
||
|
1:64 |
29 |
внутримышечно |
|
|
30 |
подкожно |
||
|
1:10⁸ |
31 |
внутримышечно |
|
|
32 |
подкожно |
||
|
Препарат № 3 |
1:64 |
33 |
внутримышечно |
|
34 |
подкожно |
||
|
1:10⁸ |
35 |
внутримышечно |
|
|
36 |
подкожно |
||
|
Без введения препаратов (интактная) |
– |
37 |
– |
Перед экспериментом все лабораторные животные в течение 14 дней прошли карантинирование. Ежедневно проводили клинический осмотр и контрольное взвешивание подопытных мышей. Через 28 дней с момента введения препаратов животных декапитировали и отбирали патологический материал (органы и сыворотка крови) для дальнейших исследований.
Все эксперименты на животных проводились в строгом соответствии с межгосударственными стандартами по содержанию и уходу за лабораторными животными ГОСТ 33216-2014 и ГОСТ 33215-2014, принятыми Межгосударственным советом по стандартизации, метрологии и сертификации, а также согласно требованиям Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
Индекс массы органов определяли как отношение массы органа к массе тела животного (индекс массы органа = mоргана / mживотного).
Определение титра антирабических антител. С целью выявления адъювантных свойств препаратов хитозана определяли уровень антирабических антител в сыворотке крови лабораторных животных в реакции диффузионной преципитации согласно инструкции к «Набору компонентов для диагностики бешенства животных в реакции диффузионной преципитации (РДП)» производства ФГБНУ «Всероссийский научно-исследовательский и технологический институт биологической промышленности» (Россия).
Статистическая обработка. Статистическую обработку полученных данных производили с использованием принятой в биологии и медицине стандартной программы Microsoft Excel 2007. Результаты считали достоверными при уровне вероятности р ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты предварительных испытаний на культуре клеток ПТ-80 показали, что хитозан пищевой (кислоторастворимый) в разведении 1:4 обладает цитотоксическим действием [6], поэтому в эксперименте на лабораторных животных использовали разведения 1:64 и 1:10⁸.
В течение всего времени наблюдения за мышами отклонений в поведении животных не наблюдали, специфическая смерть отсутствовала. При вскрытии мышей патологических изменений в местах инъекций (наличие воспаления, грануляции и др.) и во внутренних органах отмечено не было [6].
Печень – это орган, реагирующий увеличением размеров при острой токсичности, уменьшением – при хронической токсичности. Поэтому производили расчет индекса массы органа.
Как показано на рисунке 1, у мышей всех групп значения средних индексов массы печени находились в диапазоне от 0,045 до 0,050. Это говорит о том, что исследуемые препараты не обладают острой токсичностью.
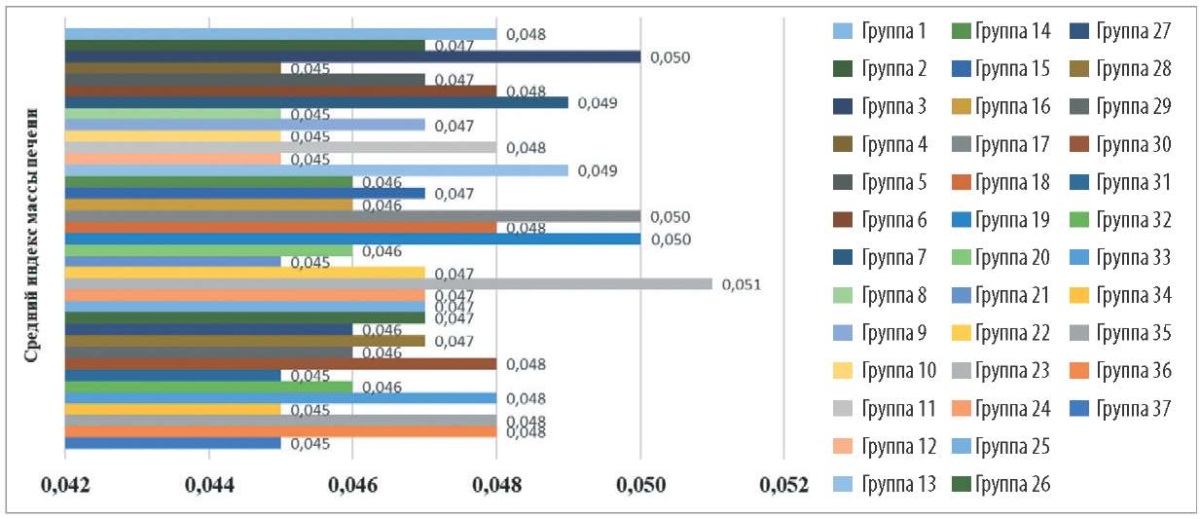
Рис. 1. Сравнение соотношения массы печени к массе тела лабораторных мышей
при введении исследуемых форм и концентраций хитозана
Fig. 1. Liver/body weight ratio in the laboratory mice after administration
of the tested forms and concentrations of the chitosan-based products
Селезенка является крупнейшим лимфоидным органом. Поэтому для оценки реакции иммунной системы на введение исследуемых препаратов рассчитывали индексы массы данного органа подопытных мышей.
Средние индексы массы селезенки животных (рис. 2), определенные для групп № 1–8 и 10–16, или соответствуют значениям, полученным для групп № 19, 20 и 37, или превышают их (р ≤ 0,05). Это может свидетельствовать о стимулировании работы иммунной системы мышей препаратами хитозана. Однако для группы № 9 средний индекс массы селезенки ниже, чем в контрольных группах. Можно предположить, что хитозан пищевой (водорастворимый) в разведении 1:64 при внутримышечном введении не оказывает выраженного иммуностимулирующего действия.
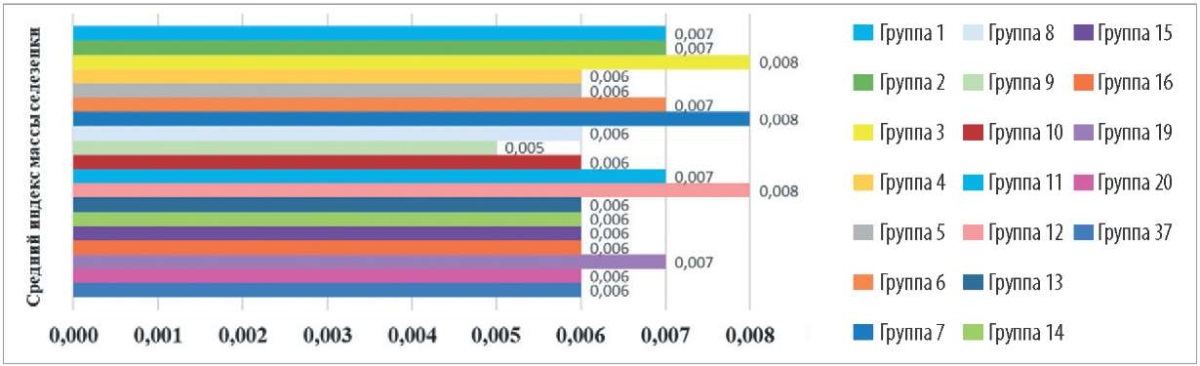
Рис. 2. Сравнение соотношения массы селезенки к массе тела лабораторных мышей
при введении исследуемых форм и концентраций хитозана
Fig. 2. Spleen/body weight ratio in the laboratory mice after administration
of the tested forms and concentrations of the chitosan-based products
Для подтверждения адъювантных свойств хитозана следующим этапом исследования было определение уровня антирабических антител в сыворотке крови лабораторных животных в реакции диффузионной преципитации. Результаты эксперимента представлены на рисунке 3.
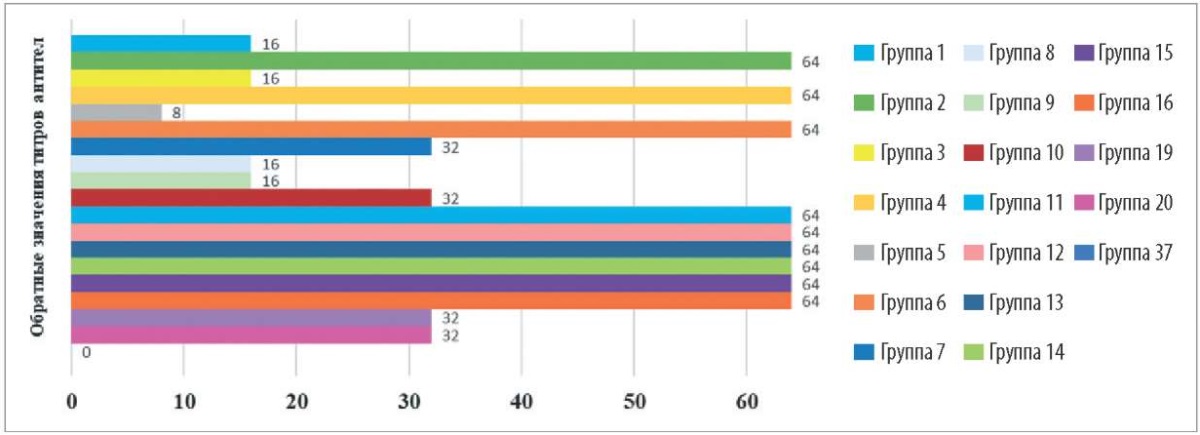
Рис. 3. Титры поствакцинальных антител против антигена вируса бешенства
в реакции диффузионной преципитации
Fig. 3. Post-vaccination antibody titres against rabies virus antigen
as demonstrated by the diffusion precipitation test
Полученные данные свидетельствуют о том, что вакцинация лабораторных животных без применения исследуемого вещества (группы № 19 и 20) приводит к выработке антирабических антител в титре 1:32, тогда как подкожное введение хитозана водорастворимого (сукцината) во всех испытуемых концентрациях (группы № 2, 4 и 6) в сочетании с вакциной стимулирует образование антител до уровня 1:64. Хитозан пищевой (кислоторастворимый) во всех исследуемых концентрациях (группы № 13–16) и хитозан пищевой (водорастворимый) в разведении 1:10⁸ (группы № 11 и 12) способствуют выработке антител независимо от способа введения.
При внутримышечном введении хитозана водорастворимого (сукцинат) во всех исследуемых концентрациях (группы № 1, 3 и 5), хитозана пищевого (водорастворимого) при подкожном в разведении 1:4 (группа № 8) и внутримышечном в разведении 1:64 (группа № 9) введении отмечена тенденция к снижению уровня антирабических антител до 1:8 – 1:16. В связи с этим можно предположить, что данные препараты в указанных разведениях и при испытуемых способах введения угнетают иммунный ответ, так как природные соли хитозана практически нерастворимы при pH выше 6, что может быть проблематичным для доставки вакцинных антигенов, растворимых и стабильных при нейтральном pH или выше [2].
ЗАКЛЮЧЕНИЕ
Показано, что исследуемые препараты на основе хитозана не оказывают негативного влияния на организм лабораторных животных и обладают иммуногенными свойствами.
В качестве экономически выгодного адъюванта для практического применения можно рекомендовать: хитозан водорастворимый (сукцинат) для подкожного введения; хитозан пищевой (кислоторастворимый) в концентрации 1:64 и выше, а также хитозан пищевой (водорастворимый) в концентрации 1:10⁸ для подкожного и внутримышечного введения. Как показывают результаты наших исследований и других авторов [2], хитозан водорастворимый (сукцинат) при внутримышечном введении и хитозан пищевой (водорастворимый) в концентрациях 1:4 при подкожном и 1:64 при внутримышечном введении снижают эффективность вакцины.
Список литературы
1. Авдеева Ж. И., Алпатова Н. А., Бондарев В. П., Волкова Р. А., Лонская Н. И., Лебединская Е. В. и др. Вакцины с адъювантами. Доклинические исследования. БИОпрепараты. Профилактика, диагностика, лечение. 2015; (1): 15–20. https://elibrary.ru/ubekft
2. Самуйленко А. Я., Гринь С. А., Еремец В. И., Албулов А. И., Еремец Н. К., Боровой В. Н. и др. Адъюванты. М.: Август Борг; 2016. 171 с. https://elibrary.ru/zsdher
3. Албулов А. И., Фролова М. А., Красочко П. А., Красочко П. П., Гринь А. В., Елисеев А. К. Использование хитозана в качестве адъюванта при производстве вакцинных препаратов. Современные перспективы в исследовании хитина и хитозана (Росхит-23): материалы шестнадцатой Всероссийской конференции с международным участием (Владивосток, 2–6 октября 2023 г.). Владивосток: Дальневосточный федеральный университет; 2023; 155–158. https://doi.org/10.24866/7444-5553-8
4. Варламов В. П., Ильина А. В., Шагдарова Б. Ц., Луньков А. П., Мысякина И. С. Хитин/хитозан и его производные: фундаментальные и прикладные аспекты. Успехи биологической химии. 2020; 60: 317–368. https://www.fbras.ru/wp-content/uploads/2020/01/8-Varlamov-final.pdf
5. Доброскок К. Б., Липатова М. С., Ярыгина Е. И. Влияние хитозана сукцината на формирование монослоя культуры клеток ПТ-80. Сборник научных трудов десятой Всероссийской межвузовской конференции по клинической ветеринарии в формате Purina Partners (Москва, 18 декабря 2020 г.). М.: НПО «Сельскохозяйственные технологии»; 2020; 453–460. https://elibrary.ru/slcelz
6. Доброскок К. Б., Ярыгина Е. И. Доклинические исследования различных форм хитозана на биологических системах: культуре клеток ПТ-80 и лабораторных мышах. Актуальные вопросы биологии, биотехнологии, ветеринарии, зоотехнии, товароведения и переработки сырья животного и растительного происхождения: материалы национальной научно-практической конференции (Москва, 1 апреля 2021 г.). Часть II. М.: ФГБОУ ВО МГАВМиБ – МВА имени К. И. Скрябина; 2021; 14–16.
7. Курашова С. С., Дзагурова Т. К., Ишмухаметов А. А., Егорова М. С., Баловнева М. В., Соцкова С. Е., Ткаченко Е. А. Адъюванты на основе углеводов для производства вакцин. БИОпрепараты. Профилактика, диагностика, лечение. 2018; 18 (2): 81–91. https://doi.org/10.30895/2221-996X-2018-18-2-81-91
8. Минькова О. А., Ярыгина Е. И., Бачинская В. М. Влияние препарата хитозана в составе вакцины на продолжительность иммунного ответа у кур. Вакцины нового поколения для профилактики особо опасных болезней сельскохозяйственных животных: сборник трудов Международной научно-практической конференции (Москва, 10 октября 2023 г.). Под. общ. ред. С. В. Позябина, Л. А. Гнездиловой. М.: Сельскохозяйственные технологии; 2023; 224–230. https://elibrary.ru/erolzp
9. Хантимирова Л. М. Получение хитозана, его производных, изучение их физико-химических характеристик и иммуноадъювантной активности в составе инактивированных вакцин против гриппа: автореф. дис. … канд. биол. наук. М.; 2019. 24 с.
10. Хантимирова Л. М., Каширина О. С., Черникова М. И., Васильев Ю. М. Сравнительная оценка иммуногенности охарактеризованных препаратов на основе хитозана и других адъювантов в составе инактивированных вакцин против гриппа. Эпидемиология и Вакцинопрофилактика. 2016; 15 (1): 86–92 с. https://doi.org/10.31631/2073-3046-2016-15-1-86-92
11. Ярыгина Е. И., Калмыкова М. С., Третьякова И. В. Изучение цитотоксического действия препаратов на основе хитозана на перевиваемые культуры клеток. Ветеринария, зоотехния и биотехнология. 2019; (8): 40–43. https://elibrary.ru/vnvdpa
12. Malik A., Gupta M., Gupta V., Gogoi H., Bhatnagar R. Novel application of trimethyl chitosan as an adjuvant in vaccine delivery. International Journal of Nanomedicine. 2018; 13: 7959–7970. https://doi.org/10.2147/ijn.s165876
13. Choi B., Jo D.-H., Anower A. K. М. М., Islam S. M. S., Sohn S. Chitosan as an immunomodulating adjuvant on T-cells and antigen-presenting cells in herpes simplex virus type 1 infection. Mediators of Inflammation. 2016; 2016:4374375. https://doi.org/10.1155/2016/4374375
14. Zaharoff D. A., Rogers C. J., Hance K. W., Schlom J., Greiner J. W. Chitosan solution enhances both humoral and cell-mediated immune responses to subcutaneous vaccination. Vaccine. 2017; 25 (11): 2085–2094. https://doi.org/10.1016/j.vaccine.2006.11.034
15. Younes I., Rinaudo M. Chitin and chitosan preparation from marine sources. Structure, properties and applications. Marine Drugs. 2015; 13 (3): 1133–1174. https://doi.org/10.3390/md13031133
16. Vázquez J. A., Rodríguez-Amado I., Montemayor M. I., Fraguas J., González M. del P., Murado M. A. Chondroitin sulfate, hyaluronic acid and chitin/chitosan production using marine waste sources: characteristics, applications and eco-friendly processes: A review. Marine Drugs. 2013; 11 (3): 747–774. https://doi.org/10.3390/md11030747
17. Muzzarelli R. A. A. Chitins and chitosans as immunoadjuvants and non-allergenic drug carriers. Marine Drugs. 2010; 8 (2): 292–312. https://doi.org/10.3390/md8020292
18. Vasiliev Y. M. Chitosan-based vaccine adjuvants: incomplete characterization complicates preclinical and clinical evaluation. Expert Review of Vaccines. 2015; 14 (1): 37–53. https://doi.org/10.1586/14760584.2015.956729
19. Gong Y., Tao L., Wang F., Liu W., Jing L., Liu D., et al. Chitosan as an adjuvant for a Helicobacter pylori therapeutic vaccine. Molecular Medicine Reports. 2015; 12 (3): 4123–4132. https://doi.org/10.3892/mmr.2015.3950
20. Xia Y., Fan Q., Hao D., Wu J., Ma G., Su Z. Chitosan-based mucosal adjuvants: Sunrise on the ocean. Vaccine. 2015; 33 (44): 5997–6010. https://doi.org/10.1016/j.vaccine.2015.07.101
21. Камская В. Е. Хитозан: структура, свойства и использование. Научное обозрение. Биологические науки. 2016; (6): 36–42. https://science-biology.ru/ru/article/view?id=1020
22. Wen Z. S., Xu Y. L., Zou X. T., Xu Z. R. Chitosan nanoparticles act as an adjuvant to promote both Th1 and Th2 immune responses induced by ovalbumin in mice. Marine Drugs. 2011; 9 (6): 1038–1055. https://doi.org/10.3390/md9061038
Об авторах
К. Б. ДоброскокРоссия
Доброскок Ксения Борисовна, аспирант кафедры вирусологии и микробиологии имени академика В. Н. Сюрина
ул. Академика Скрябина, 23, г. Москва, 109472
Е. И. Ярыгина
Россия
Ярыгина Елена Игоревна, д-р биол. наук, старший научный сотрудник, профессор кафедры вирусологии и микробиологии имени академика В. Н. Сюрина
ул. Академика Скрябина, 23, г. Москва, 109472
М. С. Липатова
Россия
Липатова Мария Сергеевна, магистр кафедры вирусологии и микробиологии имени академика В. Н. Сюрина
ул. Академика Скрябина, 23, г. Москва, 109472
М. С. Калмыкова
Россия
Калмыкова Марина Станиславовна, доцент, канд. вет. наук, доцент кафедры вирусологии и микробиологии имени академика В. Н. Сюрина
ул. Академика Скрябина, 23, г. Москва, 109472
Рецензия
Для цитирования:
Доброскок К.Б., Ярыгина Е.И., Липатова М.С., Калмыкова М.С. Адъювантные свойства производных хитозана при введении мышам антирабической вакцины. Ветеринария сегодня. 2024;13(2):177-182. https://doi.org/10.29326/2304-196X-2024-13-2-177-182
For citation:
Dobroskok K.B., Yarygina E.I., Lipatova M.S., Kalmykova M.S. Adjuvant properties of chitosan derivatives administered to mice with anti-rabies vaccine. Veterinary Science Today. 2024;13(2):177-182. https://doi.org/10.29326/2304-196X-2024-13-2-177-182



































