Перейти к:
Видовое разнообразие клостридий у крупного рогатого скота
https://doi.org/10.29326/2304-196X-2025-14-2-194-200
Аннотация
Введение. Клостридиозы, несмотря на относительно спорадические случаи их возникновения, имеют повсеместное распространение и характеризуются высокой летальностью, что наносит экономический ущерб сельскому хозяйству. У крупного рогатого скота патогенные клостридии вызывают такие заболевания, как энтеротоксемия, злокачественный отек, столбняк, ботулизм. Этиологически значимыми видами клостридий являются Clostridium septicum, Clostridium perfringens, Clostridium chauvoei, Clostridium novyi, Clostridium sordellii.
Цель работы. Изучение видового разнообразия клостридий на основании исследований патолого-анатомического и секционного материала крупного рогатого скота из различных регионов России, определение мест их локализации в организме животных, а также антибактериальной устойчивости Clostridium perfringens к наиболее распространенным группам антибиотиков.
Материалы и методы. В период проведения исследования руководствовались общепринятыми нормативно-правовыми документами, методическими указаниями, рекомендациями, инструкциями; применяли микробиологические, масс-спектрометрические методы. Для определения антибактериальной устойчивости использовались различные группы препаратов: макролиды, монобактамы, пенициллины, полипептиды, гликопептиды, аминогликозиды, карбапенемы, линкозамиды, тетрациклины, ансамицины, диаминопиримидины, фузидины и др. Изоляты клостридий выделяли, используя рутинные бактериологические методы, видовую идентификацию выполняли с помощью времяпролетной масс-спектрометрии MALDI-ToF.
Результаты. При исследовании 359 образцов биоматериала было выделено и идентифицировано 137 изолятов клостридий (Paraclostridium bifermentans, Clostridium perfringens, Clostridium tertium, Clostridium butyricum, Clostridium septicum, Clostridium sporogenes, Clostridium cadaveris, Clostridium sphenoides, Clostridium cochlearium, Clostridium sartagoforme, Clostridium chauvoei, Clostridium novyi, Clostridium sordellii, Clostridium paraputrificum, Clostridium spp.), из которых 25 обладали патогенными и 17 – токсигенными свойствами. Чаще всего клостридии обнаруживали в печени, тонком и толстом отделах кишечника, мышцах. При этом выявлено превалирование Clostridium perfringens (17,5%). Установлена полирезистентность изолятов данного вида бактерии к цефиксиму, фузидиевой кислоте, цефотаксиму, цефаклору, спектиномицину, пиперациллину, кларитромицину, дорипенему, доксициклину.
Заключение. Полученные результаты могут быть использованы для модификации существующих протоколов лечения клостридиозов, корректировки состава иммунобиологических препаратов, разработки рекомендаций по использованию антибиотиков в животноводстве для снижения рисков развития антимикробной резистентности.
Ключевые слова
Для цитирования:
Шастин П.Н., Савинов В.А., Лаишевцев А.И., Мандрыка Е.Д., Фабрикантова Е.А., Супова А.В. Видовое разнообразие клостридий у крупного рогатого скота. Ветеринария сегодня. 2025;14(2):194-200. https://doi.org/10.29326/2304-196X-2025-14-2-194-200
For citation:
Shastin P.N., Savinov V.A., Laishevtsev A.I., Mandryka E.D., Fabrikantova E.A., Supova A.V. Clostridium species diversity in cattle. Veterinary Science Today. 2025;14(2):194-200. https://doi.org/10.29326/2304-196X-2025-14-2-194-200
ВВЕДЕНИЕ
Впервые род клостридий был описан A. Prażmowski в 1880 г., в настоящее время выявлено более 225 видов данной бактерии в различных регионах планеты. Клостридии являются грамположительными палочками, образующими споры, имеют широкое распространение в окружающей среде, а также входят в состав микробиома человека и животных, но только некоторые из них способны вызывать заболевания у животных [1][2][3]. Клостридиозы характеризуются высокой смертностью. Благодаря способности спорообразования клостридии могут долгое время сохраняться в почве, таким образом представляя собой потенциальную угрозу возникновения заболевания [4][5][6]. Проникновение в организм животных происходит в основном при поедании контаминированного корма (алиментарным путем), через раны либо при вдыхании. Основными факторами патогенности клостридий являются экзотоксины и ферменты [7][8][9][10], которые обладают гемолитическим, некротизирующим и летальным эффектами. Наиболее сильнодействующими токсинами клостридиального происхождения являются ботулинистический и столбнячный нейротоксины, а также эпсилон-токсин, вырабатываемый Clostridium perfringens типов B и D [11][12][13][14].
Появление полирезистентных штаммов клостридий приводит к более широкому распространению клостридиозов. Ряд ученых отмечают низкую терапевтическую эффективность антибактериальных препаратов при клиническом проявлении анаэробной энтеротоксемии у молодняка крупного рогатого скота, высокую летальность и необходимость специфической профилактики [7][15][16][17][18][19].
В настоящее время, по данным компонента «Гален» ФГИС «ВетИС», перечень зарегистрированных вакцин против клостридиозов крупного рогатого скота на территории Российской Федерации представлен следующими препаратами: «Клостривак» (Tecnovax S. A., Аргентина); «Коглавакс» (Ceva Sante Animale, Франция; Ceva-Phylaxia Veterinary Biologicals Company, Венгрия); «Клостбовак-8» (ООО «Ветбиохим», Россия); «Клостарм-9» (ФКП «Армавирская биофабрика», Россия); «Куболак» (CZ Vaccines S. A. U., Испания); «Антокс-9» (ФКП «Ставропольская биофабрика», Россия); «ВанШотУльтра 8» (Zoetis Inc., США); «Скоугард 4КС» (Zoetis Inc., США).
Актуальность и новизна работы заключается в получении данных по антибактериальной устойчивости этиологически значимых изолятов клостридий, о структуре штаммов, выделенных от крупного рогатого скота, токсигенных и патогенных свойствах. Полученные сведения будут способствовать совершенствованию системы контроля за клостридиальными инфекциями крупного рогатого скота, что, в свою очередь, снизит экономические потери животноводства.
Целью работы стало проведение мониторинговых исследований по выявлению клостридий, а также оценка уровня антимикробной резистентности изолятов Clostridium perfringens, полученных от крупного рогатого скота из различных регионов России, изучение их токсигенных и патогенных свойств.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена в 2022–2024 гг. на базе лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени К. И. Скрябина и Я. Р. Коваленко Российской академии наук» в рамках государственного проекта Министерства науки и высшего образования Российской Федерации (FGUG-2025-0003). В результате собственных исследований получены мониторинговые данные и выполнена практическая часть. Секционный и патолого-анатомический материалы, отобранные от крупного рогатого скота, поступили из различных регионов России: Нижегородской, Московской, Ленинградской, Рязанской, Новосибирской, Пензенской областей, Республики Мордовии.
Биоматериал. Всего было исследовано 359 образцов (печень, сердце, селезенка, легкое, почка, мышца, тонкий и толстый кишечник, желудок, срез с копыт, околоплодные воды и др.).
Выделение изолятов, определение патогенных и токсигенных свойств. Исследование, целью которого было выделение изолятов микроорганизмов, этиологически наиболее значимых для промышленного животноводства, а именно семейства Clostridiaceae (клостридии), реализовано согласно ГОСТ 26503-85 «Животные сельскохозяйственные. Методы лабораторной диагностики клостридиозов»1.
Идентификация клостридий. Видовую идентификацию микроорганизмов выполняли методом масс-спектрометрии с использованием системы MALDI Biotyper (Bruker Daltonik GmbH, Германия) согласно «Методическим указаниям по идентификации микроорганизмов с применением масс-спектрометра MALDI Biotyper при исследовании продовольственного сырья и пищевых продуктов» (одобрены НТС Россельхознадзора от 03.04.2014).
Определение антибактериальной резистентности культур микроорганизмов проводили диско-диффузионным методом в соответствии с МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам»2. В ходе реализации научной работы были использованы антибактериальные препараты различных групп (HiMedia Laboratories Pvt Ltd., Индия): макролиды (азитромицин 15 мкг, кларитромицин 15 мкг, пристинамицин 15 мкг, спирамицин 30 мкг, тилозин 15 мкг, эритромицин 15 мкг), монобактамы (азтреонам 30 мкг), пенициллины (амоксиклав 30 мкг, амоксициллин 25 мкг, ампициллин 25 мкг, бензилпенициллин 10 мкг, карбенициллин 100 мкг, пиперациллин 100 мкг), полипептиды (бацитрацин 10 мкг, полимиксин-B 50 мкг), хлорамфеникол 30 мкг, гликопептиды (ванкомицин 30 мкг), аминогликозиды (гентамицин 30 мкг, канамицин 30 мкг, спектиномицин 100 мкг, стрептомицин 25 мкг), карбапенемы (дорипенем 10 мкг), линкозамиды (клиндамицин 2 мкг, линкомицин 10 мкг), фторхинолоны (левофлоксацин 5 мкг, норфлоксацин 10 мкг, офлоксацин 5 мкг, пефлоксацин 5 мкг, ципрофлоксацин 30 мкг, энрофлоксацин 10 мкг), тетрациклины (окситетрациклин 30 мкг, тетрациклин 30 мкг, хлортетрациклин 30 мкг, доксициклин 30 мкг), ансамицины (рифампицин 15 мкг), сульфаниламиды (сульфадиазин 100 мкг, сульфафуразол 300 мкг), диаминопиримидины (триметоприм 25 мкг), цефалоспорины (цефиксим 5 мкг, цефазолин 30 мкг, цефаклор 30 мкг, цефалексин 30 мкг, цефотаксим 30 мкг, цефепим 30 мкг, цефоперазон 75 мкг, цефпиром 30 мкг, цефтриаксон 30 мкг), производные фосфоновой кислоты (фосфомицин 50 мкг), фузидины (фузидиевая кислота 30 мкг).
Интерпретацию результатов проводили в соответствии с рекомендациями CLSI (Clinical and Laboratory Standards Institute) и EUCAST (European Committee on Antimicrobial Susceptibility Testing) [20][21].
Статистическая обработка результатов велась с использованием Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенных исследований выделено и идентифицировано 137 изолятов следующих клостридий: Paraclostridium bifermentans, Clostridium perfringens, Clostridium tertium, Clostridium butyricum, Clostridium septicum, Clostridium sporogenes, Clostridium cadaveris, Clostridium sphenoides, Clostridium cochlearium, Clostridium sartagoforme, Clostridium chauvoei, Clostridium novyi, Clostridium sordellii, Clostridium paraputrificum, Clostridium spp.
Установлено видовое разнообразие изолятов клостридий, циркулирующих на территории Российской Федерации, которое представлено на рисунке 1.
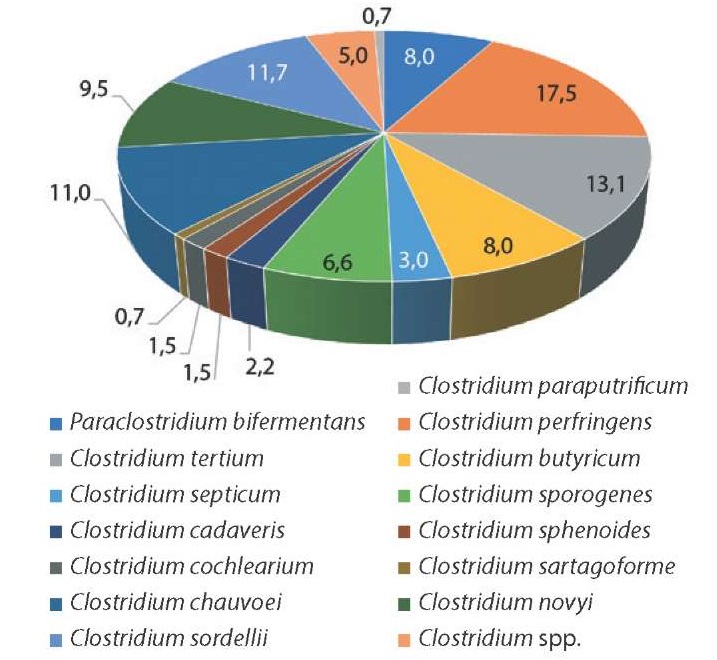
Рис. 1. Видовое разнообразие изолятов клостридий, циркулирующих на территории Российской Федерации (n = 137), %
Fig. 1. Species diversity of Clostridium isolates circulating in the Russian Federation (n = 137), %
Выявлено превалирование C. perfringens – 17,5%, далее по убыванию распространение имеют C. tertium – 13,1%, C. sordellii – 11,7%, C. chauvoei – 11,0%, C. novyi – 9,5%, P. bifermentans и C. butyricum – 8,0%, C. sporogenes – 6,6%, Clostridium spp. – 5,0%, C. septicum – 3,0%, C. cadaveris – 2,2%, C. sphenoides и C. cochlearium – по 1,5%, наименьшую долю составляют изоляты C. sartagoforme и C. paraputrificum – 0,7%.
Результаты определения антибиотикорезистентности изолятов C. perfringens (n = 24), выделенных от крупного рогатого скота из различных регионов Российской Федерации, представлены на рисунке 2.
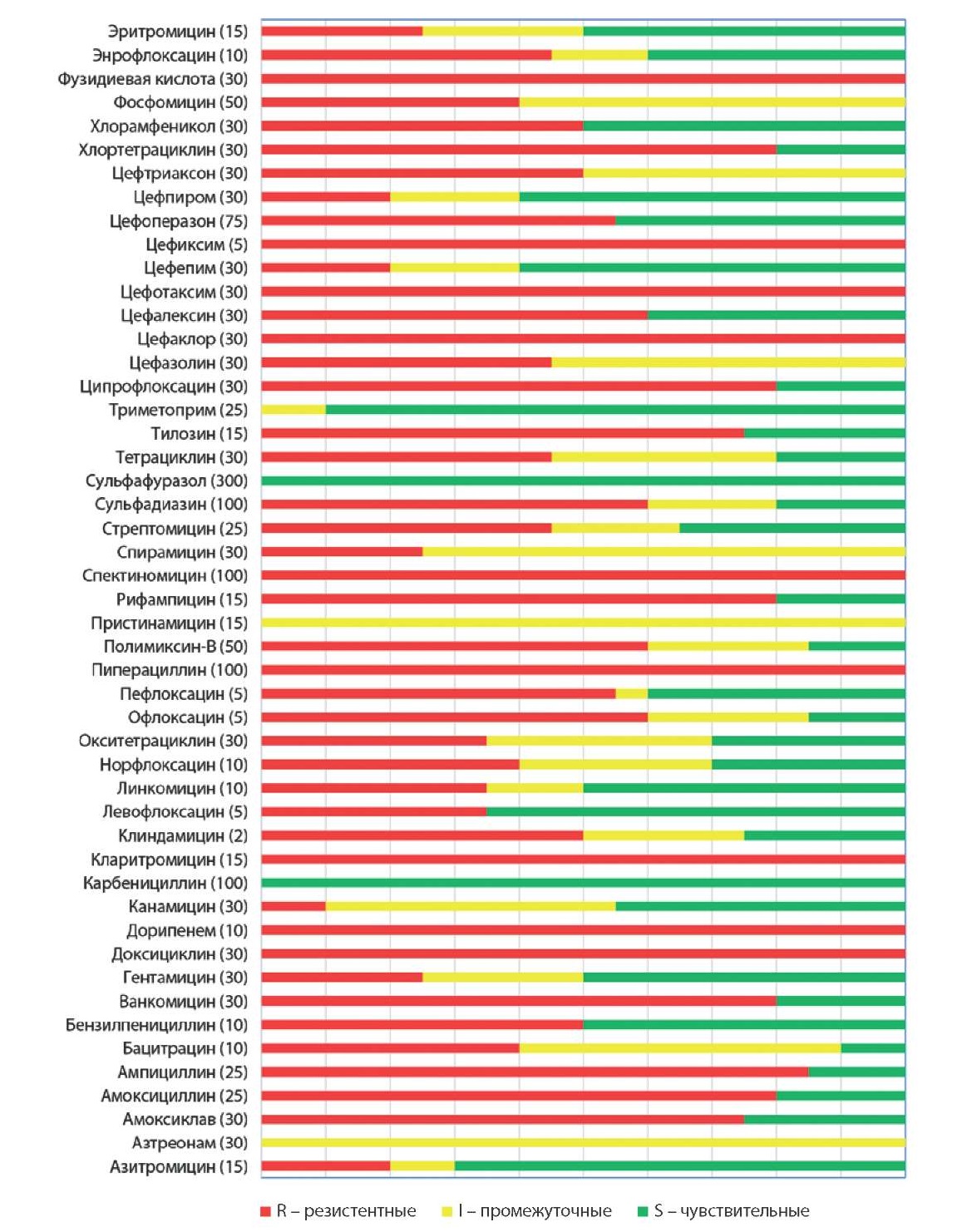
Рис. 2. Антибактериальная устойчивость изолятов C. perfringens (n = 24), полученных от крупного рогатого скота
Fig. 2. Antibiotic resistance of C. perfringens isolates (n = 24) recovered from cattle
Согласно полученным данным, можно утверждать, что изоляты C. perfringens (n = 24) резистентны к цефиксиму, фузидиевой кислоте, цефотаксиму, цефаклору, спектиномицину, пиперациллину, кларитромицину, дорипенему, доксициклину. Антибиотикорезистентность к ампициллину составила 85%, к амоксициллину, хлортетрациклину, ванкомицину, рифампицину и ципрофлоксацину – 80%, к тилозину и амоксиклаву – 75%, к сульфадиазину, цефалексину, офлоксацину и полимиксину-В – 60%, к пефлоксацину и цефоперазону – 55%, к бензилпенициллину, клиндамицину, цефтриаксону и хлорамфениколу – 50%, к энрофлоксацину, цефазолину, тетрациклину и стрептомицину – 45% изолятов. 40% изолятов C. perfringens имели устойчивость к бацитрацину, норфлоксацину, фосфомицину, 35% изолятов – к левофлоксацину, линкомицину, окситетрациклину, 25% изолятов – к эритромицину, спирамицину и гентамицину, 20% изолятов – к азитромицину, цефепиму, цефпирому. К сульфафуразолу и карбенициллину были чувствительны все исследуемые изоляты C. perfringens (100%), к триметоприму – 90%, к азитромицину – 70%, а к левофлоксацину – 65%, к канамицину – 45% изолятов. Промежуточной чувствительностью к азтреонаму и пристинамицину обладали все исследуемые штаммы, к спирамицину – 75%, к фосфомицину – 60%, к цефазолину – 55%, к канамицину – 45% изолятов.
Среди 137 выделенных изолятов клостридий у 25 установлены патогенные свойства и у 17 – токсигенные. Полученные данные представлены графически в процентах на рисунках 3 и 4.
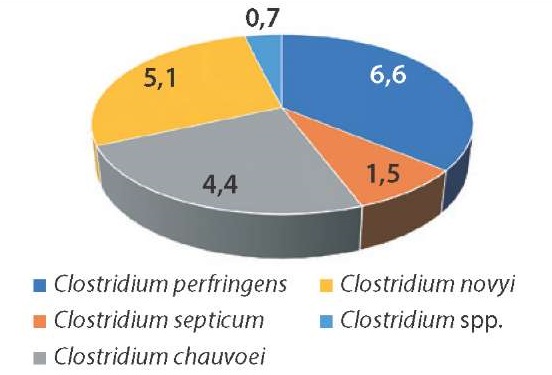
Рис. 3. Видовой состав изолятов клостридий, обладающих патогенными свойствами, %
Fig. 3. Species composition of Clostridium isolates with pathogenic properties, %
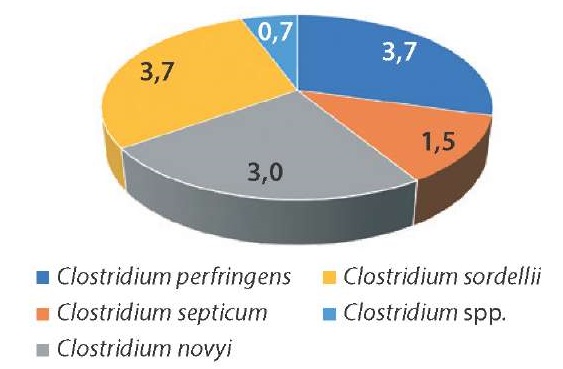
Рис. 4. Видовой состав изолятов клостридий, обладающих токсигенными свойствами, %
Fig. 4. Species composition of Clostridium isolates with toxic properties, %
Патогенными свойствами в большинстве случаев обладали изоляты C. perfringens (6,6%). Наличие факторов патогенности выявлено у 5,1% штаммов C. novyi, у 4,4% изолятов C. chauvoei, у 1,5% штаммов C. septicum и у 0,7% изолятов Clostridium spp. Токсигенные свойства установлены у C. sordellii (3,7%), C. perfringens (3,7%), C. novyi (3,0%), C. septicum (1,5%) и Clostridium spp. (0,7%).
Места локализации клостридий в организме крупного рогатого скота представлены в таблице.
Таблица
Места локализации клостридий в организме крупного рогатого скота
Table
Localization of Clostridia in cattle
|
Вид клостридий |
Наименование биоматериала |
||||||||||
|
Сердце |
Печень |
Селезенка |
Легкое |
Почка |
Мышца |
Тонкий кишечник |
Толстый кишечник |
Желудок |
Срез с копыт |
Околоплодные воды |
|
|
Paraclostridium bifermentans |
– |
+ |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
– |
|
Clostridium tertium |
– |
+ |
+ |
– |
– |
+ |
+ |
+ |
– |
– |
– |
|
Clostridium perfringens |
– |
+ |
+ |
– |
+ |
+ |
+ |
+ |
+ |
– |
+ |
|
Clostridium butyricum |
– |
+ |
– |
– |
– |
– |
+ |
+ |
+ |
– |
– |
|
Clostridium cochlearium |
– |
– |
– |
– |
– |
– |
– |
+ |
– |
– |
– |
|
Clostridium sartagoforme |
– |
– |
– |
– |
– |
– |
– |
+ |
– |
– |
– |
|
Clostridium septicum |
– |
+ |
– |
– |
+ |
+ |
– |
+ |
– |
– |
– |
|
Clostridium sporogenes |
– |
+ |
– |
– |
– |
+ |
+ |
+ |
– |
– |
– |
|
Clostridium sphenoides |
– |
– |
– |
– |
– |
– |
– |
+ |
– |
– |
– |
|
Clostridium chauvoei |
– |
+ |
– |
– |
– |
– |
+ |
+ |
+ |
– |
– |
|
Clostridium novyi |
– |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
Clostridium sordellii |
– |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
Clostridium paraputrificum |
– |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
Clostridium spp. |
– |
+ |
– |
– |
– |
+ |
+ |
+ |
– |
– |
– |
|
Clostridium cadaveris |
– |
+ |
– |
– |
+ |
– |
– |
+ |
– |
– |
– |
Согласно приведенным данным, чаще всего клостридии выделяли из печени, тонкого и толстого отделов кишечника, а также мышц.
Клостридии являются широко распространенными микроорганизмами, вызывающими заболевания у животных, птиц и людей. Устойчивость к противомикробным препаратам является серьезной проблемой в ветеринарии ввиду того, что 80% всех антибиотиков в мире применяется в сельском хозяйстве, в том числе в качестве кормовых добавок и стимуляторов роста. Полученные при проведении настоящего исследования результаты по антимикробной резистентности к цефотаксиму согласуются с данными Н. А. Безбородовой и соавт. [7], H. A. Ahmed et al. [22]. В работе, проведенной иранскими исследователями F. Khademi et al., отмечена устойчивость C. perfringens к ампициллину (25,8%), эритромицину (32,9%), гентамицину (45,4%), тетрациклину (19,5%), амоксициллину (19,3%), бацитрацину (89,1%) [23]. Группа ученых из Китая и Пакистана исследовала 11 наиболее часто используемых антибиотиков, 2 из них не оказывали ингибирующего воздействия, 5 – были эффективны, а 4 – обладали умеренной активностью против C. perfringens. Линкомицин и амикацин не ингибировали изоляты, тетрациклин, пенициллин, эритромицин и окситетрациклин в меньшей степени подавляли рост клостридий. Ученые пришли к выводу о целесообразности использования нескольких видов антибиотиков, что является более эффективным подходом для подавления бактериальной инфекции [24]. Исследователи из Кот-д’Ивуара в своей работе определили, что уровень антибиотикорезистентности у C. perfringens к тетрациклину, доксициклину, хлорамфениколу, эритромицину составляет от 20 до 50% [25]. Группа ученых из Южной Кореи при изучении степени распространенности и устойчивости C. perfringens к антибиотикам установила, что резистентность к тетрациклину составила 100%, к ампициллину – 31,6%, к хлорамфениколу – 68,4%, к метронидазолу – 34,2%, к имипенему – 71%. Также авторы исследования отмечают важный момент комбинированной устойчивости 78,9% изолятов к нескольким антимикробным препаратам [26].
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований секционного и патматериала от крупного рогатого скота в 2022–2024 гг. выделено 137 изолятов клостридий, из них у 25 установлены патогенные свойства, а у 17 – токсигенные. Наиболее частыми местами локализации клостридий были печень, толстый и тонкий отделы кишечника, мышцы, желудок. Также бактерии обнаруживали в почках, селезенке, околоплодных водах и смывах с копыт.
При проведении мониторинговых исследований по определению антимикробной резистентности изолятов C. perfringens выявлена устойчивость к цефиксиму, фузидиевой кислоте, цефотаксиму, цефаклору, спектиномицину, пиперациллину, кларитромицину, дорипенему, доксициклину.
Результаты данного исследования могут быть использованы для модификации существующих протоколов лечения клостридиальных инфекций, корректировки состава иммунобиологических препаратов, разработки рекомендаций по использованию антибиотиков в животноводстве для снижения рисков развития антимикробной резистентности.
Вклад авторов: Шастин П. Н. – подбор и анализ источников по теме, анализ экспериментальных и лабораторных исследований, написание текста статьи; Савинов В. А. – подбор и анализ источников по теме; Лаишевцев А. И. – редактирование текста статьи, формальный анализ, формулировка выводов; Мандрыка Е. Д. и Фабрикантова Е. А. – проведение микробиологических исследований, сбор и систематизация данных; Супова А. В. – проведение микробиологических исследований, обобщение и интерпретация результатов исследования.
Contribution of the authors: Shastin P. N. – source selection and analysis, experimental and laboratory data analysis, paper writing; Savinov V. A. – source selection and analysis; Laishevtsev A. I. – paper editing, formal analysis, drawing conclusions; Mandryka E. D. and Fabrikantova E. A. – microbiological tests, data accumulation and systematization; Supova A. V. – microbiological tests, test result compilation and interpretation.
1. https://base.garant.ru/5916932
2. https://docs.cntd.ru/document/1200038583
Список литературы
1. Капустин А. В., Алипер Т. И. Эпизоотология и профилактика клостридиозов крупного рогатого скота. Единый мир – единое здоровье: материалы VII Международного ветеринарного конгресса (Уфа, 19–21 апреля 2017 г.). Уфа: Российская ветеринарная ассоциация; 2017; 106–108. https://elibrary.ru/zarmnr
2. Судоргина Т. Е., Глотова Т. И., Нефедченко А. В., Котенева С. В., Велькер Д. А., Глотов А. Г. Частота выделения бактерий Clostridium spp. и их ассоциаций при различных формах клостридиоза крупного рогатого скота. Сибирский вестник сельскохозяйственной науки. 2024; 54 (3): 55–62. https://doi.org/10.26898/0370-8799-2024-3-6
3. Salvarani F. M., Vieira E. V. Clostridial infections in cattle: a comprehensive review with emphasis on current data gaps in Brazil. Animals. 2024; 14 (20):2919. https://doi.org/10.3390/ani14202919
4. Robi D. T., Mossie T., Temteme S. A comprehensive review of the common bacterial infections in dairy calves and advanced strategies for health management. Veterinary Medicine: Research and Reports. 2024; 15: 1–14. https://doi.org/10.2147/vmrr.s452925
5. Santos B. L., Ladeira S. R. L., Riet-Correa F., Soares M. P., Marcolongo- Pereira C., Sallis E. S. V., et al. Clostridial diseases diagnosed in cattle from the South of Rio Grande do Sul, Brazil. A forty-year survey (1978–2018) and a brief review of the literature. Pesquisa Veterinária Brasileira. 2019; 39 (7): 435–446. http://doi.org/10.1590/1678-5150-pvb-6333
6. Popoff M. R., Bouvet P. Clostridial toxins. Future Microbiology. 2009; 4 (8): 1021–1064. https://doi.org/10.2217/fmb.09.72
7. Безбородова Н. А., Соколова О. В., Кожуховская В. В., Томских О. Г., Печура Е. В., Суздальцева М. А. Патогенные виды клостридий и их устойчивость к антибиотикам, факторы вирулентности и геномные особенности. Инновации и продовольственная безопасность. 2023; (3): 39–51. https://doi.org/10.31677/2311-0651-2023-41-3-39-51
8. Глотова Т. И., Терентьева Т. Е., Глотов А. Г. Возбудители и возрастная восприимчивость крупного рогатого скота к клостридиозам. Сибирский вестник сельскохозяйственной науки. 2017; 47 (1): 90–96. https://elibrary.ru/ylkevt
9. Kapustin A. V., Laishevtcev A. I., Ivanov E. V., Danilyuk A. V. Species diversity of Clostridia causing malignant edema in cattle. IOP Conference Series: Earth and Environmental Science. 2020; 548 (7):072041. https://doi.org/10.1088/1755-1315/548/7/072041
10. Мельцов И. В., Блохин А. А., Сухинин А. А., Батомункуев А. С., Кутузова Л. А. Эпизоотологическое расследование вспышки эмфизематозного карбункула крупного рогатого скота (на примере Иркутской области). Международный вестник ветеринарии. 2024; (3): 84–94. https://doi.org/10.52419/issn2072-2419.2024.3.84
11. Rings D. M. Clostridial disease associated with neurologic signs: tetanus, botulism, and enterotoxemia. Veterinary Clinics of North America: Food Animal Practice. 2004; 20 (2): 379–391. https://doi.org/10.1016/j.cvfa.2004.02.006
12. Otter A., Uzal F. A. Clostridial diseases in farm animals: 2. Histo toxic and neurotoxic diseases. In Practice. 2020; 42 (5): 279–288. https://doi.org/10.1136/inp.m1984
13. Otter A., Uzal F. A. Clostridial diseases in farm animals: 1. Enterotoxaemias and other alimentary tract infections. In Practice. 2020; 42 (4): 219–232. https://doi.org/10.1136/inp.m1462
14. Jing W., Pilato J. L., Kay C., Feng S., Tuipulotu D. E., Mathur A., et al. Clostridium septicum α-toxin activates the NLRP3 inflammasome by engaging GPI-anchored proteins. Science Immunology. 2022; 7 (71):eabm1803. https://doi.org/10.1126/sciimmunol.abm1803
15. Kapustin A. V., Laishevtsev A. I., Motorygin A. V. Emphysematous carbuncle in cattle. Russian Journal of Agricultural and SocioEconomic Sciences. 2021; (1): 149–156. https://doi.org/10.18551/rjoas.2021-01.20
16. Капустин А. В. Разработка вакцины против эмфизематозного карбункула крупного рогатого скота. Russian Journal of Agricultural and SocioEconomic Sciences. 2016; (5): 97–102. https://doi.org/10.18551/rjoas.2016-05.13
17. Терентьева Т. Е., Глотова Т. И., Котенева С. В., Глотов А. Г. Видовой спектр бактерий рода Clostridium, выделенных от крупного рогатого скота на молочных комплексах. Российский ветеринарный журнал. Сельскохозяйственные животные. 2016; (1): 5–8. https://elibrary.ru/vmdwdn
18. Козлова А. Д., Горбачева Н. С., Клименкова О. В., Лаишевцев А. И., Капустин А. В., Яцентюк С. П. Использование молекулярно-генетических методов для типирования Clostridium perfringens. Russian Journal of Agricultural and SocioEconomic Sciences. 2017; (3): 188–194. https://doi.org/10.18551/rjoas.2017-03.23
19. Скляров О. Д., Капустин А. В., Лаишевцев А. И., Гулюкин А. М. Интерференция компонентов в поливалентной вакцине против клостридиозов крупного и мелкого рогатого скота. Российский ветеринарный журнал. 2017; (1): 20–23. https://elibrary.ru/xxyqvr
20. Clinical and Laboratory Standards Institute (CLSI). https://clsi.org
21. European Committee on Antimicrobial Susceptibility Testing ( EUCAST). https://www.eucast.org
22. Ahmed H. A., El Bayomi R. M., Hamed R. I., Mohsen R. A., El- Gohary F. A., Hefny A. A., et al. Genetic relatedness, antibiotic resistance, and effect of silver nanoparticle on biofilm formation by Clostridium perfringens isolated from chickens, pigeons, camels, and human consumers. Veterinary Sciences. 2022; 9 (3):109. https://doi.org/10.3390/vetsci9030109
23. Khademi F., Sahebkar A. The prevalence of antibiotic-resistant Clostridium species in Iran: a meta-analysis. Pathogens and Global Health. 2019; 113 (2): 58–66. https://doi.org/10.1080/20477724.2019.1603003
24. Khan M. U. Z., Humza M., Yang S., Iqbal M. Z., Xu X., Cai J. Evaluation and optimization of antibiotics resistance profile against Clostridium perfringens from buffalo and cattle in Pakistan. Antibiotics. 2021; 10 (1):59. https://doi.org/10.3390/antibiotics10010059
25. Kouassi K. A., Dadie A. T., N’Guessan K. F., Dje K. M., Loukou Y. G. Clostridium perfringens and Clostridium difficile in cooked beef sold in Côte d’Ivoire and their antimicrobial susceptibility. Anaerobe. 2014; 28: 90–94. https://doi.org/10.1016/j.anaerobe.2014.05.012
26. Jang Y.-S., Kim D.-H., Bae D., Kim S.-H., Kim H., Moon J.-S., et al. Prevalence, toxin-typing, and antimicrobial susceptibility of Clostridium perfringens from retail meats in Seoul, Korea. Anaerobe. 2020; 64:102235. https://doi.org/10.1016/j.anaerobe.2020.102235
Об авторах
П. Н. ШастинРоссия
Шастин Павел Николаевич, канд. вет. наук, старший научный сотрудник лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
В. А. Савинов
Россия
Савинов Василий Александрович, канд. биол. наук, старший научный сотрудник лаборатории микологии и антибиотиков им. А. Х. Саркисова,
Рязанский проспект, 24/1, г. Москва, 109428.
А. И. Лаишевцев
Россия
Лаишевцев Алексей Иванович, канд. биол. наук, ведущий научный сотрудник, и. о. заведующего лабораторией диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
Е. Д. Мандрыка
Россия
Мандрыка Екатерина Дмитриевна, микробиолог лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
Е. А. Фабрикантова
Россия
Фабрикантова Елизавета Алексеевна, микробиолог лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
А. В. Супова
Россия
Супова Анастасия Владимировна, научный сотрудник лаборатории диагностики и контроля антибиотикорезистентности возбудителей наиболее клинически значимых инфекционных болезней животных,
Рязанский проспект, 24/1, г. Москва, 109428.
Рецензия
Для цитирования:
Шастин П.Н., Савинов В.А., Лаишевцев А.И., Мандрыка Е.Д., Фабрикантова Е.А., Супова А.В. Видовое разнообразие клостридий у крупного рогатого скота. Ветеринария сегодня. 2025;14(2):194-200. https://doi.org/10.29326/2304-196X-2025-14-2-194-200
For citation:
Shastin P.N., Savinov V.A., Laishevtsev A.I., Mandryka E.D., Fabrikantova E.A., Supova A.V. Clostridium species diversity in cattle. Veterinary Science Today. 2025;14(2):194-200. https://doi.org/10.29326/2304-196X-2025-14-2-194-200



































