Перейти к:
Индикация биопленок изолятов Escherichia coli, Escherichia albertii, Proteus vulgaris, идентифицированных при болезнях органов дыхания и пищеварения птиц
https://doi.org/10.29326/2304-196X-2025-14-2-186-193
Аннотация
Введение. При снижении компенсаторных механизмов резистентности организма, изменении состава эволюционно сложившихся микробиоценозов избыточному росту патогенных микроорганизмов способствует репрезентация сигнальных молекул quorum sensing. Антибактериальный потенциал ингибиторов синтеза молекул межклеточных коммуникаций достигается за счет снижения адгезии микроорганизмов, а соответственно, и степени контаминации in vivo и in vitro.
Цель исследования. Изучение динамики изменений морфометрических и денситометрических показателей биопленок изолятов Escherichia coli, Escherichia albertii, Proteus vulgaris, идентифицированных при болезнях органов дыхания и пищеварения птиц.
Материалы и методы. Исследовали динамику развития биопленок референтных штаммов и изолятов, выделенных из патматериала птицы: куры кросса ROSS-308 40–42-недельного возраста (n = 20). Оптическую плотность исследуемых образцов определяли с применением фотометрического анализатора Immunochem-2100 (HTI, США), длина волны 580 нм (OD580). Морфометрические показатели учитывали при достоверной частоте встречаемости ≥ 90,0% поля зрения оптического микроскопа H604 Trinocular Unico (United Рroducts & Instruments Inc., США) и сканирующего электронного микроскопа Hitachi TM3030 Plus (Hitachi, Япония).
Результаты. Из патматериала птиц с признаками катарально-геморрагического аэросаккулита, геморрагического энтерита, фибринозного полисерозита и спленомегалии были выделены и идентифицированы Escherichia coli, Escherichia albertii, Proteus vulgaris. В зависимости от времени культивирования установлены прямые коррелятивные зависимости (r = 0,91) между морфометрическими и денситометрическими показателями. При дисперсии гетерогенной популяции доминируют клетки с дефектной клеточной стенкой, сферопласты, игольчатые и гигантские структуры, а также клетки-ревертанты.
Заключение. Общие закономерности динамики развития гетерогенной популяции микроорганизмов опосредованы адгезией, синтезом экзоцеллюлярных молекул, интенсивной пролиферацией и дифференциацией клеток в зависимости от стадии клеточного цикла.
Ключевые слова
Для цитирования:
Ленченко Е.М., Пономарев В.В., Сачивкина Н.П. Индикация биопленок изолятов Escherichia coli, Escherichia albertii, Proteus vulgaris, идентифицированных при болезнях органов дыхания и пищеварения птиц. Ветеринария сегодня. 2025;14(2):186-193. https://doi.org/10.29326/2304-196X-2025-14-2-186-193
For citation:
Lenchenko E.M., Ponomarev V.V., Sachivkina N.P. Identification of Escherichia coli, Escherichia albertii, Proteus vulgaris biofilms detected in poultry with respiratory and gastrointestinal diseases. Veterinary Science Today. 2025;14(2):186-193. https://doi.org/10.29326/2304-196X-2025-14-2-186-193
ВВЕДЕНИЕ
При глобализации распространения новых нозологических форм, а также известных вариантов форм, характеризующихся высокими эпидемиологическими показателями, наблюдается статистически достоверная тенденция возрастания инцидентности инфекций, обусловленных антибиотикорезистентными бактериями порядка Enterobacterales [1][2][3][4]. Из-за множественной лекарственной устойчивости указанные бактерии причислены к первой категории критического уровня приоритетности для исследований согласно перечню патогенов WHO Bacterial Priority Pathogens List (2024) [5].
Клинические изоляты Escherichia coli, идентифицированные при септицемии, неонатальных менингитах, уропатологии человека, имеют генетическое сходство и общие черты генов вирулентности с птичьими патогенными E. coli – APEC (Avian pathogenic E. coli) [6][7].
Концентрация популяции на ограниченных площадях, комплектование хозяйств животными одного вида и возраста, применение антибиотиков, а также частая смена схемы вакцинации, в том числе применение вакцин, изготовленных на основе «горячих» и вариантных штаммов, способствуют широкому распространению инфекционных болезней [8]. По статистическим данным ветеринарной отчетности, колибактериоз регистрируется повсеместно, нанося значительный экономический ущерб [9][10]. При развитии генерализованной инфекции у птиц доминирование этиологической значимости E. coli составляет от 50,7 до 100% в зависимости от эпизоотической ситуации на птицефабриках различного технологического направления, в крестьянско-фермерских и личных подсобных хозяйствах [11][12]. Маркером множественной резистентности APEC является формирование устойчивости к различным классам антибиотиков, в том числе и к социально значимым: колистину, карбапенемам, β-лактамам [13][14][15][16].
Реализация патогенных свойств E. coli обеспечивается факторами вирулентности, кодируемыми хромосомными, плазмидными генами и интегрированными в хромосому бактериофагами [17][18]. При снижении компенсаторных механизмов мукоцилиарного клиренса и колонизационной резистентности кишечника, изменении количественного и видового состава микробиоценозов репрезентация сигнальных молекул quorum sensing (QS) способствует избыточному росту патогенных микроорганизмов [19]. Терапевтический и дезинфицирующий потенциал ингибиторов QS за счет блокировки синтеза молекул межклеточных коммуникаций позволяет снизить адгезию микроорганизмов, а соответственно, и степень контаминации in vivo и in vitro [20][21].
Для раскрытия патогенетических аспектов инициации, развития и исхода инфекционной патологии птицы, характеризующихся избыточным ростом и диссеминацией патогенных энтеробактерий, приоритетность представляют исследования этиологической структуры респираторных и желудочно-кишечных болезней птицы. Изучение общих закономерностей многоуровневых алгоритмов дифференциации гетерогенной популяции, в том числе и жизнеспособных некультивируемых клеток, будут способствовать оптимизации длительной ретроспективной идентификации убиквитарных бактерий, а также в перспективе – разработке способов эрадикации биопленок.
Цель работы – изучить динамику изменений морфометрических и денситометрических показателей биопленок изолятов E. coli, Escherichia albertii, Proteus vulgaris, идентифицированных при болезнях органов дыхания и пищеварения птиц.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы. В опытах использовали изоляты, выделенные из патматериала птицы – кур кросса ROSS-308, возраст – 40–42 нед. (n = 20). В качестве контроля использовали референтный штамм Escherichia coli ATCC 25922 из коллекции Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов имени Л. А. Тарасевича (г. Москва) [22].
Питательные среды: среда Эндо, висмут-сульфидный агар (ВСА; HiMedia, Индия), мясо-пептонный бульон (МПБ), мясо-пептонный агар (МПА), среда Гисса, кровяной агар, среда Олькеницкого, цитратный агар Симмонса (ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии», Россия), Tryptone Bile X-glucuronide agar, Chromocult® Coliform Agar (Merck, Германия).
Тест-системы: «Системы индикаторные бумажные для идентификации микроорганизмов. Набор № 2 для межродовой и видовой дифференциации энтеробактерий» (АО «НПО «Микроген», Россия); «Пластина биохимическая, дифференцирующая энтеробактерии (ПБДЭ)» (ООО «НПО «Диагностические системы», Россия); ENTERO-Rapid 24, NEFERMtest 24 (Erba Lachema s.r.o., Чехия).
Патолого-анатомические исследования проводили при полном вскрытии трупов кур (n = 20), направленных из птицеводческих хозяйств Центрально-Черноземного региона Российской Федерации для бактериологического исследования в Белгородский филиал ФГБУ «ВНИИЗЖ». Опыты выполняли в соответствии с «Методическими указаниями по патоморфологической диагностике болезней животных, птиц и рыб в ветеринарных лабораториях», утвержденными Департаментом ветеринарии Минсельхоза России 11.09.2000 № 13-7-2/2137 [23]. При патолого-анатомическом исследовании применяли общепринятые методы, учитывая анатомо-топографические особенности птиц [24][25][26].
Микробиологические исследования проводили в соответствии с «Методическими указаниями по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями», утвержденными Департаментом ветеринарии Минсельхозпрода России 11.10.1999 № 13-7-2/1759; «Методическими указаниями по бактериологической диагностике колибактериоза (эшерихиоза) животных», утвержденными Департаментом ветеринарии Минсельхозпрода России 27.07.2000 № 13-7-2/2117; методическими рекомендациями «Выделение и идентификация бактерий желудочно-кишечного тракта животных», утвержденными Департаментом ветеринарии Минсельхоза России 11.05.2004 № 13-5-02/1043 [27][28][29].
Авторы подтверждают соблюдение институциональных и национальных стандартов в соответствии с Consensus Author Guidelines for Animal Use (IAVES, 23 July 2010). Протокол исследования одобрен этическим комитетом РУДН, г. Москва, Россия (протокол от 08.10.2024 № 9а/3).
Для количественного учета микроорганизмов исследовали содержимое тонкого отдела и слепых отростков кишечника. Образцы массой 1,0 г помещали в пробирки и добавляли 9,0 см³ 0,85%-го раствора хлорида натрия. Из диагностически значимых разведений 0,1 мл анализируемого образца наносили на поверхность дифференциально-диагностических сред.
Исследуемый патматериал (сердце с перевязанными сосудами, легкие, трубчатую кость, печень с желчным пузырем, селезенку) пастеровской пипеткой наносили на среднюю часть чашки Петри и равномерно растирали стеклянным шпателем. При исследовании тонкого отдела кишечника содержимое удаляли, тщательно соскабливали слизистую оболочку с помощью скарифицирующего конуса пастеровской пипетки и вносили материал на поверхность среды. Во избежание роста роящихся бактерий перед посевами материала поверхность среды Эндо орошали 96%-м этиловым спиртом (1–2 см³). Микроорганизмы культивировали при (37 ± 1) °C в течение (24 ± 1) и (48 ± 1) ч. Для выделения чистых культур микроорганизмов бактерий рода Proteus проводили посевы по Щукевичу в конденсационную жидкость свежескошенного МПА и культивировали при (37 ± 1) °C в течение (24 ± 1) ч. При наличии роста микроорганизмы пересевали на среду ВСА и культивировали при (37 ± 1) °C в течение (24 ± 1) и (48 ± 1) ч [24][27][28].
Для видовой идентификации три типичные для вида колонии микроорганизмов пересевали в пробирки со скошенным МПА и культивировали при (37 ± 1) °C в течение (24 ± 1) ч. Изучение морфологических, культуральных и биохимических свойств микроорганизмов проводили общепринятыми методами [1][27][28][29].
Исследование биопленок. Для учета денситометрических показателей исследуемые образцы вносили в лунки 96-луночного планшета (АО «Фирма Медполимер», Россия), культивировали в статических аэробных условиях при (37 ± 1) °C в течение 6, 18, 24, 48 ч. По истечении указанного времени жидкость из лунок планшетов удаляли, осадок трижды промывали 200 мкл фосфатно-буферного раствора (рН 7,2). На каждой стадии промывки производили перемешивание при 2000 об/мин в течение 10 мин с использованием вихревого шейкера MixMate (Eppendorf, Германия). Фиксацию образцов проводили 96%-м этанолом в течение 15 мин, подсушивали при (37 ± 1) °C в течение 20 мин. Затем в лунки вносили 0,5%-й раствор красителя кристаллического фиолетового (HiMedia Laboratories Pvt. Ltd., Индия), культивировали при (37 ± 1) °C в течение 5 мин. Содержимое лунок удаляли, трижды промывали 200 мкл фосфатно-буферного раствора (рН 7,3), подсушивали. Краситель элюировали 200 мкл 96%-го этилового спирта в течение 30 мин [30][31]. Оптическую плотность образцов определяли с применением фотометрического анализатора ImmunoChem-2100 (HTI, США) при длине волны 580 нм (OD580).
Для морфометрических исследований препараты фиксировали смесью спирта и эфира (1:1) в течение 10 мин и окрашивали водным раствором генцианвиолета 1:2000 и по Граму (BioVitrum, Россия). Для сканирующей электронной микроскопии препараты фиксировали парами 25%-го раствора глутарового альдегида в течение 8 ч, а затем парами 1%-го раствора тетраоксида осмия в течение 4 ч. Уплотнение исследуемых образцов проводили этанолом возрастающей концентрации: 30, 50, 96, 100%. Затем образцы подвергали воздействию ионов золота с применением аппарата Q150T ES (Quorum Technologies Ltd., Великобритания). Морфометрические показатели учитывали при достоверной частоте встречаемости ≥ 90,0% поля зрения оптического микроскопа H604 Trinocular Unico (United Рroducts & Instruments Inc., США) и сканирующего электронного микроскопа Hitachi TM3030 Plus (Hitachi, Япония).
Результаты исследований обрабатывали методом статистического анализа с использованием критерия Стьюдента, результаты считали достоверными при р ≤ 0,05 [19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Патолого-анатомические исследования. При патолого-анатомическом вскрытии трупов кур кросса ROSS-308, возраст – 40–42 недели (n = 20), наблюдали, что перьевой покров всех исследованных птиц был тусклый и взъерошенный. Трупы кур были истощены. Выявляли цианоз слизистых оболочек, неравномерное и резкое вздутие желудка, тонкого отдела и слепых отростков кишечника. Множественные точечные и полосчатые кровоизлияния отмечены в мышцах и слизистых оболочках трахеи, желудка и кишечника. Острая застойная гиперемия органов сердечно-сосудистой системы характеризовалась переполнением кровью кровеносных сосудов, скоплением отечной жидкости рыхлой соединительной неоформленной ткани, гемолизом эритроцитов. Выявляли признаки катарально-геморрагического аэросаккулита, спленомегалии, геморрагического энтерита и фибринозного полисерозита (рис. 1).
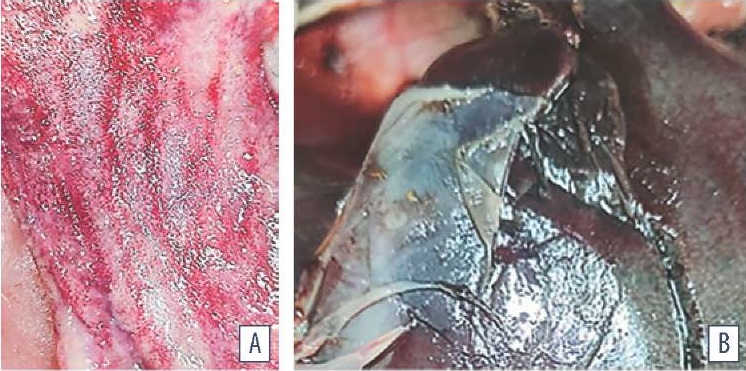
Рис. 1. Патолого-анатомические признаки болезней органов пищеварения птицы: A – множественные кровоизлияния в слизистой оболочке кишечника; B – перигепатит
Fig. 1. Postmortem gastrointestinal lesions in poultry: A – multiple hemorrhages in intestinal mucosa; B – perihepatitis
Индикация и идентификация микроорганизмов. При посеве исследуемого материала на поверхность дифференциально-диагностических питательных сред, предназначенных для первичной идентификации, бактерии формировали круглые колонии с гладкой выпуклой поверхностью, ровными краями, диаметром 1,5–2,5 мм.
На среде Эндо ферментирующие лактозу микроорганизмы формировали красного цвета колонии, часть которых были с характерным металлическим блеском. Количество колоний, выросших при посеве содержимого тонкого кишечника, составило (1,43 ± 0,25) × 10⁶ КОЕ/г; слепых отростков кишечника – (4,6 ± 0,32) × 10⁷ КОЕ/г. Наряду с указанными бактериями из содержимого тонкого кишечника птиц были выявлены не ферментирующие лактозу микроорганизмы, количество бесцветных в центре с розовым оттенком колоний было равно (0,85 ± 0,34) × 10⁴ КОЕ/г (рис. 2A).
При посеве по Щукевичу в конденсационную жидкость свежескошенного МПА выявили наличие роста микроорганизмов. Пересеянные из МПА культуры на среде ВСА формировали темно-зеленые колонии, вокруг которых наблюдали редукционную зону, количество колоний составило (0,77 ± 0,87) × 10³ КОЕ/г (рис. 2B).
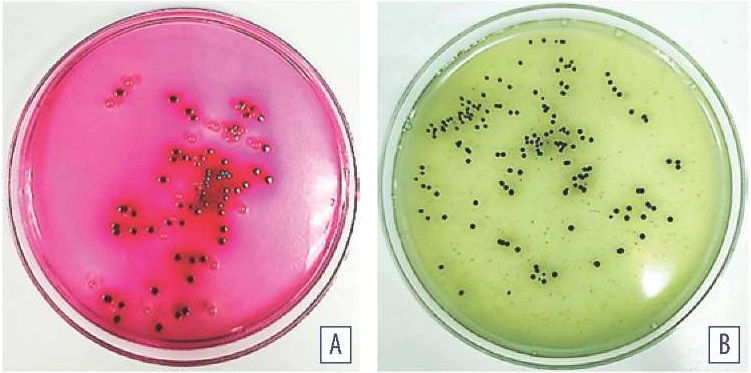
Рис. 2. Культуры микроорганизмов, выделенные из содержимого тонкого кишечника кур: A – среда Эндо, культивирование при (37 ± 1) °С в течение 24 ч; B – среда ВСА, культивирование при (37 ± 1) °C в течение (24 ± 1) ч
Fig. 2. Microorganism cultures isolated from chicken small intestine contents: A – Endo medium, cultivation at (37 ± 1) °С for 24 hours; B – bismuth sulfite agar, cultivation at (37 ± 1) °С for (24± 1) hours
При изучении морфологических, тинкториальных, биохимических свойств чистых культур микроорганизмов, выделенных из патматериала всех исследованных птиц (100%), были идентифицированы грамотрицательные, факультативно-анаэробные, оксидазоотрицательные, каталазоположительные изоляты E. coli. В пробах содержимого тонкого кишечника 16 птиц (80%) выявлена монокультура E. coli. В образцах тонкого кишечника 4 птиц (20%) наряду с E. coli обнаружены бактерии E. albertii, P. vulgaris.
Морфологические и денситометрические показатели биопленок. При (37 ± 1) °C в течение 6, 18, 24, 48 ч в статических аэробных условиях культивирования выявляли общие закономерности развития и формирования биопленок изолятами E. coli, E. albertii, P. vulgaris, независимо от источника выделения. Изменения значений абсолютных величин оптической плотности исследуемых образцов и интенсивность формирования биопленок представлены в таблице.
Таблица
Денситометрические показатели биопленок
Table
Densitometric parameters of biofilms
|
Время культивирования образцов, ч |
Абсолютная величина оптической плотности |
Интенсивность формирования биопленок |
|
6 |
(0,102 ± 0,04) – (0,111 ± 0,06) |
≥ 0,1–0,2 |
|
18 |
(0,172 ± 0,07) – (0,191 ± 0,05) |
≥ 0,1–0,2 |
|
24 |
(0,246 ± 0,03) – (0,284 ± 0,08) |
≥ 0,2–0,3 |
|
48 |
(0,348 ± 0,07) – (0,526 ± 0,18) |
≥ 0,3–0,4 |
В зависимости от времени культивирования установлены прямые коррелятивные зависимости (r = 0,91) между интенсивностью денситометрических показателей и возрастанием достоверной частоты визуализации коагрегации бактерий, объединенных межклеточным матриксом.
При репрезентативной выборке ≥ 90,0% поля зрения микроскопа дифференцировали стадии образования биопленок: адгезия, фиксация, микроколония, рост, дисперсия. На начальных этапах развития за счет кондиционирования выявляли сорбцию, неспецифическую адгезию микроорганизмов к поверхности исследуемого субстрата – стекла. Причем клетки могут на данном этапе как прикрепиться к поверхности субстрата, так и открепиться, переходя вновь в планктонную фазу развития. Межмолекулярные взаимодействия специализированных структур клеточной стенки микроорганизмов обеспечивают необратимую адгезию – фиксацию бактерий. Прикрепившиеся прочно к поверхности субстрата микроорганизмы способствовали адгезии последующих клеток. В зависимости от стадий клеточного цикла дифференцировали клетки разной формы и размеров, объединенные межклеточным матриксом (рис. 3).
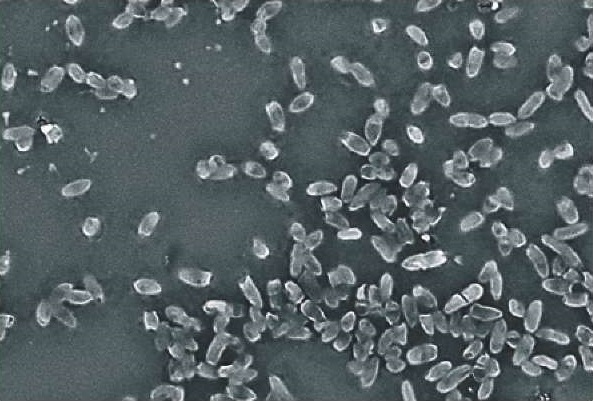
Рис. 3. Морфология биопленки E. coli (среда МПБ; культивирование при (37 ± 1) °C в течение 18 ч; Hitachi TM3030 Plus, Япония)
Fig. 3. E. coli biofilm morphology (meat peptone broth (MPB) medium; cultivation at (37 ± 1) °C for 18 hours; Hitachi TM3030 Plus, Japan)
В процессе интенсивной пролиферации клеток, синтезирующих экзоцеллюлярные молекулы, формировались кластеры (скопления, конгломераты), развивающиеся за счет бинарного деления бактерий. Между кластерами упорядоченно и вместе с тем разнонаправленно расположенных клеток выявляли округлой формы структуры – каналы, содержащие жидкость, обеспечивающие гидратацию популяции. При увеличении численности прикрепившихся делящихся клеток и, соответственно, достоверном возрастании синтеза экзоцеллюлярных компонентов межклеточный матрикс уплотнялся. При окраске анилиновыми красителями со свойствами метахромазии, в зависимости от химического состава, дифференцировали компоненты матрикса: белковые структуры – синий цвет, полисахариды – розовый цвет (рис. 4).
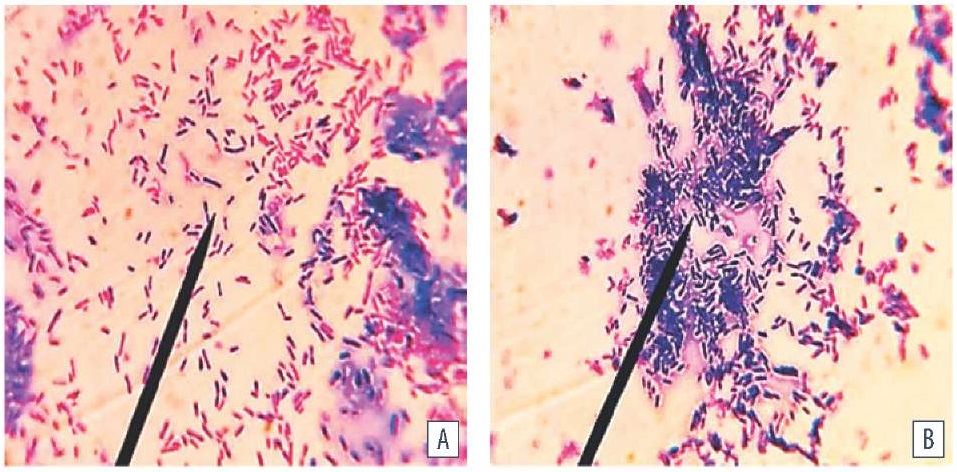
Рис. 4. Морфология биопленки E. coli (среда МПБ, температура (37 ± 1) °C, время культивирования: A –18 ч, B – 24 ч; окраска по Граму; ок. 10×, об. 100×, иммерсия, H604 Trinocular Unico, США)
Fig. 4. E. coli biofilm morphology (MPB medium, temperature (37 ± 1) °C, cultivation period: A –18 hours, B – 24 hours; Gram staining; оc. 10×, obj. 100×, immersion, H604 Trinocular Unico, USA)
При реализации механизмов межклеточной коммуникации QS за счет увеличения численности популяции, степени развития межклеточного матрикса происходит иммобилизация популяции зрелой трехмерной гетероморфной биопленки. По мере увеличения времени культивирования возрастала дисперсия (распад) гетероморфной популяции. Наряду с типичными для вида клетками выявляли бактерии, характерные для L-трансформации. Доминирующими были клетки с дефектной клеточной стенкой, сферопласты, игольчатые и гигантские структуры, а также клетки, способные к реверсии в исходное фенотипическое и метаболическое состояние. Деструкция, частичный или полный автолиз клеток, утрачивающих типичные морфофункциональные признаки (некультивируемые клетки), сопровождались увеличением светопреломления и снижением оптической плотности биопленки (рис. 5).
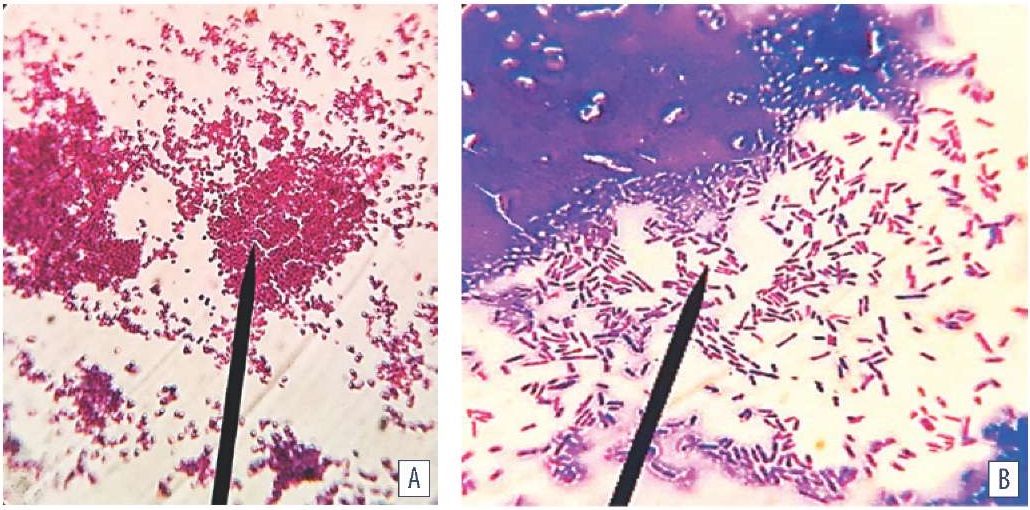
Рис. 5. Морфология биопленки: A – E. albertii; B – E. coli (среда МПБ; культивирование при (37 ± 1) °C в течение 48 ч; окраска по Граму; ок. 10×, об. 100×, иммерсия, H604 Trinocular Unico, США)
Fig. 5. Biofilm morphology: A – E. albertii; B – E. coli (MPB medium; cultivation at (37 ± 1) °C for 48 hours; Gram staining; oc. 10×, obj. 100×, immersion, H604 Trinocular Unico, USA)
При развитии синдрома избыточного роста микроорганизмов их патогенный потенциал реализуется за счет транскрипционного контроля адгезии, инвазии, синтеза полимерных молекул [32][33]. Молекулы QS рассматриваются как перспективные мишени при разработке препаратов, значительно снижающих адгезию APEC и ингибирующих экспрессию противовоспалительных цитокинов [34][35].
Результаты исследований динамики развития биопленок будут способствовать оптимизации способов микробиологического мониторинга критических точек технологии птицеводства, а также могут быть использованы при разработке лекарственных и дезинфицирующих препаратов, блокирующих синтез молекул межклеточной коммуникации.
ЗАКЛЮЧЕНИЕ
При (37 ± 1,0) °C в течение 6, 18, 24, 48 ч в статических аэробных условиях культивирования выявляли общие закономерности развития и формирования биопленок изолятов E. coli, E. albertii, P. vulgaris. Инициация и развитие биопленки – особая форма межклеточной коммуникации QS, представляющая собой многоэтапный процесс дифференциации единичных подвижных планктонных микроорганизмов и адгезированных популяций клеток. Общей закономерностью динамики развития гетерогенной популяции микроорганизмов, опосредованной адгезией, интенсивной пролиферацией клеток, синтезом экзоцеллюлярных молекул, является коагрегация гетероморфных клеток разных размеров и форм в зависимости от стадии клеточного цикла. При дисперсии гетероморфной популяции доминирующими были бактерии, характерные для L-трансформации. Наряду с клетками, типичными для вида, дифференцировались сферопласты, игольчатые и гигантские структуры, а также клетки, способные к реверсии в исходное фенотипическое и метаболическое состояние.
Вклад авторов: Авторы внесли равный вклад в проведение исследования: сбор и анализ материала; определение целей и задач, методов исследования; формулирование и научное обоснование выводов; оформление ключевых результатов исследования в виде статьи.
Contribution of the authors: The authors contributed to the study equally: data collection and analysis; determination of the study goals, tasks and methods; conclusion formulation and scientific justification; presentation of the key study results as the paper.
Список литературы
1. Janda J. M., Abbott S. L. The changing face of the family Enterobacteriaceae (Order: “Enterobacterales”): new members, taxonomic issues, geographic expansion, and new diseases and disease syndromes. Clinical Microbiology Reviews. 2021; 34 (2):e00174-20. https://doi.org/10.1128/cmr.00174-20
2. Mirzaei A., Nasr Esfahani B., Ghanadian M., Moghim S. Alhagi maurorum extract modulates quorum sensing genes and biofilm formation in Proteus mirabilis. Scientific Reports. 2022; 12 (1):13992. https://doi.org/10.1038/s41598-022-18362-x
3. Muchaamba F., Barmettler K., Treier A., Houf K., Stephan R. Microbiology and epidemiology of Escherichia albertii – an emerging elusive foodborne pathogen. Microorganisms. 2022; 10 (5):875. https://doi.org/10.3390/microorganisms10050875
4. Hirose S., Konishi N., Sato M., Suzumura K., Obata H., Ohtsuka K., et al. Growth and survival of Escherichia albertii in food and environmental water at various temperatures. Journal of Food Protection. 2024; 87 (4):100249. https://doi.org/10.1016/j.jfp.2024.100249
5. WHO bacterial priority pathogens list, 2024: Bacterial pathogens of public health importance to guide research, development and strategies to prevent and control antimicrobial resistance. Geneva: WHO; 2024. https://www.who.int/publications/i/item/9789240093461
6. Khairullah A. R., Afnani D. A., Riwu K. H. P., Widodo A., Yanestria S. M., Moses I. B., et al. Avian pathogenic Escherichia coli: Epidemiology, virulence and pathogenesis, diagnosis, pathophysiology, transmission, vaccination, and control. Veterinary World. 2024; 17 (12): 2747–2762. https://doi.org/10.14202/vetworld.2024.2747-2762
7. Nawaz S., Wang Z., Zhang Y., Jia Y., Jiang W., Chen Z., et al. Avian pathogenic Escherichia coli (APEC): current insights and future challenges. Poultry Science. 2024; 103 (12):104359. https://doi.org/10.1016/j.psj.2024.104359
8. Джавадов Э. Д., Новикова О. Б., Красков Д. А., Березкин В. А. Болезни птиц, вызываемые условно-патогенной микрофлорой. Эффективное животноводство. 2023; (6): 8–12. https://doi.org/10.24412/cl-33489-2023-6-8-12
9. Герасимова А. О., Новикова О. Б., Савичева А. А. Колибактериоз птиц – актуальные вопросы. Ветеринария сегодня. 2023; 12 (4): 284–292. https://doi.org/10.29326/2304-196X-2023-12-4-284-292
10. Курмакаева Т. В., Козак С. С., Баранович Е. С. К вопросу о заболеваемости птицы отдельными бактериальными болезнями и обеспечение биобезопасности. Ветеринария сегодня. 2024; 13 (2): 171–176. https://doi.org/10.29326/2304-196X-2024-13-2-171-176
11. Макавчик С. А., Смирнова Л. И., Сухинин А. А., Кузьмин В. А. Видовое разнообразие доминирующих этиологически значимых бактерий, циркулирующих в промышленном птицеводстве Международный вестник ветеринарии. 2022; (1): 22–26. https://doi.org/10.52419/issn2072-2419.2022.1.22
12. Тамбиев Т. С., Тамбиева Ю. Г., Дулетов Е. Г., Федоров В. Х., Тазаян А. Н., Федюк В. В., Шлычков А. Е. Антимикробная активность фитогенных препаратов в отношении условно-патогенной микрофлоры кишечника кур. Актуальные вопросы ветеринарной биологии. 2023; (2): 27–31. https://doi.org/10.24412/2074-5036-2023-2-27-31
13. Панкратов С. В., Рождественская Т. Н., Сухинин А. А., Рузина А. В. Респираторный синдром птиц. Этиология, диагностика, меры борьбы и профилактики. Птица и птицепродукты. 2021; (4): 34–36. https://elibrary.ru/tfcyys
14. Исакова М. Н., Соколова О. В., Безбородова Н. А., Кривоногова А. С., Исаева А. Г., Зубарева В. Д. Антибиотикорезистентность клинических изолятов Escherichia coli, выделенных от животных. Ветеринария сегодня. 2022; 11 (1): 14–19. https://doi.org/10.29326/2304196X-2022-11-1-14-19
15. Конищева А. С., Лещева Н. А., Плешакова В. И. Микробиологический спектр возбудителей при желудочно-кишечной патологии у животных. Вестник КрасГАУ. 2022; (2): 106–112. https://doi.org/10.36718/1819-4036-2022-2-106-112
16. Прунтова О. В., Русалеев В. С., Шадрова Н. Б. Современное представление о механизмах антимикробной резистентности бактерий (аналитический обзор). Ветеринария сегодня. 2022; 11 (1): 7–13. https://doi.org/10.29326/2304-196X-2022-11-1-7-13
17. Пирожков М. К., Галиакбарова А. А., Пименов Н. В. Современное состояние отечественного рынка вакцинопрепаратов против колибактериоза животных. Ветеринария, зоотехния и биотехнология. 2022; (2): 12–20. https://elibrary.ru/chvpjh
18. Светоч Э. А., Ерусланов Б. В., Мицевич И. П., Храмов М. В., Перескокова Е. С., Карцев Н. Н., Фурсова Н. К. Алгоритм разработки и характеристика диагностических латексных тест-систем, производимых в Государственном научном центре прикладной микробиологии и биотехнологии (часть 2). Бактериология. 2023; 8 (3): 56–67. https://obolensk.org/bacteriology/archive-numbers/item/453-svetoch2023-8-3-p56-67
19. Lenchenko E., Sachivkina N., Lobaeva T., Zhabo N., Avdonina M. Bird immunobiological parameters in the dissemination of the biofilm-forming bacteria Escherichia coli. Veterinary World. 2023; 16 (5): 1052–1060. https:// doi.org/10.14202/vetworld.2023.1052-1060
20. Peng L.-Y., Yuan M., Wu Z.-M., Song K., Zhang C.-L., An Q., et al. Anti- bacterial activity of baicalin against APEC through inhibition of quorum sensing and inflammatory responses. Scientific Reports. 2019; 9 (1):4063. https://doi.org/10.1038/s41598-019-40684-6
21. Sachivkina N., Vasilieva E., Lenchenko E., Kuznetsova O., Karamyan A., Ibragimova A., et al. Reduction in pathogenicity in yeast-like fungi by farnesol in quail model. Animals. 2022; 12 (4):489. https://doi.org/10.3390/ani12040489
22. ATCC: The Global Bioresource Center. https://www.atcc.org/products/25922
23. Методические указания по патоморфологической диагностике болезней животных, птиц и рыб в ветеринарных лабораториях: утв. Департаментом ветеринарии Минсельхоза России 11.09.2000 № 13-7-2/2137. https://base.garant.ru/71878976
24. Иллюстрированный атлас болезней птиц. Ред. Б. Ф. Бессарабов. М.: Медол; 2006. 247 с.
25. Волков М. С., Ирза В. Н., Варкентин А. В., Роголев С. В., Андриясов А. В. Результаты научной экспедиции в природные биотопы Республики Тыва в 2019 году для проведения мониторинга инфекционных болезней в популяциях диких птиц. Ветеринария сегодня. 2020; (2): 83–88. https://doi.org/10.29326/2304-196X-2020-2-33-83-88
26. Громов И. Н. Патоморфологическая и дифференциальная диагностика болезней птиц, протекающих с преимущественным поражением кишечника. Животноводство и ветеринарная медицина. 2020; (2): 27–31. https://elibrary.ru/ofnxlc
27. Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных: утв. Департаментом ветеринарии Минсельхозпрода России 27.07.2000 № 13-7-2/2117. https://docs.cntd.ru/document/555906594
28. Выделение и идентификация бактерий желудочно-кишечного тракта животных: методические рекомендации: утв. Департаментом ветеринарии Минсельхоза России 11.05.2004 № 13-5-02/1043. http://gost.gtsever.ru/Data2/1/4293723/4293723844.pdf
29. Методические указания по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями: утв. Департаментом ветеринарии Минсельхозпрода России 11.10.1999 № 13-7-2/1759. https://base.garant.ru/71987758
30. Carter M. Q., Carychao D., Lindsey R. L. Conditional expression of flagellar motility, curli fimbriae, and biofilms in Shiga toxin-producing Escherichia albertii. Frontiers in Microbiology. 2024; 15:1456637. https://doi.org/10.3389/fmicb.2024.1456637
31. Lenchenko E., Sachivkina N., Petrukhina O., Petukhov N., Zharov A., Zhabo N., Avdonina M. Anatomical, pathological, and histological features of experimental respiratory infection of birds by biofilm-forming bacteria Staphylococcus aureus. Veterinary World. 2024; 17 (3): 612–619. https://doi.org/10.14202/vetworld.2024.612-619
32. Robé C., Blasse A., Merle R., Friese A., Roesler U., Guenther S. Low dose colonization of broiler chickens with ESBL-/AmpC-producing Escherichia coli in a seeder-bird model independent of antimicrobial selection pressure. Frontiers in Microbiology. 2019; 10:2124. https://doi.org/10.3389/fmicb.2019.02124
33. Lenchenko E., Lozovoy D., Strizhakov A., Vatnikov Yu., Byakhova V., Kulikov E., et al. Features of formation of Yersinia enterocolitica biofilms. Veterinary World. 2019; 12 (1): 136–140. https://doi.org/10.14202/vetworld.2019.136-140
34. Sivaranjani M., McCarthy M. C., Sniatynski M. K., Wu L., Dillon J. R., Rubin J. E., White A. P. Biofilm formation and antimicrobial susceptibility of E. coli associated with colibacillosis outbreaks in broiler chickens from Saskatchewan. Frontiers in Microbiology. 2022; 13:841516. https://doi.org/10.3389/fmicb.2022.841516
35. Helmy Y. A., Kathayat D., Deblais L., Srivastava V., Closs G. Jr., Tokarski R. J., et al. Evaluation of novel quorum sensing inhibitors targeting auto-inducer 2 (AI-2) for the control of avian pathogenic Escherichia coli infections in chickens. Microbiology Spectrum. 2022; 10 (3):e00286-22. https://doi.org/10.1128/spectrum.00286-22
Об авторах
Е. М. ЛенченкоРоссия
Ленченко Екатерина Михайловна, д-р вет. наук, профессор кафедры ветеринарной медицины,
Волоколамское шоссе, 11, г. Москва, 125080.
В. В. Пономарев
Россия
Пономарев Владислав Владимирович, аспирант кафедры ветеринарной медицины,
Волоколамское шоссе, 11, г. Москва, 125080.
Н. П. Сачивкина
Россия
Сачивкина Надежда Павловна, канд. биол. наук, доцент департамента ветеринарной медицины Аграрно-технологического института,
ул. Миклухо-Маклая, 6, г. Москва, 117198.
Рецензия
Для цитирования:
Ленченко Е.М., Пономарев В.В., Сачивкина Н.П. Индикация биопленок изолятов Escherichia coli, Escherichia albertii, Proteus vulgaris, идентифицированных при болезнях органов дыхания и пищеварения птиц. Ветеринария сегодня. 2025;14(2):186-193. https://doi.org/10.29326/2304-196X-2025-14-2-186-193
For citation:
Lenchenko E.M., Ponomarev V.V., Sachivkina N.P. Identification of Escherichia coli, Escherichia albertii, Proteus vulgaris biofilms detected in poultry with respiratory and gastrointestinal diseases. Veterinary Science Today. 2025;14(2):186-193. https://doi.org/10.29326/2304-196X-2025-14-2-186-193
JATS XML



































