Перейти к:
Изучение антигенных свойств вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак
https://doi.org/10.29326/2304-196X-2025-14-2-179-185
Аннотация
Введение. В настоящий момент на базе подведомственного Россельхознадзору Федерального центра охраны здоровья животных (ФГБУ «ВНИИЗЖ», г. Владимир) разработана в соответствии с требованиями законодательства Российской Федерации вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак «Карникан-5R». Для ее создания были использованы штаммы вирусов, циркулирующие на территории страны и актуальные в настоящее время.
Цель исследования. Изучение антигенных свойств вакцины «Карникан-5R» на целевых животных: определение срока формирования гуморального иммунитета и продолжительности иммунитета на протяжении периода наблюдения.
Материалы и методы. В исследовании использовали ассоциированную вакцину «Карникан-5R», состоящую из двух компонентов: лиофилизированного и жидкого. В качестве животных моделей для изучения антигенных свойств препарата служили собаки 10–12-недельного возраста. Уровень антител оценивали в реакции нейтрализации, реакции торможения гемагглютинации и реакции нейтрализации методом FAVN (Fluorescent Antibody Virus Neutralization).
Результаты. Установлено, что вакцинация собак индуцировала выработку антител к возбудителям указанных инфекций. Двукратное введение вакцины «Карникан-5R» с интервалом 21 сут стимулировало формирование напряженного гуморального ответа к 35-м сут после первого введения и прирост титра антител к вирусу чумы плотоядных в 8,6 раза, к парвовирусу собак типа 2 – в 2,1 раза, к коронавирусу собак – в 5,0 раза, к аденовирусу собак серотипа 2 – в 5,36 раза, к вирусу бешенства – в 5,72 раза. Продолжительность специфического иммунитета составила не менее 12 мес. с сохранением протективного уровня титра вирусспецифических антител к указанным возбудителям.
Заключение. Вакцина «Карникан-5R» безвредна и ареактогенна для целевых животных, способствует формированию у собак напряженного иммунитета продолжительностью не менее 12 мес. с момента бустерной вакцинации.
Ключевые слова
Для цитирования:
Климова А.А., Комарова А.А., Киселев А.М., Галкина Т.С. Изучение антигенных свойств вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак. Ветеринария сегодня. 2025;14(2):179-185. https://doi.org/10.29326/2304-196X-2025-14-2-179-185
For citation:
Klimova A.A., Komarova A.A., Kiselev A.M., Galkina T.S. Testing of vaccine against canine distemper, parvovirus and coronavirus enteritis, adenovirus infection and dog rabies for its antigenic properties. Veterinary Science Today. 2025;14(2):179-185. https://doi.org/10.29326/2304-196X-2025-14-2-179-185
ВВЕДЕНИЕ
Вирус чумы плотоядных (canine distemper virus, CDV) поражает некоторые виды животных отряда плотоядных, в числе которых представители псовых, енотовых, кошачьих и др., а также панды. Возбудитель политропен – может затрагивать практически все системы организма. Согласно международной классификации, вирус относится к отряду Mononegavirales, семейству Paramyxoviridae, подсемейству Orthoparamyxovirinae, роду Morbillivirus, виду Morbillivirus canis [1][2].
Парвовирус собак типа 2 (canine parvovirus type 2, CPV-2) – возбудитель парвовирусного энтерита и основная причина гибели собак от вирусных болезней; чрезвычайно заразен. Клиническими признаками заболевания являются: острый гастроэнтерит, отслоение и геморрагическое воспаление слизистой оболочки толстого кишечника, геморрагическая диарея, эксикоз, лейкопения и нейтропения [2]. Вирус принадлежит к отряду Piccovirales, семейству Parvoviridae, подсемейству Parvovirinae, роду Protoparvovirus, виду Protoparvovirus carnivoran 1 [1].
Вирус коронавирусного энтерита собак (canine coronavirus, CCoV) вызывает энтерит с характерными признаками, среди которых анорексия, рвота, диарея, лимфопения, летаргия [3][4][5][6]. Проявление болезни варьирует от бессимптомного течения до летального исхода [7]. По уровню встречаемости среди энтеропатогенов вирусного происхождения коронавирус занимает второе место в мире [8][9][10]. Возбудитель относится к отряду Nidovirales, подотряду Cornidovirineae, семейству Coronaviridae, подсемейству Orthocoronavirinae, роду Alphacoronavirus [1].
Аденовирус собак серотипа 2 (canine adenovirus serotype 2, CAV-2) вызывает инфекционный ларинготрахеит, проявляющийся в транзиторной, бессимптомной или легкой формах; может вызвать тяжелый некротизирующий бронхит, интерстициальную пневмонию [11], диарею [12] и поражение центральной нервной системы [2]. Вирус относится к отряду Rowavirales, семейству Adenoviridae, роду Mastadenovirus, виду Mastadenovirus canidae, серотипу 2 [1].
Вирус бешенства (rabies virus, RABV) поражает центральную нервную систему у теплокровных животных и человека, заболевание приводит к летальному исходу [13][14]. Лечение не разработано. Вирус относится к отряду Mononegavirales, семейству Rhabdoviridae, подсемейству Alpharhabdovirinae, роду Lyssavirus [1][15][16].
Штаммовый состав ассоциированной вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак «Карникан-5R» был подобран согласно руководству, опубликованному Группой по составлению руководств по вакцинации (Vaccination Guidelines Group, VGG) Международной ветеринарной ассоциации мелких домашних животных (World Small Animal Veterinary Association, WSAVA). К базовым вирусным болезням, профилактика которых должна осуществляться вне зависимости от географического положения животного, относят: чуму плотоядных, парвовирусный энтерит и аденовирусную инфекцию (возбудитель CAV-2) собак. Вакцинопрофилактика лептоспироза в руководстве классифицирована как дополнительная [17]. Иммунизация против бешенства урегулирована законодательством Российской Федерации [18][19], в связи с этим в состав вакцины был включен штамм вируса этой болезни. Однако данное руководство не является обязательным, и схемы вакцинации определяются ветеринарными врачами согласно распространенности вирусных заболеваний в конкретном регионе. Ввиду возрастающего числа случаев летального исхода в популяции собак вследствие переболевания коронавирусным энтеритом [5][6][10] в состав вакцины также включили штамм возбудителя указанного заболевания.
График иммунизации собак был составлен исходя из научных данных о гуморальном иммунитете и рекомендаций WSAVA. В среднем ветеринарные врачи по всему миру рекомендуют начинать вакцинацию собак в 12-недельном возрасте, бустерную вакцинацию проводить в 16-недельном возрасте и далее в зависимости от благополучия региона по вирусным болезням один раз в год или один раз в 3 года пожизненно [17].
Предварительно в процессе разработки вакцины «Карникан-5R», помимо изучения свойств вирусов и определения соотношения компонентов в препарате, были проведены эксперименты на лабораторных животных по определению ареактогенности и безвредности, а также опыт по подбору оптимальной иммунизирующей дозы и способа введения. При этом были получены следующие данные: вакцина ареактогенна и безвредна, иммунизирующая доза – 1,0 см³ (жидкий компонент является разбавителем для лиофилизированного), способ введения – подкожный или внутримышечный. Срок хранения после объединения компонентов составил 2 ч при температуре 18–25 °С.
Для оценки антигенных свойств вакцины были запланированы и проведены опыты на целевых животных по изучению формирования гуморального иммунитета и длительности сохранения вирусспецифических антител после введения препарата в течение периода наблюдения (12 мес.).
Целью исследований являлось изучение антигенных свойств вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак на целевых животных. В процессе исследования были решены следующие задачи: получение качественного иммунобиологического препарата, соответствующего заявленным параметрам, разработка программ опытов, проведение опытов, постановка серологических реакций для оценки уровня антител до и после вакцинации, обработка и структурирование полученных данных.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование антигенных свойств вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак «Карникан-5R» было проведено согласно требованиям приказа Минсельхоза России от 06.03.2018 № 101 «Об утверждении правил проведения доклинического исследования лекарственного средства для ветеринарного применения, клинического исследования лекарственного препарата для ветеринарного применения, исследования биоэквивалентности лекарственного препарата для ветеринарного применения».
Вакцина. Разработанная Федеральным центром охраны здоровья животных (ФГБУ «ВНИИЗЖ») вакцина «Карникан-5R» включает 2 компонента: лиофилизированный (содержит аттенуированный вирус чумы плотоядных), жидкий (включает инактивированные парвовирус, коронавирус, аденовирус и вирус бешенства собак). Препарат зарегистрирован в РФ, на изобретение получен патент [20].
Действующим веществом лиофилизированного компонента вакцины является аттенуированный штамм «Рокборн» CDV; жидкого компонента – инактивированные аминоэтилэтиленимином штамм «Грей» CPV-2, штамм «Рич» CCoV, штамм «Юнити» CAV-2, штамм «ВНИИЗЖ» RABV. В качестве целевой добавки для лиофилизированного компонента использованы стабилизаторы: гидролизат лактальбумина, сахароза и желатоза; для жидкого компонента – адъювант гидроокись алюминия. Все компоненты вакцины прошли всесторонний входной контроль качества. Одна иммунизирующая доза препарата содержит не менее 3,0 lg ТЦД50/см³ аттенуированного CDV и инактивированные вирусы CPV-2 (титр вируса до инактивации не менее 7,0 log2, ГАЕ 1:128), CCoV (титр вируса до инактивации не менее 3,0 lg ТЦД50/см³), CAV-2 (титр вируса до инактивации не менее 3,0 lg ТЦД50/см³), RABV (титр вируса до инактивации не менее 1,0 МЕ/см³).
Животные. Клинические исследования проводились с использованием собак 10–12-недельного возраста (n = 35).
Животные содержались в условиях приютов, ветеринарных клиник и индивидуально в частном владении. Состояние здоровья собак оценивалось до начала исследования и в течение всего периода наблюдения.
Для оценки эффективности вакцины «Карникан-5R» проводили двукратную иммунизацию щенков с интервалом 21 сут; препарат вводили внутримышечно в каудопроксимальную часть тазовой конечности в объеме одной иммунизирующей дозы.
Все эксперименты осуществляли в соответствии с требованиями стандартов ФГБУ «ВНИИЗЖ» СТО 00495527-0002 «Животные лабораторные. Использование для контроля и экспериментов» и СТО 00495527-0230 «Доклинические исследования лекарственных средств для ветеринарного применения».
Серологические исследования. Исследование сывороток крови собак для определения уровня антител к CDV, CCoV, CAV-2 проводили с использованием реакции нейтрализации (РН) в микропланшетах [21][22][23], к RABV – с помощью реакции нейтрализации методом Fluorescent Antibody Virus Neutralization (РН FAVN) и к CPV-2 – в реакции торможения (ингибирования) гемагглютинации (РТГА) согласно утвержденным методическим рекомендациям [24].
Статистический анализ результатов. Обработка полученных данных производилась с использованием статистических методов в программе Microsoft Exсel. Расчет титра специфических антител осуществляли по формуле Кербера и выражали в логарифмах с основанием 2 (log2).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После вакцинации изменений температуры тела, ухудшения общего физиологического состояния организма, анорексии и местной реакции в области введения вакцины не отмечали. Признаков заболевания чумой плотоядных, парвовирусным и коронавирусным энтеритом, аденовирусной инфекцией собак и бешенством также не было зафиксировано.
При исследовании сывороток крови щенков до вакцинации среднегрупповой уровень специфических антител к CDV, CCoV, CAV-2 составлял < 1,0 log2 (в РН); к CPV-2 – 4,23 ± 0,63 log2 (в РТГА); к RABV – < 0,5 log2 (в РН FAVN).
На рисунке 1 представлена динамика формирования гуморального иммунитета у собак после введения вакцины «Карникан-5R». Было установлено, что вакцинация индуцировала выработку вирусспецифических антител к CDV, CPV-2, CCoV, CAV-2 и RABV. Через 21 сут после первичной иммунизации уровень антител к CDV составлял 4,00 ± 0,25 log2; к CPV-2 – 5,67 ± 0,58 log2; к CCoV – 2,67 ± 0,14 log2; к CAV-2 – 2,83 ± 0,14 log2; к RABV – 0,82 ± 0,03 log2, что достоверно выше пороговых значений.
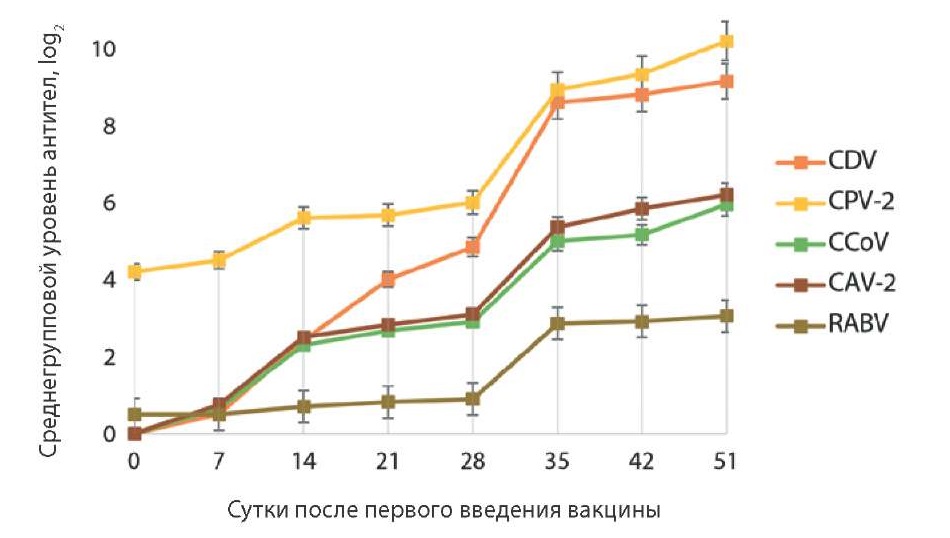
Рис. 1. Формирование гуморального иммунитета у собак после введения препарата «Карникан-5R»
Fig. 1. Development of humoral immunity in dogs after “Carnican-5R” vaccine administration
Среднегрупповые титры вирусспецифических антител на 7, 14, 21 и 35-е сут были выше титров, установленных до начала иммунизации собак. На 35-е сут регистрировали достоверно более высокий уровень вирусспецифических антител, чем в предыдущих точках контроля (р ≥ 0,1), который к CDV составил 8,60 ± 0,14 log2; к CPV-2 – 8,93 ± 0,58 log2; к CCoV – 5,0 ± 0,25 log2; к CAV-2 – 5,36 ± 0,14 log2; к RABV – 2,86 ± 0,07 log2. Показатели уровня антител демонстрировали «эффект плато» с 42-х и с 51-х сут. На основании полученных данных был сделан вывод о том, что двукратное введение вакцины «Карникан-5R» с интервалом 21 сут стимулировало формирование напряженного гуморального ответа к 35-м сут после первого введения. Таким образом, рекомендованной схемой вакцинации собак против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак и бешенства является: начало вакцинации – с 10–12-недельного возраста, бустерная иммунизация – через 21 сут, далее – ежегодная иммунизация. Схема вакцинации взрослых животных аналогична и не зависит от возраста собаки.
На следующем этапе была изучена длительность иммунитета после двукратной вакцинации против чумы плотоядных, парвовирусного и коронавирусного энтеритов собак, аденовирусной инфекции собак и бешенства. Для этого в течение 12 мес. (срок наблюдения) у животных производили отбор проб крови каждые 30 дней.
Как показано на рисунке 2, продолжительность иммунитета к возбудителям указанных заболеваний составила не менее 12 мес. На момент бустерной вакцинации через год после начала иммунизации собак было отмечено незначительное снижение уровня специфических антител. Однако, согласно опубликованным результатам исследований, протективный уровень антител к CDV составляет 2–4 log2 [25][26]. Двукратное введение вакцины индуцировало прирост антител до 9,15 ± 0,14 log2, минимальное значение за период наблюдения составило 7,75 ± 0,14 log2. Уровень антител для защиты собак от заболевания парвовирусным энтеритом должен быть не ниже 4 log2 [25][26][27][28][29][30][31]. После двукратной вакцинации максимальный уровень антител к CPV-2 составил 10,40 ± 0,58 log2, минимальный – 9,0 ± 0,28 log2. Двукратная иммунизация стимулировала прирост антител к CAV-2 до 6,35 ± 0,25 log2, в течение 12 мес. минимальное значение регистрировали на уровне 5,90 ± 0,14 log2. Протективный уровень вирусспецифических антител к CCoV достоверно не установлен, однако титр антител после второго введения вакцины превышал 5,95 ± 0,14 log2, а минимальный – составлял 5,08 ± 0,28 log2, что позволяет сделать предположение о защите животных от заболевания [32]. Согласно научным данным и требованиям Всемирной организации здравоохранения животных, вакцина против бешенства должна обеспечивать выработку антирабических антител в титре ≥ 0,5 МЕ/см³ [14][33]. В нашем случае после иммунизации максимальный титр антител к RABV был равен 3,69 МЕ/см³, минимальный – 2,6 МЕ/см³.
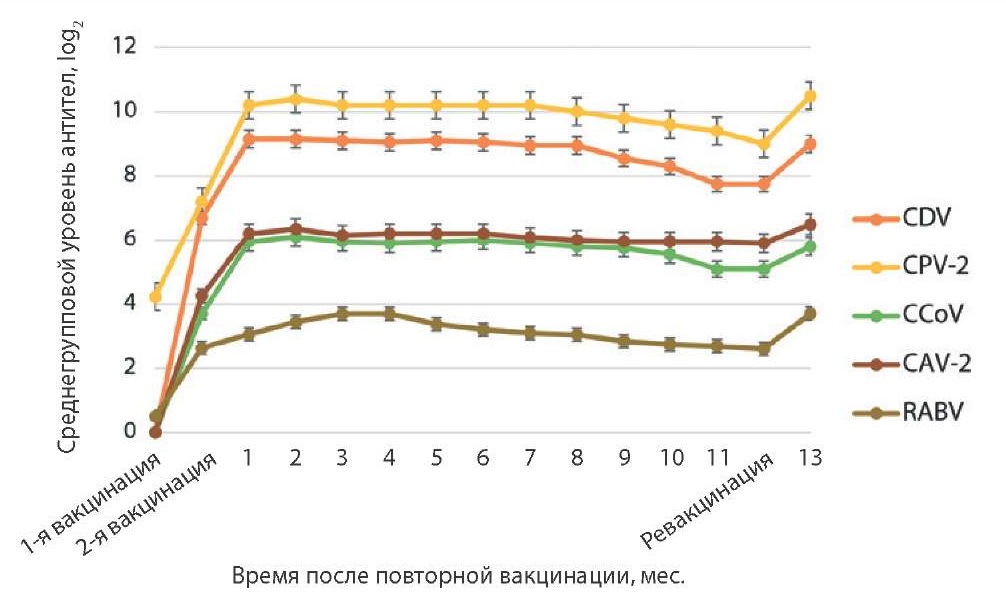
Рис. 2. Продолжительность иммунитета у собак после двукратного введения препарата «Карникан-5R»
Fig. 2. Duration of the immunity in dogs after double “Carnican-5R” vaccine administration
В течение года в среднем титр антител к CDV составил 8,74 ± 0,53 log2, к CPV-2 – 9,95 ± 0,42 log2, к CCoV – 5,75 ± 0,34 log2, к CAV-2 – 6,09 ± 0,14 log2, к RABV – 3,12 ± 0,37 МЕ/см³. Таким образом, вакцина «Карникан-5R» обеспечивает образование гуморальных антител к вирусам чумы плотоядных, парвовирусного и коронавирусного энтеритов собак, аденовирусу собак серотипа 2 и вирусу бешенства.
ЗАКЛЮЧЕНИЕ
В процессе исследования были изучены антигенные свойства вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак. На основании полученных данных установлено, что препарат «Карникан-5R» индуцирует сероконверсию у целевых животных. При двукратном введении вакцины с интервалом 21 сут продолжительность иммунитета составляет не менее 12 мес. Иммунный ответ формируется через 21 сут после двукратного введения препарата. Уровень титра антител через 1 мес. после бустерной вакцинации к CDV составил в среднем 9,15 log2 (в РН), к CPV-2 – 10,2 log2 (в РТГА), к CCoV – 5,95 log2 (в РН), к CAV-2 – 6,2 log2 (в РН), к RABV – 3,05 МЕ/см³ (в РН FAVN). Уровень антител к указанным вирусам у собак выше протективного, что обеспечивает защиту организма животного от перечисленных инфекций.
Вакцина ареактогенна и безвредна, не вызывает выраженной местной реакции при внутримышечном или подкожном введении и не оказывает отрицательного действия на физиологическое состояние животных. Препарат провоцирует выраженный иммунный ответ в виде образования вирусспецифических антител в защитных титрах.
Разработанная в ФГБУ «ВНИИЗЖ» ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак «Карникан-5R» может использоваться для специфической профилактики вирусных болезней у собак. Препарат прошел контроль в ФГБУ «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») и зарегистрирован на территории РФ.
Вклад авторов: Климова А. А. – проведение исследований, систематизация результатов, анализ литературы, написание текста; Комарова А. А. – вирусологические исследования, обработка биологического материала, анализ и интерпретация данных; Киселев А. М. – вирусологические исследования, обработка биологического материала; Галкина Т. С. – идея и дизайн исследования, утверждение окончательного варианта статьи.
Contribution of the authors: Klimova A. A. – testing, test result systematization, literature data analysis, paper writing; Komarova A. A. – virological tests, biological sample processing, data analysis and interpretation; Kiselev A. M. – virological tests, biological sample processing; Galkina T. S. – study idea and design, paper review and editing.
Список литературы
1. International Committee on Taxonomy of Viruses: ICTV. https://ictv.global/taxonomy
2. Шевченко А. А., Зеркалев Д. Ю., Шевченко Л. В., Черных О. Ю., Горпинченко Е. А. Инфекционные болезни мелких домашних животных: учебное пособие. Краснодар: КубГАУ; 2018. 107 с.
3. Pratelli A., Tempesta M., Elia G., Martella V., Decaro N., Buonavoglia C. The knotty biology of canine coronavirus: a worrying model of coronaviruses’ danger. Research in Veterinary Science. 2022; 144: 190–195. https://doi.org/10.1016/j.rvsc.2021.11.014
4. Parkhe P., Verma S. Evolution, interspecies transmission, and zoonotic significance of animal coronaviruses. Frontiers in Veterinary Science. 2021; 8:719834. https://doi.org/10.3389/fvets.2021.719834
5. Decaro N., Buonavoglia C. An update on canine coronaviruses: viral evolution and pathobiology. Veterinary Microbiology. 2008; 132 (3–4): 221–234. https://doi.org/10.1016/j.vetmic.2008.06.007
6. Zappulli V., Caliari D., Cavicchioli L., Tinelli A., Castagnaro M. Systemic fatal type II coronavirus infection in a dog: pathological findings and immunohistochemistry. Research in Veterinary Science. 2008; 84 (2): 278–282. https://doi.org/10.1016/j.rvsc.2007.05.004
7. Licitra B. N., Duhamel G. E., Whittaker G. R. Canine enteric coronaviruses: emerging viral pathogens with distinct recombinant spike proteins. Viruses. 2014; 6 (8): 3363–3376. https://doi.org/10.3390/v6083363
8. Alves C. D. B. T., Granados O. F. O., Budaszewski R. D. F., Streck A. F., Weber M. N., Cibulski S. P., et al. Identification of enteric viruses circulating in a dog population with low vaccine coverage. Brazilian Journal of Microbiology. 2018; 49 (4): 790–794. https://doi.org/10.1016/j.bjm.2018.02.006
9. McElligott S., Collins P. J., Sleator R. D., Martella V., Decaro N., Buonavoglia C., O’Shea H. Detection and genetic characterization of canine parvoviruses and coronaviruses in southern Ireland. Archives of Virology. 2011; 156 (3): 495–503. https://doi.org/10.1007/s00705-010-0861-3
10. Decaro N., Desario C., Billi M., Mari V., Elia G., Cavalli A., et al. Western European epidemiological survey for parvovirus and coronavirus infections in dogs. The Veterinary Journal. 2011; 187 (2): 195–199. https://doi.org/10.1016/j.tvjl.2009.10.027
11. Руководство по вирусологии: вирусы и вирусные инфекции человека и животных. Под ред. Д. К. Львова. М.: Медицинское информационное агентство; 2013. 1200 с.
12. Koptopoulos G., Cornwell H. J. C. Canine adenoviruses: a review. Veterinary Bulletin. 1981; 51 (3): 135–142. https://www.cabidigitallibrary.org/doi/pdf/10.5555/19812282132
13. Гаврилов А. В., Зотова А. В. Бешенство: учебное пособие. Благовещенск: Амурская ГМА; 2020. 38 с.
14. Rabies (infection with rabies virus and other lyssaviruses). In: WOAH Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 2023; Chapter 3.1.18. https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/3.01.19_RABIES.pdf
15. Tordo N., Poch O. Structure of rabies virus. In: Rabies. Developments in Veterinary Virology. Ed. by J. B. Campbell, K. M. Charlton. Boston: Springer; 1988; 7: 25–45. https://doi.org/10.1007/978-1-4613-1755-5_2
16. Kuzmin I. V., Tordo N. Genus Lyssavirus. In: Rhabdoviruses: Molecular Taxonomy, Evolution, Genomics, Ecology, HostVector Interactions, Cytopathology and Control. Ed. by R. G. Dietzgen, I. V. Kuzmin. Norfolk: Caister Academic Press; 2012; Chapter 5: 37–57.
17. Сквайрс Р. А., Кроуфорд С., Маркондес М., Уитли Н. Руководство по вакцинации собак и кошек 2024 г., составленное Группой по составлению руководств по вакцинации (VGG) Всемирной ассоциации ветеринарии мелких домашних животных (WSAVA). https://wsava.org/wp-content/uploads/2024/12/WSAVA-Vaccination-guidelines-2024_rus-compressed.pdf
18. Ветеринарные правила осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов бешенства: утверждены приказом Минсельхоза России от 25.11.2020 № 705 (с изменениями и дополнениями от 24.08.2021). https://base.garant.ru/75095535/#friends
19. WSAVA and OIE call for action on rabies. Veterinary Record. 2013; 173 (19): 463–464. https://doi.org/10.1136/vr.f6792
20. Галкина Т. С., Комарова А. А., Климова А. А., Доронин М. И., Борисов А. В., Михалишин Д. В. Ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак. Патент № 2817255 Российская Федерация, МПК A61K 39/12 (2006.01), C12N 7/00 (2006.01), А61К 39/12 (2024.01), C12N 7/00(2024.01). ФГБУ «Федеральный центр охраны здоровья животных». № 2023115792. Заявл. 15.06.2023. Опубл. 12.04.2024. Бюл. № 11.
21. Климова А. А., Комарова А. А., Киселев А. М., Галкина Т. С. Методические рекомендации по титрованию вируса аденовироза собак микрометодом: № 35-22. Владимир: ФГБУ «ВНИИЗЖ»; 2022. 22 с.
22. Комарова А. А., Галкина Т. С., Киселев А. М., Климова А. А. Методические рекомендации по титрованию вируса коронавирусного энтерита собак микрометодом: № 37-22. Владимир: ФГБУ «ВНИИЗЖ»; 2022. 20 с.
23. Киселев А. М., Комарова А. А., Галкина Т. С., Климова А. А. Методические рекомендации по титрованию вируса чумы плотоядных микрометодом: № 36-22. Владимир: ФГБУ «ВНИИЗЖ»; 2022. 20 с.
24. Климова А. А., Комарова А. А., Киселев А. М., Галкина Т. С. Методические рекомендации по титрованию возбудителя парвовирусного энтерита собак микрометодом в РГА: № 38-22. Владимир: ФГБУ « ВНИИЗЖ»; 2022. 20 с.
25. Böhm M., Herrtage M. E., Thompson H., Weir A., Hasted A. M., Maxwell N. S., Serum antibody titres to canine parvovirus, adenovirus and distemper virus in dogs in the UK which had not been vaccinated for at least three years. Veterinary Record. 2004; 154 (15): 457–463. https://doi.org/10.1136/vr.154.15.457
26. Gray L. K., Crawford P. C., Levy J. K., Dubovi E. J. Comparison of two assays for detection of antibodies against canine parvovirus and canine distemper virus in dogs admitted to a Florida animal shelter. Journal of the American Veterinary Medical Association. 2012; 240 (9): 1084–1087. https://doi.org/10.2460/javma.240.9.1084
27. Abdelmagid O. Y., Larson L., Payne L., Tubbs A., Wasmoen T., Schultz R. Evaluation of the efficacy and duration of immunity of a canine combination vaccine against virulent parvovirus, infectious canine hepatitis virus, and distemper virus experimental challenges. Veterinary Therapeutics. 2004; 5 (3): 173–186. https://www.researchgate.net/publication/8150149
28. Mouzin D. E., Lorenzen M. J., Haworth J. D., King V. L. Duration of serologic response to five viral antigens in dogs. Journal of the American Veterinary Medical Association. 2004; 224 (1): 55–60. https://doi.org/10.2460/javma.2004.224.55
29. Schultz R. D., Thiel B., Mukhtar E., Sharp P., Larson L. J. Age and long-term protective immunity in dogs and cats. Journal of Comparative Pathology. 2010; 142 (Suppl. 1): S102–S108. https://doi.org/10.1016/j.jcpa.2009.10.009
30. Schultz R. D. Duration of immunity for canine and feline vaccines: a review. Veterinary Microbiology. 2006; 117 (1): 75–79. https://doi.org/10.1016/j.vetmic.2006.04.013
31. Canine enteric viral infections. In: Sykes J. E., Greene C. E. Infectious Diseases of the Dog and Cat. 4th ed. Elsevier; 2011; Chapter 8: 67–80.
32. Pratelli A., Tinelli A., Decaro N., Martella V., Camero M., Tempesta M., et al. Safety and efficacy of a modified-live canine coronavirus vaccine in dogs. Veterinary Microbiology. 2004; 99 (1): 43–49. https://doi.org/10.1016/j.vetmic.2003.07.009
33. Cliquet F., Aubert M., Sagné L. Development of a fluorescent antibody virus neutralisation test (FAVN test) for the quantitation of rabies-neutralising antibody. Journal of Immunological Methods. 1998; 212 (1): 79–87. https://doi.org/10.1016/s0022-1759(97)00212-3
Об авторах
А. А. КлимоваРоссия
Климова Анастасия Антоновна, ветеринарный врач лаборатории профилактики болезней мелких домашних животных,
мкр. Юрьевец, г. Владимир, 600901.
А А Комарова
Россия
Комарова Анна Александровна, ведущий ветеринарный врач лаборатории профилактики болезней мелких домашних животных,
мкр. Юрьевец, г. Владимир, 600901.
А. М. Киселев
Россия
Киселев Алексей Максимович, ветеринарный врач лаборатории профилактики болезней мелких домашних животных,
мкр. Юрьевец, г. Владимир, 600901.
Т. С. Галкина
Россия
Галкина Татьяна Сергеевна, канд. вет. наук, заведующий лабораторией профилактики болезней мелких домашних животных,
мкр. Юрьевец, г. Владимир, 600901.
Рецензия
Для цитирования:
Климова А.А., Комарова А.А., Киселев А.М., Галкина Т.С. Изучение антигенных свойств вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак. Ветеринария сегодня. 2025;14(2):179-185. https://doi.org/10.29326/2304-196X-2025-14-2-179-185
For citation:
Klimova A.A., Komarova A.A., Kiselev A.M., Galkina T.S. Testing of vaccine against canine distemper, parvovirus and coronavirus enteritis, adenovirus infection and dog rabies for its antigenic properties. Veterinary Science Today. 2025;14(2):179-185. https://doi.org/10.29326/2304-196X-2025-14-2-179-185



































