Перейти к:
Вирулицидная активность дезинфицирующих препаратов в отношении возбудителя африканской чумы свиней
https://doi.org/10.29326/2304-196X-2025-14-2-156-163
Аннотация
Введение. Наиболее эффективной стратегией борьбы с африканской чумой свиней остается проведение комплекса противоэпизоотических мероприятий, направленных на предотвращение заноса и распространение возбудителя данной болезни. В настоящее время существует широкий спектр коммерческих дезинфицирующих средств, применяемых на объектах ветеринарного надзора, эффективность которых в отношении вируса африканской чумы свиней неизвестна и подтверждается только заверениями производителей, которые не всегда предоставляют обоснованные доказательства.
Цель исследования. Лабораторные испытания вирулицидной активности различных дезинфицирующих препаратов в отношении возбудителя африканской чумы свиней.
Материалы и методы. Исследовано 12 образцов дезинфицирующих средств с различным химическим составом. Первый этап по оценке свойств in vitro проводили суспензионным методом путем добавления к жидкофазному вируссодержащему материалу рабочих растворов испытуемых препаратов в экспериментальных концентрациях и при различном времени экспозиции. Второй этап осуществлялся посредством тестирования смывов с контаминированных вирусом африканской чумы свиней тест-пластин из бетона после их обработки рабочими растворами дезсредств. Каждый этап проводили в двух вариантах: без органического загрязнения и с его имитацией (экспозиция инактивированной сыворотки крови крупного рогатого скота на тест-поверхности). Образцы исследовали методом вирусовыделения в чувствительной культуре клеток селезенки свиньи. Учет и интерпретацию результатов проводили в реакции гемадсорбции. Считали, что образец препарата обладал вирулицидной активностью при отсутствии репродукции вируса африканской чумы свиней.
Результаты. Вирулицидным эффектом в отношении референтного штамма Arm 07 вируса африканской чумы свиней (II генотип) при испытаниях на тест-поверхностях обладали 9 из 12 испытуемых препаратов, что свидетельствует о необходимости проведения дальнейших исследований по оценке действенности различных дезинфицирующих средств в отношении данного возбудителя.
Заключение. Возможность присутствия в коммерческом обороте дезсредств, неспособных при заявленных в инструкции условиях инактивировать вирус африканской чумы свиней, подчеркивает необходимость совершенствования нормативно-правовых актов в целях обеспечения эффективности мер общей профилактики и борьбы с болезнью.
Ключевые слова
Для цитирования:
Лаврентьев И.А., Иголкин А.С., Шевцов А.А., Колбин И.С., Пузанкова О.С., Гаврилова В.Л., Чернышев Р.С. Вирулицидная активность дезинфицирующих препаратов в отношении возбудителя африканской чумы свиней. Ветеринария сегодня. 2025;14(2):156-163. https://doi.org/10.29326/2304-196X-2025-14-2-156-163
For citation:
Lavrentiev I.A., Igolkin A.S., Shevtsov A.А., Kolbin I.S., Puzankova O.S., Gavrilova V.L., Chernyshev R.S. Virucidal activity of disinfectants against African swine fever virus. Veterinary Science Today. 2025;14(2):156-163. https://doi.org/10.29326/2304-196X-2025-14-2-156-163
ВВЕДЕНИЕ
Несмотря на предпринимаемые усилия по профилактике распространения африканской чумы свиней (АЧС) на территории Российской Федерации, риски заноса инфекции в свиноводческие хозяйства страны остаются высокими. Ущерб, причиняемый болезнью, значителен. Так, совокупные потери от АЧС в России за 2018–2020 гг. составили 32 571,6 млн руб. [1].
В сложившихся условиях особую значимость имеет биологическая защита свиноводческих хозяйств всех типов – комплекс управленческих и физических мероприятий, направленных на снижение риска заноса, укоренения и распространения болезни [2][3].
При несоблюдении или несовершенстве регламента биозащиты увеличивается вероятность заноса возбудителей опасных болезней, включая АЧС. Поэтому во всех свиноводческих хозяйствах и на предприятиях по убою свиней и переработке продуктов убоя важна организация действенных заградительных мер (сегрегация, очистка, дезинфекция) с учетом возможности проникновения инфекции как с источниками вируса (инфицированными животными), так и с контаминированными объектами окружающей среды (транспорт, одежда и обувь персонала, расходные материалы и оборудование).
В случае возникновения АЧС ветеринарными правилами регламентирована организация ветеринарных постов для обработки транспорта на выезде из очага, угрожаемой зоны и проведение трехэтапной дезинфекции в эпизоотическом очаге для предотвращения распространения инфекции [4]. В п. 49 упомянутых правил указано, что для дезинфекции объектов должны применяться хлорсодержащие (с содержанием действующего вещества не менее 25%) или другие дезинфицирующие растворы, обладающие высокой вирулицидной активностью в отношении возбудителя, согласно инструкциям по применению. Однако далеко не во всех инструкциях к коммерческим дезсредствам представлена обоснованная информация о степени их губительного действия по отношению к возбудителям и об условиях применения, обеспечивающих их эффективность.
Все перечисленное указывает на то, что для защиты от заноса и распространения АЧС необходима организация действенных дезинфекционных мероприятий, учитывающих устойчивость конкретного возбудителя во внешней среде и продукции свиноводства, а также его толерантность к некоторым типам дезинфицирующих средств, что обусловлено сложной структурой вириона.
Устойчивость вируса АЧС в разных температурных условиях составляет: 5 °С – до 7 лет, 18–20 °С – 18 мес., 37 °С – 30 сут, 50 °С – до 1 ч. В сыворотке крови при температуре 5 °С вирус может сохраняться на протяжении 6 лет, в копченой ветчине – до 180 сут, в замороженном мясе – до 155 сут [5][6].
Данные о сохранности вируса АЧС во внешней среде и в различных экскретах инфицированных животных представлены в таблице 1.
Таблица 1
Устойчивость вируса АЧС во внешней среде согласно данным различных исследователей
Table 1
African swine fever virus resistance to the environmental factors, based on findings from independent researchers
|
Матрица |
Режим хранения |
Период наблюдения |
Ссылка на источник |
|
Фекалии |
+4 °C |
5–280 сут |
[7][8] |
|
+20 °C |
3–11 сут |
[7][9] |
|
|
Навоз |
–20 °C |
2 мес. |
[10] |
|
+4 °C |
30–145 сут |
[8][10] |
|
|
+20 °C |
21 сут |
[10] |
|
|
Моча |
–20 °C |
3 мес. |
[10] |
|
+4 °C |
5–60 сут |
[7][10] |
|
|
+20 °C |
5–21 сут |
[7][10] |
|
|
Пляжный песок |
+20 °C |
14 сут |
[7] |
|
Дворовая земля |
+20 °C |
7 сут |
[7] |
|
Болотная грязь |
+20 °C |
3 сут |
[7] |
|
Почва |
–20 °C |
2 мес. |
[10] |
|
+4 °C |
45–650 сут |
[8][10] |
|
|
+20 °C |
30–132 сут |
[8][10] |
|
|
Влажная почва |
+4 °C |
до 3 сут |
[7] |
|
+20 °C |
до 3 сут |
[7] |
|
|
Вода |
–20 °C |
3 года |
[11] |
|
+4 °C |
2–33 мес. |
[8][10][11] |
|
|
+20 °C |
2–13 мес. |
[8][10][11] |
Следует отметить, что в СанПиН 3.3686-21 вирус АЧС не упомянут, поскольку не относится к возбудителям болезней, общих для человека и животных [12]. Согласно п. 2.13.2 Правил проведения дезинфекции и дезинвазии объектов государственного ветеринарного надзора, вирус АЧС относится к устойчивым (вторая группа устойчивости из четырех, установленных правилами) [13]. В документе также представлены требования по соблюдению режимов дезинфекции в соответствии с классом устойчивости возбудителя, однако перечень упоминаемых дезсредств не включает в себя широкий спектр применяемых в настоящее время препаратов (на основе кислот, щелочей, альдегидов, соединений хлора, йода, фенолов, четвертичных аммониевых соединений), заявляемыми преимуществами которых являются относительно короткий период экспозиции, отсутствие выраженного коррозийного и токсического эффектов, усиленный эффект за счет синергии компонентов при низких концентрациях действующих веществ [14][15][16].
В «Методических указаниях по контролю качества ветеринарной дезинфекции объектов животноводства», приведенных в приложении 3 к указанным выше правилам, для контроля качества текущей дезинфекции регламентированы исследования по определению наличия или отсутствия санитарно-показательных микроорганизмов (для второй группы устойчивости: Staphylococcus aureus, S. epidermatis, S. saprophiticus) [13]. Однако, хотя устойчивость вируса АЧС и стафилококков сопоставима, она не равнозначна, что обусловлено разницей в строении конкретных возбудителей и видовых механизмах резистентности [17][18]. Так, например, основой в строении клеточной стенки грамположительных бактерий, в том числе S. aureus, являются пептидогликан и тейхоевые кислоты, в то время как внутренний кор вириона АЧС окружен плотным белковым слоем, внутренней липидной оболочкой и капсидом, который является внешним слоем у внутриклеточных вирионов. Вышеперечисленное в том числе обуславливает разницу в чувствительности к различным показателям pH; так, оптимальный диапазон для размножения стафилококков составляет 7,2–7,4, в условиях повышенной кислотности (pH < 4,5) рост бактерий замедляется, в отличие от возбудителя АЧС, который инактивируется при значениях pH < 3,9 или > 11,5 [19][20].
В связи с этим для исследовательских целей по определению дезинфицирующих свойств испытуемых средств или отдельных их компонентов больше подходит методология, разделяющая испытания по типу конкретных возбудителей (отдельно бактерии, вирусы, грибы и др.).
В рамках научно-исследовательских работ в референтной лаборатории по АЧС ФГБУ «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ») проводится изучение вирулицидной активности коммерческих дезинфицирующих средств в отношении вируса АЧС генотипа II. Испытания проходят в два этапа: in vitro с определением минимальной эффективной концентрации и экспозиции; методом орошения тест-поверхностей рабочими растворами препаратов. На всех стадиях предусмотрено применение искусственного органического загрязнения для имитации условий, приближенных к реальным.
Цель исследования – сравнительная оценка шифрованных дезинфицирующих препаратов с известным химическим составом по их вирулицидным свойствам в отношении возбудителя АЧС.
МАТЕРИАЛЫ И МЕТОДЫ
Испытаниям подвергнуты 12 дезинфицирующих средств российских производителей. Образцы препаратов шифровали перед постановкой экспериментов.
В отсутствие соответствующих ведомственных документов исследования проводились по схеме испытаний дезинфекционных средств, схожей с представленной в ГОСТ Р 58151.4-2018 и Р 4.2.3676-20, но с модификацией методологии под условия применения дезсредств в ветеринарии и адаптацией к актуальному возбудителю – вирусу АЧС [21].
Работа с вирусом АЧС и интерпретация полученных результатов выполнялась в соответствии с «Методическими рекомендациями по выделению и титрованию вируса африканской чумы свиней в культуре клеток селезенки свиней» [22].
Первый этап по оценке свойств in vitro проводили в двух вариантах: без белковой нагрузки и с добавлением инактивированной сыворотки крови крупного рогатого скота (КРС) из расчета 40%-й концентрации в смеси вируса c дезинфектантом. В качестве тест-объекта использовали 2-суточный субконфлюэнтный монослой первичной культуры клеток селезенки свиньи с добавлением поддерживающей питательной среды Игла MEM по прописи ФГБУ «ВНИИЗЖ», содержащей 10% фетальной сыворотки крови КРС.
Заражение культуры клеток проводили методом инокуляции жидкофазного материала гемадсорбирующего референс-штамма Arm 07 вируса АЧС II генотипа, депонированного в государственную коллекцию штаммов микроорганизмов ФГБУ «ВНИИЗЖ».
К образцам очищенной от клеточного детрита суспензии, содержащей штамм Arm 07 вируса АЧС в титре не менее 6,0 lg ГАдЕ50/см³, добавляли рабочий раствор испытуемых дезинфицирующих препаратов в пропорции 1:9 (1 объем вируссодержащего материала и 9 объемов средства).
Для нейтрализации действия препаратов и имитации органического загрязнения использована 70%-я инактивированная сыворотка крови КРС.
Полученные образцы (как с сывороткой, так и без нее) выдерживали при комнатной температуре в течение срока экспозиции, впоследствии нейтрализовали путем обработки образца сывороткой крови КРС в соотношении 1:1 (объем образца и нейтрализатора).
Затем образцы смеси вируса, препарата и нейтрализатора вносили в лунки планшета с монослоем чувствительной к вирусу АЧС культуры клеток селезенки свиньи, через 30 мин удаляли смесь, заменяли поддерживающей средой. Культуру клеток инкубировали в атмосфере с 5%-м содержанием СО2 в течение 7 сут при 37 °C с ежедневным контролем результатов.
Второй этап тестирования эффективности обеззараживания осуществляли способом орошения из пульверизатора рабочими растворами дезсредств тест-пластин из бетона размером 10 × 10 см. Перед экспериментом все поверхности подвергали механической очистке (мыли водой с мылом и щеткой, промывали проточной водой, после чего протирали несколько раз стерильной влажной салфеткой) и автоклавировали.
Тест-пластины располагали горизонтально и пипеткой на каждую наносили суспензию вируса АЧС в титре не менее 6,0 lg ГАдЕ50/см³ из расчета 0,5 см³/м² с добавлением 5% инактивированной сыворотки крови КРС на площадь в 100 см², равномерно распределяли по поверхности. Контаминированные вирусом поверхности высушивали при комнатной температуре, затем обрабатывали раствором испытуемого дезинфекционного препарата в минимальной эффективной на первом этапе концентрации и при минимальном времени экспозиции.
Для имитации органического загрязнения (белковой нагрузки) использовали 40%-ю инактивированную сыворотку крови КРС, которую наносили на контаминированные вирусом поверхности. Затем поверхности орошали из пульверизатора испытуемым дезинфекционным препаратом при норме расхода 0,3 л/м² обрабатываемой площади (согласно инструкциям производителей).
Контрольные тест-пластины орошали стерильной или прокипяченной водопроводной водой при той же норме расхода (0,3 л/м²), что и в опыте. Для определения полноты инактивации вируса АЧС с испытуемых поверхностей отбирали пробы-смывы с последующим нанесением их на чувствительную культуру клеток селезенки свиньи (индикацию осуществляли методом вирусовыделения с проведением трех слепых пассажей на культуре клеток каждого из образцов).
Учет результатов проводили по наличию или отсутствию феномена гемадсорбции – качественного специфического показателя репродукции вируса АЧС (рис.). Считали, что образец препарата обладал вирулицидной активностью при отсутствии гемадсорбции.
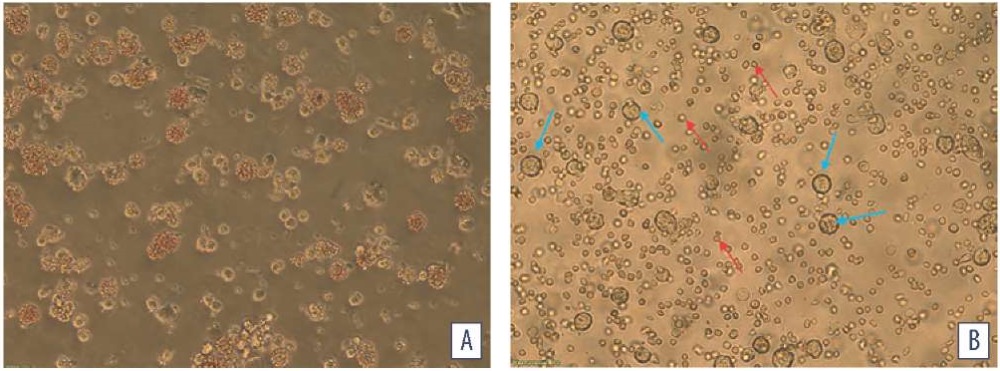
Рис. Культура клеток селезенки свиней: А – инфицированная вирусом АЧС; B – интактная (синими стрелками отмечены клетки селезенки свиней, красными – эритроциты)
Fig. Porcine spleen cell culture: A – infected with African swine fever virus; B – intact (blue arrows indicate porcine spleen cells, red – red blood cells)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты испытаний эффективности (по наличию или отсутствию вирулицидной активности) шифрованных дезинфекционных препаратов в двух последовательных этапах in vitro представлены в таблице 2.
Таблица 2
Результаты исследований вирулицидной активности дезинфекционных средств в отношении вируса АЧС в культуре клеток и на тест-поверхности из бетона
Table 2
Results of testing virucidal activity of disinfectants against African swine fever virus in cell culture and on a concrete test surface
|
Шифр препарата |
Компоненты (действующие вещества) |
Концентрация действующего вещества, % |
Экспозиция, мин |
1-й этап (суспензионный метод) |
2-й этап (орошение) |
||
|
без белковой нагрузки |
с белковой нагрузкой |
без белковой нагрузки |
с белковой нагрузкой |
||||
|
1 |
калия пероксомоносульфат |
0,55 |
30 |
+ |
+ |
+ |
+ |
|
2 |
калия пероксомоносульфат |
0,5 |
30 |
+ |
+ |
+ |
+ |
|
3 |
калия пероксомоносульфат |
1,5 |
60 |
+ |
+ |
+ |
+ |
|
4 |
диоксид хлора |
0,002 |
3 |
+ |
+ |
– |
– |
|
5 |
глутаровый альдегид |
0,0375 |
15 |
+ |
+ |
+ |
+ |
|
бензалкония хлорид |
0,025 |
||||||
|
6 |
алкилдиметилбензиламмоний хлорид |
0,03 |
30 |
+ |
+ |
+ |
+ |
|
глутаровый альдегид |
0,05 |
||||||
|
7 |
глутаровый альдегид |
0,024 |
15 |
+ |
+ |
– |
– |
|
алкилдиметилбензиламмоний хлорид |
0,01 |
||||||
|
8 |
дидецилдиметиламмоний хлорид |
0,0156 |
15 |
+ |
+ |
+ |
+ |
|
алкилдиметилбензиламмоний хлорид |
0,034 |
||||||
|
глутаровый альдегид |
0,0214 |
||||||
|
9 |
глутаровый альдегид |
2,0 |
10 |
+ |
+ |
+ |
+ |
|
алкилдиметилбензиламмоний хлорид |
1,7 |
||||||
|
дидецилдиметиламмоний хлорид |
0,8 |
||||||
|
изопропиловый спирт |
1,0 |
||||||
|
10 |
алкилдиметилбензиламмоний хлорид |
0,018 |
5 |
+ |
+ |
+ |
+ |
|
глутаровый альдегид |
0,015 |
||||||
|
формальдегид |
0,01 |
||||||
|
полигексаметиленгуанидин |
0,0006 |
||||||
|
изопропиловый спирт |
0,004 |
||||||
|
11 |
пероксисольват карбоната натрия |
0,012 |
30 60 90 |
+ + + |
+ + + |
– + + |
– + + |
|
алкилбензолсульфонат натрия |
0,75 |
||||||
|
лимонная кислота |
0,135 |
||||||
|
метиленовый синий |
0,36 |
||||||
|
углекислый натрий |
0,00015 |
||||||
|
12 |
дидецилдиметиламмоний хлорид |
0,05 |
15 |
+ |
+ |
+ |
+ |
|
алкилдиметилбензиламмоний хлорид |
0,15 |
||||||
|
глутаровый альдегид |
0,05 |
||||||
|
аминооксид |
0,05 |
||||||
|
изопропиловый спирт |
0,05 |
||||||
|
изотридеканол этоксилированный |
менее 0,05 |
||||||
|
«+» – наличие вирулицидного эффекта (отсутствие гемадсорбции); «–» – отсутствие вирулицидного эффекта (наличие гемадсорбции). “+” – virucidal effect in place (absence of hemadsorption); “–” – no virucidal effect (presence of hemadsorption). |
|||||||
Установлено, что способностью инактивировать высоковирулентный вирус АЧС референтного штамма Arm 07 во всех заявленных производителями концентрациях и экспозициях при орошении бетонных тест-поверхностей обладали девять дезинфицирующих препаратов из двенадцати.
Препараты под шифрами 1, 2 и 3, главным действующим веществом которых является калия пероксомоносульфат в концентрациях 0,55, 0,5 и 1,5% соответственно, показали активность в отношении вируса АЧС как при тестировании суспензионным методом, так и способом орошения тест-поверхностей из бетона при времени экспозиции 30 и 60 мин. Пероксомоносульфат калия способен инактивировать вирус АЧС даже при значительном органическом загрязнении, однако в таком случае концентрация его должна составлять не менее 1,0% [23]. Данные настоящего исследования демонстрируют активность препаратов на основе пероксомоносульфата калия меньшей концентрации как при белковой нагрузке, так и без нее, что может учитываться при оптимизации химического состава дезсредств.
Зашифрованный под номером 4 препарат, рабочий раствор которого представляет собой 0,002%-й диоксид хлора, обладал достаточной вирулицидной эффективностью на первом этапе исследования, однако инфекционная активность вируса АЧС сохранялась на бетонной тест-поверхности при экспозиции 3 мин. Испытуемая концентрация ClO2 превосходит рекомендуемую (0,0012%) для инактивации возбудителя АЧС, и отсутствие активности, скорее всего, связано с недостаточным временем экспозиции. Для достижения оптимального эффекта деградации вируса при нанесении диоксида хлора на поверхность следует выдерживать строгий температурно-временной режим (не менее 50 мин, 37 °C) [24].
Препараты под шифрами 5, 6, 7, 8, 9, 10 и 12 имеют в своем составе глутаровый альдегид. Дезсредство под номером 7 в эксперименте не показало выраженной вирулицидной активности, несмотря на заявленную производителем достаточно высокую концентрацию действующего вещества (0,024%) в рабочем растворе, превосходящую показатели других дезинфектантов, например зашифрованного под номером 10 и содержащего всего 0,015% глутарового альдегида, который оказался в проведенных испытаниях действенным против вируса АЧС. Доступные результаты немногочисленных исследований показывают возможность применения глутарового альдегида в концентрации 0,1% при экспозиции 30 мин [23]. Возможно, отсутствие эффекта у препарата под шифром 7 связано с недостаточным содержанием в составе вспомогательных веществ или с нарушением технологии его производства. Существенный недостаток информации о минимальной эффективной концентрации глутарового альдегида для инактивации вируса АЧС свидетельствует о необходимости проведения исследовательских работ по оценке губительного воздействия дезсредств. Следует отметить, что концентрация глутарового альдегида более 0,5% может приводить к увеличению цитотоксичности, что значительно лимитирует диапазон экспериментов [25].
Зашифрованный под номером 11 препарат, содержащий в своем составе пероксисольват карбоната натрия 0,012%, алкилбензолсульфонат натрия 0,75%, лимонную кислоту 0,135%, метиленовый синий 0,36%, углекислый натрий 0,00015%, показал частичное губительное воздействие на возбудитель. При экспозиции 30 мин в заявленных концентрациях препарат не проявил вирулицидной активности в отношении вируса АЧС, однако с пролонгированной экспозицией, а именно 60 и 90 мин, был достаточно эффективен. Отдельные компоненты, входящие в его состав, согласно литературным данным, обладают активностью в отношении возбудителя АЧС при больших концентрациях и длительной экспозиции [26]. Соединения хлора широко используются в качестве дезинфицирующих средств благодаря их высокой эффективности за счет способности к денатурации белков, однако они обладают коррозионным действием и ингибируются органическими веществами. Алкилбензолсульфонат натрия относится к анионным поверхностно-активным веществам с хорошо выраженными моющими свойствами. Вирулицидные свойства лимонной кислоты были доказаны при ее использовании в концентрации 2% при экспозиции 30 мин, эффект достигается за счет взаимодействия липофильных структур с мембраной вируса и снижения pH. Карбонат натрия также оказался эффективным в отношении вируса АЧС при концентрации 1% с экспозицией 30 мин [26].
Проведенные испытания показывают, что белковая нагрузка (как имитация органического загрязнения), короткое время экспозиции и относительно низкие температуры (рабочего раствора, обрабатываемого объекта, окружающей среды) – все это крайне важные факторы, которые способны значительно снизить эффективность дезсредств. Поэтому для практики по-прежнему большое значение имеет предварительная тщательная механическая очистка поверхностей, строгое соблюдение рекомендаций, в том числе по продолжительности экспозиции и температурному режиму, что согласуется с данными литературы [17].
ЗАКЛЮЧЕНИЕ
По результатам проведения первого этапа испытаний дезсредств в культуре клеток селезенки свиней вирулицидную активность в отношении референтного штамма Arm 07 вируса АЧС показали все 12 тестируемых препаратов, что подтверждает их эффективность in vitro и отсутствие цитотоксического действия при соблюдении заявленных концентраций и времени экспозиции.
При этом на втором этапе испытаний (с применением тест-поверхностей из бетона как с имитацией органического загрязнения, так и без нее) эффективностью обладали только 9 из 12 препаратов, что подчеркивает необходимость проведения комплексных исследований по оценке вирулицидной активности дезсредств с применением различных тест-объектов.
Для оптимизации состава компонентов дезинфицирующих средств с целью повышения их эффективности против возбудителя АЧС считаем целесообразным использовать глутаровый альдегид с концентрацией минимум 0,05%, пероксомоносульфат калия с концентрацией минимум 0,5%.
Подтверждаемое экспериментами влияние органических загрязнений на вирулицидный эффект дезсредств показывает, что при их практическом применении крайне важно проводить тщательную очистку поверхностей и подбирать наиболее эффективные средства как для дезинфекции, так и для мойки. Кроме того, требуется учитывать и другие факторы, в том числе действенный в отношении конкретного возбудителя состав и концентрацию действующих веществ дезсредства, температуру окружающего воздуха, обрабатываемых поверхностей, рабочего раствора дезинфектанта, время экспозиции, параметры сушки и др.
Практическое применение коммерческих дезсредств, вирулицидная активность которых в отношении возбудителя АЧС неизвестна, повышает риски свести на нет значительные усилия, прилагаемые при проведении профилактических и ликвидационных мероприятий, что указывает на необходимость введения в соответствующие нормативно-правовые акты требований по проведению испытаний коммерческих дезинфицирующих средств на предмет их эффективности в отношении актуальных возбудителей заразных болезней, которые заявлены в инструкции по применению препарата.
Вклад авторов: Лаврентьев И. А. – формирование идеи, развитие ключевых целей и задач, подготовка текста рукописи, проведение статистического анализа; Иголкин А. С. – формирование идеи, развитие ключевых целей и задач, утверждение окончательного варианта рукописи; Шевцов А. А. – подготовка текста рукописи; Колбин И. С. – проведение экспериментов; Пузанкова О. С. – проведение экспериментов; Гаврилова В. Л. – проведение экспериментов; Чернышев Р. С. – формирование идеи, разработка методологии, проведение экспериментов, подготовка текста рукописи.
Contribution of the authors: Lavrentiev I. A. – formulating the idea, developing key goals and objectives, preparing the manuscript, conducting statistical analysis; Igolkin A. S. – formulating the idea, developing key goals and objectives, approving of the manuscript final version; Shevtsov A. A. – preparing the manuscript text; Kolbin I. S. – conducting experiments; Puzankova O. S. – conducting experiments; Gavrilova V. L. – conducting experiments; Chernyshev R. S. – formulating the idea, developing methods, conducting experiments, preparing the manuscript text.
Список литературы
1. Петрова О. Н., Караулов А. К. Сравнительный анализ ущерба от распространения особо опасных болезней животных на территории РФ за 2018–2020 гг. с элементами прогноза на 2021 г. БИО. 2021; (5): 12–18. https://elibrary.ru/pwuhnj
2. WOAH. Terrestrial Animal Health Code. https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-code-online-access
3. WOAH. Manual of Diagnostic Test and Vaccines for Terrestrial Animals. https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access
4. Ветеринарные правила осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов африканской чумы свиней: утв. приказом Минсельхоза России от 28.01.2021 № 37. https://docs.cntd.ru/document/573473462?ysclid=m6abw80wls994110372
5. Макаров В. В., Сухарев О. И., Литвинов О. Б. Вирус африканской чумы свиней: устойчивость, выживаемость, деконтаминация. Ветеринария. 2012; (9): 23–25. https://elibrary.ru/pdslxt
6. Макаров В. В., Грубый В. А. Африканская чума свиней: эпизоотический полиморфизм и контроль. Часть II. История и география успешной эрадикации. Ветеринария сегодня. 2013; (3): 21–25. https://elibrary.ru/ ratovp
7. Sauter-Louis C., Conraths F. J., Probst C., Blohm U., Schulz K., Sehl J., et al. African swine fever in wild boar in Europe – a review. Viruses. 2021; 13 (9):1717. https://doi.org/10.3390/v13091717
8. Власов М. Е., Сливко И. А., Середа А. Д. Сохраняемость вируса африканской чумы свиней в объектах внешней среды. Ветеринария. 2018; (10): 17–22. https://doi.org/10.30896/0042-4846.2018.21.10.17-22
9. Бельтран Алькрудо Д., Ариас М., Гайардо К., Крамер А. С., Пенрит М. Л. Африканская чума свиней: обнаружение и диагностика. Руководство для ветеринаров. Рим: ФАО; 2017. 104 с. https://openknowledge.fao.org/handle/20.500.14283/i7228ru
10. Власов М. Е. Биологические свойства изолятов вируса африканской чумы свиней, выделенных в различных регионах Российской Федерации от кабанов и домашних свиней: дис. … канд. вет. наук. Вольгинский; 2021. 149 с.
11. Синдрякова И. П., Моргунов Ю. П., Чичикин А. Ю., Газаев И. Х., Кудряшов Д. А., Цыбанов С. Ж. Инфекционная активность вируса африканской чумы свиней в лабораторных образцах и пищевых продуктах при разных температурных режимах (с экстраполяцией на сохраняемость в природных условиях). Сельскохозяйственная биология. 2016; 51 (4): 467–474. https://doi.org/10.15389/agrobiology.2016.4.467rus
12. СанПиН 3.3686-21 Санитарно-эпидемиологические требования по профилактике инфекционных болезней: утв. постановлением Главного государственного санитарного врача РФ от 28.01.2021 № 4 (с изменениями на 25.05.2022). https://docs.cntd.ru/document/573660140?ysclid=m6akzus7b3685301845
13. Правила проведения дезинфекции и дезинвазии объектов государственного ветеринарного надзора: утв. Минсельхозом России 15.07.2002 № 13-5-2/0525. https://base.garant.ru/70268920/?ysclid=m6aleudxu5550644985
14. Боталова Д. П., Кузьмин В. А., Иголкин А. С., Ципле С. Ю., Касаткин А. С. Вирулицидная активность дезинфектантов «Дезон Ветклин» и «Дезон Вет» в отношении вируса африканской чумы свиней. Междун ародный вестник ветеринарии. 2022; (4): 16–23. https://doi.org/10.52419/ISSN2072-2419.2022.4.16
15. Герасимов В. Н., Кузьмин В. А., Васинский Р. Г. Современные дезинфицирующие средства в системе мер по недопущению заноса и распространения вируса африканской чумы свиней в Российской Федерации. Ветеринария Кубани. 2017; (1): 15–16. https://elibrary.ru/zduibr
16. Балышев В. М., Балышева В. И., Болгова М. В., Живодеров С. П., Селянинов Ю. О. Инактивирующее действие аэрозолей некоторых дезинфектантов на вирус африканской чумы свиней. Ветеринария. 2016; (11): 44–47. https://elibrary.ru/wzixpb
17. МУ 3.5.2431-08 Изучение и оценка вирулицидной активности дезинфицирующих средств: методические указания. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2010. 39 с.
18. Шестопалов Н. В., Пантелеева Л. Г., Соколова Н. Ф., Абрамова И. М., Лукичев С. П. Федеральные клинические рекомендации по выбору химических средств дезинфекции и стерилизации для использования в медицинских организациях. М.: Ремедиум Приволжье; 2015. 56 с. https://elibrary.ru/tytfur
19. Воробьев А. А., Кривошеин Ю. С., Широбоков В. П. Медицинская и санитарная микробиология: учебное пособие. М.: Aкадемия; 2003. 464 с.
20. Иголкин А. С., Груздев К. Н. Африканская чума свиней: учебнометодическое пособие. Владимир: ФГБУ «ВНИИЗЖ»; 2021. 126 с.
21. Методы лабораторных исследований и испытаний медико-профилактических дезинфекционных средств для оценки их эффективности и безопасности: руководство. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2010. 615 с.
22. Мазлум А., Шарыпова Д. В., Гаврилова В. Л., Пузанкова О. С., Жуков И. Ю., Аронова Е. В. и др. Методические рекомендации по выделению и титрованию вируса африканской чумы свиней в культуре клеток селезенки свиней: утв. ФГБУ «ВНИИЗЖ» 15.03.2019 № 09-19. Владимир; 2019. 24 с.
23. Juszkiewicz M., Walczak M., Mazur-Panasiuk N., Woźniakowski G. Virucidal effect of chosen disinfectants against African swine fever virus (ASFV) – preliminary studies. Polish Journal of Veterinary Sciences. 2019; 22 (4): 777–780. https://doi.org/10.24425/pjvs.2019.131407
24. Wei R., Wang X., Liu X., Guo C. Chlorine dioxide inhibits African swine fever virus by blocking viral attachment and destroying viral nucleic acids and proteins. Frontiers in Veterinary Science. 2022; 9:844058. https://doi.org/10.3389/fvets.2022.844058
25. Juszkiewicz M., Walczak M., Mazur-Panasiuk N., Woźniakowski G. Effectiveness of chemical compounds used against African swine fever virus in commercial available disinfectants. Pathogens. 2020; 9 (11):878. https://doi.org/10.3390/pathogens9110878
26. Beato M. S., D’Errico F., Iscaro C., Petrini S., Giammarioli M., Feliziani F. Disinfectants against African swine fever: an updated review. Viruses. 2022; 14 (7):1384. https://doi.org/10.3390/v14071384
Об авторах
И. А. ЛаврентьевРоссия
Лаврентьев Иван Андреевич, ведущий ветеринарный врач референтной лаборатории по африканской чуме свиней,
мкр. Юрьевец, г. Владимир, 600901.
А. С. Иголкин
Россия
Иголкин Алексей Сергеевич, канд. вет. наук, заведующий референтной лабораторией по африканской чуме свиней,
мкр. Юрьевец, г. Владимир, 600901.
А. А. Шевцов
Россия
Шевцов Александр Анатольевич, канд. вет. наук, ведущий научный сотрудник информационно-аналитического центра,
мкр. Юрьевец, г. Владимир, 600901.
И. С. Колбин
Россия
Колбин Иван Сергеевич, младший научный сотрудник референтной лаборатории по африканской чуме свиней,
мкр. Юрьевец, г. Владимир, 600901.
О. С. Пузанкова
Россия
Пузанкова Ольга Сергеевна, канд. вет. наук, старший научный сотрудник референтной лаборатории по африканской чуме свиней,
мкр. Юрьевец, г. Владимир, 600901.
В. Л. Гаврилова
Россия
Гаврилова Вера Львовна, канд. биол. наук, научный сотрудник референтной лаборатории по африканской чуме свиней,
мкр. Юрьевец, г. Владимир, 600901.
Р. С. Чернышев
Россия
Чернышев Роман Сергеевич, младший научный сотрудник референтной лаборатории по африканской чуме свиней,
мкр. Юрьевец, г. Владимир, 600901.
Рецензия
Для цитирования:
Лаврентьев И.А., Иголкин А.С., Шевцов А.А., Колбин И.С., Пузанкова О.С., Гаврилова В.Л., Чернышев Р.С. Вирулицидная активность дезинфицирующих препаратов в отношении возбудителя африканской чумы свиней. Ветеринария сегодня. 2025;14(2):156-163. https://doi.org/10.29326/2304-196X-2025-14-2-156-163
For citation:
Lavrentiev I.A., Igolkin A.S., Shevtsov A.А., Kolbin I.S., Puzankova O.S., Gavrilova V.L., Chernyshev R.S. Virucidal activity of disinfectants against African swine fever virus. Veterinary Science Today. 2025;14(2):156-163. https://doi.org/10.29326/2304-196X-2025-14-2-156-163



































